Пиролиз метилпентена
Третьей стадией современного синтеза изопрена является пиролиз 2-метилпентена-2 в изопрен и метан. Для этого' требуются высокие температуры и короткое время контакта. Благодаря резонансу изопрен сравнительно стабилен. При удачном подборе условий реакции можно избежать образования ароматических веществ и нежелательных промежуточных продуктов типа ацетилена.
|
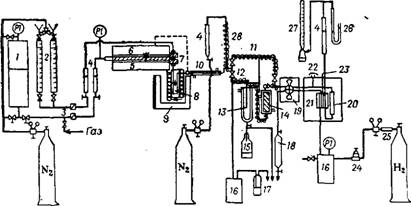
Рис. 60. Схема лабораторной установки для пиролиза: 1 — сборник с дистиллированной водой; 2 — бюретки для реактивов с воронками для заполнения; 3 — фильтры; 4 — расходомеры жидкости; 5 — подогреватель; « — подогревательная труба из нержавеющей стали, заполненная стружкой из нержавеющей стали; 7 — смеситель; 8 — реактор; 9 — тигельная печь; 10 — холодильник Либиха (максимальная температура 70 °С); 11 — медная трубка, обмотанная нагревательной проволокой; 12 — газопровод, обмотанный нагревательной лентой; 13 — водоотделитель (температура 40 °С); 14 — сушильная башня с ВаО (температура 40 °С); 15 — водосборник; 16 — буферная емкость; 17 — ртутный затвор; 18 — баллон для проб газа; 19 — восьмиходовой кран с трубкой для проб газа в термостате при 40 °С; 20 — колонка для газо-жидкостной хроматографии; 21 — катарометр в термостате при 40 °С; 22 — впрыск жидкости; 23 — сигнал катарометра на измерительный щит и регистрирующий прибор; 24 — кран прецезионной регулировки; 25 — осушитель; 26' — открытый жидкостной манометр; 27 — счетчик пузырей; 28 — подогреватель для нагревания азота-разбавителя. (В подогревателе, смесителе и в реакторе имеются термоэлементы платина/ Платина—родий). |
Пиролиз 2-метилпентена-2 в изопрен проводится в крекинг-печи. Для того чтобы добиться превращения олефинов с хорошими выходами и с минимумом побочных реакций, в качестве катализатора применяют бромистый водород, а в качестве разбавителя — пар. Пиролиз 2-метилпентена-2 проводится при температурах 650—800 °С и времени контакта от 0,05 до 0,3 с. Изопрен, метан, другие газы и непрореагировавший 2-метилпсптсп-2 разделяются ректификацией. 2-Метилпентен-2 снова возвращается в пиролизную печь.
Наиболее эффективными оказались кислые катализаторы. Среди прочих рекомендуются у-А1203 и НВг. Применяемый бромистый водород выделяют на резко охлаждаемых системах (квенч-системах) и тоже возвращают в пиролизную печь.
|
750 |
800 |
800 |
800 |
|
0,02 |
0,01 |
0,01 |
0,02 |
|
19,6 |
17,7 |
24,1 |
53,3 |
|
18,4 |
18,1 |
16,9 |
14,6 |
|
800 0,02 52,9 15,7 |
Баас с сотрудниками [5с] тщательно исследовал эту реакцию и в полупромышленном масштабе. На рис. 60 схематически изображена аппаратура, в которой при пиролизе 2-метилпентена-1 (получен димеризацией пропилена под действием A1R3; степень чистоты 98,9%), 2-метилпентена-2 (получен изомеризацией 2-метилпенте - на-1; степень чистоты >98,5%) и З-метилпентена-2 (получен дегидрированием З-метилпентанола-З) они получили различные количс-' ства изопрена (табл. 23).
|
* Т а б л и ц а 23 Результаты пиролиза гексенов
Пиролиз 2-м етилпентен а-1* Температура, °С. Время контакта, с Конверсия, мол. % |
|
Пиролиз 2-м етилпентен а-2
|
|
Пиролиз 3-м етилпентен а-2* |
|
Разбавление Температура, РС. Время контакта, с Конверсия, мол. % Выход изопрена, % |
Температура, °С. , Время контакта, с. Конверсия, мол. % Выход пзопрена, %
|
750 |
800 |
800 |
800 |
800 |
|
0,02 |
0,005 |
0,01 |
0,02 |
0,015 |
|
20,6 |
6,0 |
16,6 |
48,7 |
39,0 |
|
71,0 |
81,6 |
74,9 |
60,1 |
65,2 |
* Пиролиз 2-метйлпентена-1 и з-метилпентена-2 проводили без разбавления.
Данные табл. 23 показывают, что до пиролиза целесообразно сначала изомеризовать 2-метшшентен-1 в 2-метилпентен-2. Еще лучше было бы использовать в качестве исходного материала 3-метил - пентен-2, но, к сожалению, его трудно получить.
Коэффициент полезного действия этого метода производства изопрена определяется в первую очередь последней стадией, т. е. де - метанизацией. Перед последней стадией выход изопрена достигает около 65 мол. %. Опыты показывают, что расщепление происходит точно или примерно по реакции первого порядка, когда имеет место разрыв одной или нескольких С— С-связей. Однако энергии
активации, относящиеся к этим процессам первого порядка, значительно меньше, чем энергии диссоциации С—С-связей.
Такие экспериментально найденные закономерности теоретически оказываются вполне понятными, если исходить из предположения, что реакции разложения проходят через цепные радикальные реакции [113]. Реакция пиролиза состоит из трех частей: инициирования, роста цепи (цепная реакция) и обрыва цепи. При реакции инициирования образуются радикалы, которые, отщепляя водород, вызывают множество следующих друг за другом цепных реакций.
Эти цепные реакции состоят из двух частей: отщепления водорода и стабилизации радикалов, образовавшихся после отщепления водорода. В частности, реакции отщепления водорода влияют на окончательный состав продукта пиролиза. В результате рекомбинации радикалов происходит обрыв цепи и цепные реакции прекращаются. Все это можно проиллюстрировать следующей схемой:
Инициирование
М —v 2R
Рост цепи
R + M —>• RH + R' (отщепление водорода) R' —>- M'+R (стабилизация радикала) R + M —> RH + R' R' M' + R и т. д.
Обрыв цепи
R + R' —► М"
Очень часто возникновение начальных реакций ложно объясняют столкновением со стенкой реактора. Возможно, что инициирование происходит бимолекулярно, как это предполагают в случае пиролиза этана [114]:
М + Х—>- 2R + X
Причем X может быть равен М.
Непосредственно за каждой начальной реакцией быстро следуют цепные реакции, которые благодаря образованию новых радикалов сами обеспечивают дальнейший рост цепи. Соотношение между ростом цепи и инициированием (средняя длина цепи) очень велико. В схеме окончание выбрано произвольно. Эта реакция может проходить также на стейке реактора или тримолекулярно:
R + R'+(молекула газа) —>- М
По данной схеме можно вычислить в стационарном состоянии что рассматриваемый пиролиз протекает как реакция первого порядка. Однако это зависит от выбранной схемы пиролиза.