Окисление пропилена на медьсодержащих катализаторах
В 1942 г. американские ученые обнаружили, что при пропускании пропилена через окись меди (I) и селенид серебра на асбесте при 295 °С образовывалось значительное количество акролеина [25].
Это привело к разработке нового процесса в 1946—1947 гг. фирмой Shell Development Co. [26]. Пропилен вместе с воздухом и водяным паром пропускали при 370—400 °С и небольшом давлении в присутствии 0,03 мол. % изопропилхлорида через окись меди (I) на карбиде кремния. Максимальный выход акролеина равнялся 51%. Повышение давления кислорода увеличивает выход акролеина до 68— 81 % [27]. В промышленном масштабе конверсия пропилена составляет 14% при 368 °С и объемном соотношении пропилен : водяной пар : кислород = 4,4 : 4,7 : 1 в присутствии 0,4% окиси меди (I) на карбиде кремния. Выход акролеина колеблется в пределах 65— 85% [28].
Образование акролеина происходит одновременно с полным окислением до двуокиси углерода и воды, при этом катализаторы с высоким содержанием меди способствуют окислительной деструкции. Побочными продуктами реакции будут формальдегид, ацетальдегид, окись углерода, органические кислоты, карбонильные соединения и полимеры.
Изучение механизма реакции показало, что Cu20 является эффективным катализатором, в то время как СиО приводит к полному окислению пропилена в С02, а металлическая медь не активна. Из окисей металлов Cu20 является единственным катализатором, который окисляет избирательно [29]. Катализаторы V208, W03, Мо03 и Сг203 на пемзе (особенно V208 и W03) хотя и давали значительное количество акролеина, но реакция протекала неселективно [30]. Оптимальным количеством катализатора — окиси меди, нанесенной на окись алюминия, силикагель, пемзу или карбид кремния, — является 1—1,5% Си. При более высоких концентрациях на катализаторе присутствовала частично металлическая медь, способствующая образованию С02 [31—35]. Независимо от первоначальной формы образуется совершенно определенная смесь Си — Си20 — СиО [36— 40], которая прежде всего зависит от соотношения пропилен : кислород. Например, при используемом в промышленности соотношении С3Н6 : 02 = 7,5 : 1 и 1,5% СиО на карбиде кремния получается смесь из 70% Cu20 и 30% СиО. При соотношении С3Н6 : 02 = = 30 : 1 уменьшается выход акролеина из-за образования меди.
Наиболее подходящими носителями являются пористое стекло [41], пемза и особенно карбид кремния [39, 42]. Рекомендуется применение пористой меди при "300 °С (конверсия 2,5%, выход 54%), конверсия возрастает с увеличением поверхности катализатора [43]. Обычная окись алюминия не может быть носителем, так как способствует образованию С02 и воды, тем не менее предложен катализатор из 1,5% СиО на неактивированной окиси алюминия, действие которого можно улучшить добавкой Fe203, Th02 или Мо03 [44]. Промоторами для катализатора Cu20 (на глиноземе или SiC) могут быть Ю"4 — Ю-6 моль брома, иода, бромистого или иодистого водорода, бром - или иодсодержащих углеводородов. Максимальный выход акролеина (73%) получали при 391 °С и добавке иода [45]. Аналогичное действие оказывает добавление к катализатору СиО на силика - геле галогенида меди, особенно CuBr2 (выход 12,5%, селективность 30—40%) [46] и смеси щелочных окисей и галогенидов (например, Na20 и NaCl) [47].
Медьсодержащие катализаторы известны как эффективные добавки к селену или селенсодержащим соединениям {работы американской фирмы Distillers Co. Ltd.). Исследования советских авторов [48] показали, что селен является переносчиком кислорода, при этом Se и Se02 вместе с СиО и Cu20 образуют окислительно-восстановительную систему [49], а образование С02 подавляется. В качестве катализаторов рекомендуются CuO, CuS04 и CuSe03 на А1203, SiC, пемзе, стеклянном порошке, силикагеле, которые обрабатываются парами селена. Для катализаторов, содержащих 12—16% Си, оптимальными условиями будут: температура 325 °С, время контакта 2—2,5 с; при этом достигается выход 81—82%, конверсия 90—95%.
В 1949 г. появился первый патент фирйы Distillers Co. Ltd. [50], в котором предложен катализатор из Ag2Se и СиО на асбесте (350 °С, выход 15%) и катализатор CuO — Se (выход 12%) [51]. Газообразный пропилен можно также пропустить перед окислением через селен. Незначительное количество унесенных селеновых частичек достаточно для каталитического воздействия. При 320 °С получали 77% акролеина на СиО — А1203 (конверсия 84%) [52]. Катализатор СиО на силикагеле повышает выход акролеина с 3,5 до 23% при наличии следов селена или Se02 [53—54]. Кроме СиО предложены окиси других металлов [55] и различные соли меди (хромат, молибдат, сульфат, вольфрамат и ванадат) ч присутствии селена [56]. Применение CuS04 — А1203 дает 62% акролеина. Для регулировки процесса можно вначале пропускать исходный продукт через неактивированную СиО при 1000 °С и лишь после этого — через активный катализатор [57].
Аналогично селенсодержащим соединениям рекомендуют также сернистый газ, CuS, Ag2S, Sb2S3 и Fe2S3 в качестве промоторов для катализаторов, содержащих силикат меди [58].
В патентах и публикациях фирмы Montecatini Soc. рекомендуется проводить окисление пропилена в акролеин в трубчатых реакторах, состоящих из медных или покрытых медью труб. В оптимальных условиях (390 °С, 4 кгс/см2, время контакта 0,5 с) селективность 91%, конверсия 78% [59—62].
Разновидностью метода является окисление пропилена в акролеин с катализатором СиО на носителе в кипящем слое [63].
При окислении пропилена в акролеин на медьсодержащих катализаторах энергия активации в присутствии водяного пара составляет 20 ± 1 ккал/моль [64], в отсутствие водяного пара 30 ккал/моль (36 ± 2,5 ккал/моль) [65, 66]. Для образования С02 достаточно энергии активации 35 и соответственно 36 ккал/моль. Состояние меди оказывает некоторое влияние на катализатор. Если доля Gu (II) составляет 60—70% от общего количества меди, то энергия активации равняется 17—18 ккал/моль, при наличии только 20—50% Си (II) энергия активации снижается до 11—12 ккал/моль [67]. Количество меди, необходимое для получения селективных катализаторов, зависит от материала носителя [68].
Окисление пропилена в присутствии СиО на SiC — реакция первого порядка по отношению к кислороду и нулевого порядка по отношению к пропилену [69], поэтому скорость окисления возрастает с увеличением концентрации кислорода [64]. Селективность образования акролеина повышается с ростом концентрации пропилена [64—66]. Водяной пар является лучшим разбавителем по сравнению с пропаном или азотом (при конверсии 6% оптимальный выход 70%) [70—71]. Образование С02 уменьшается при введении водяного пара. Тем самым повышается и селективность; оптимальная концентрация пропилена будет 10% [72]. Лучше всего действует добавка 40% водяного пара (при 340—400 °С), выше этого показателя катализатор становится нестойким [73].
Введение металлов, обладающих меньшей электроотрицатель - ностыо по сравнению с СиО и поэтому действующих как доноры электронов (щелочные или щелочноземельные металлы), повышает активность и снижает селективность. Электронные акцепторы (С1~, SO|~, S, Р), напротив, увеличивают селективность и уменьшают активность [74, 75].
Окисление пропилена на медьсодержащих катализаторах изучалось рядом авторов [76—78]. Гетерогенные медные катализаторы зарекомендовали себя лучше, чем гомогенные [81].
Исследование окисления пропилена в присутствии Cu20 и Ві2(Мо04)3 показало, что механизм окисления в обоих случах одинаков: вначале отщепляется атом Н от группы СН3, затем второй атом Н [79]. Акролеин всегда является промежуточным продуктом при последующем окислении до СО 2 и воды [80].
Метод прямого каталитического окисления пропилена на медных катализаторах был внедрен в промышленности лишь в 1959—1960 гг. фирмами Shell Chemical - Со. (мощность установки 1.5 000— 20 000 т/год) и Union Carbide Со. Поэтому сегодня классический синтез акролеина из формальдегида и ацетальдегида, бывший до 1959 г. основным методом промышленного производства акролеина, считается устаревшим.
Вначале катализатором для этой реакции служила окись меди (I), нанесенная в количестве 1—2% на карбид кремния. Данный катализатор очень селективен в отношении окисления пропилена в акролеин. В зависимости от состава реакционной смеси и условий реакции в катализаторе устанавливается динамическое равновесие:
Си ^ Си20 СиО
7 Заказ 399
Из этих трех форм окись меди (I), по литературным данным, является специфическим, селективно действующим катализатором для окисления пропилена в акролеин. Окись меди (II) оказывает каталитическое действие на реакцию полного окисления пропилена в СО2, а металлическая медь неактивна.
|
Рис. 33. Схема производства акролеина, методом окисления пропилена: 1 — трубчатый реактор; г — обогревательная система; з — холодильник; 4 — скруббер; S — колонна для удаления С02; в — газодувка; 7—в — дистилля- Ционные колонны. |
При окислении пропилена в основном возможны следующие реакции:
СН2=СНСН3 + 03 —>■ СН2=СНСН0 + Н20 + 88,2 ккал СН2=СНСН3 + 02 —> СН3СНО + НСНО + 79,9 ккал
СН2=СНСН3 + 0,502 --------- У СН3СН2СНО + 54,0 ккал
, СНо=СНСН3 + 302 —► ЗС0 + ЗН20 + 259,9 ШИЛ СН2=СНСН3 + 4,5р2 > ЗС02 4 ЗНоО + 462,7 ккал
В незначительном количестве образуются, кроме того, органические кислоты, карбонильные соединения и полимеры.
На рис. 33 представлена схема производства акролеина путем окисления пропилена.
/
Пропилен вместе с кислородом или воздухом вводится после карбонизационной башни в цикл через отделитель и газодувку 6 в следующий отделитель. В подогревателе смесь нагревается до 250—350 °С и поступает в заполненный катализатором трубчатый реактор 1. Для поддержания постоянной температуры реакции имеется специальная система 2. Образующаяся смесь охлаждается в холодильнике 3 цо 50—80 °С и направляется дальше в скруббер 4, где продукты реакции поглощаются водой. Промывная вода иэ скруббера 4 поступает в перегонную колонну 7, где отгоняются образующиеся продукты окисления. Вода, вытекающая из низа колонны, содержит небольшое количество кислот (акриловой, уксусной и др.). После нейтрализации вода снова возвращается для промывки в скруббер 4. В колоннах 8 и 9 осуществляется дистилляция акролеина.
Выходящие из скруббера 4 остаточные газы содержат наряду с непрореагировавшим пропиленом также азот, кислород, окись
|
|
|
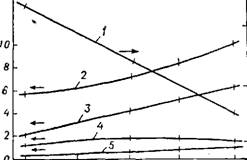
К Рис. 35. Зависимость - состава продуктов оки - о сления пропилена от да - Є вления: о І — акролеин; 2 — ацеталь - ^ дегид; 3 — окись пропилена; * — пропионовый альдегид; б — ацетон. |
|
2 3 4*5 $ Давление, кгс/см1 |
И двуокись углерода. Для удаления двуокиси углерода смесь газов пропускают через колонну для декарбонизации 5, после чего снова используют в реакционном цикле.
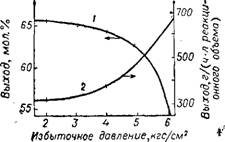
Влияние давления на процесс получения акролеина из пропилена показано на рис. 34 и 35.
|
Рис. 34. Зависимость от давления общего выхода акролеина (1) и выхода в единицу времени на единицу реакционного объема (2). |
Выделить чистый акролеин из реакционной смеси не просто. По литературным данным при процессе фирмы Shell получают в
качестве дистиллята в перегонной колонне смесь следующего состава (в вес. %):
TOC \o "1-3" \h \z Акролеин........................ ' 80—90 Ацетон................................................ 2—5
Ацетальдегид.... 3—10 Высококипящие вещест-
Пропионовый альде - ва....................................... 1—2
Гид............................... 0,5—3
Удаление минимального количества пропионового альдегида, имеющего почти такую же температуру кипения, что и акролеин (пропионовый альдегид 49 °С, акролеин 50 °С), удается осуществить только экстракционной перегонкой с водой при повышенном давлении во второй колонне.