Исследование процесса окисления кумола
Кучер и другие [265] нашли, что скорость окисления повышается >с увеличением рН и количества воды. Эмульгатор в водной фазе повышает растворимость кислорода, кумола и КМГП. Реакция окислення инициируется в этой же фазе [265, 266]:
RH + 02 —>- R. + HO2 R. + 02 ► ROO. + RH ROOH + R.
Перекисные радикалы, очевидно, образуют комплексы с водой 1268]. Одновременно стеарат натрия увеличивает стабильность КМГП [267].
Как и при окислении чистого кумола, скорость окисления увеличивается по мере повышения давления, но в последнем случае влияние давления значительно больше. Однако это компенсируется тем, что скорость окисления в эмульсии априори больше, чем скорость окисления чистого кумола [270—272]. Давление выше 10 кгс/см2 уже не оказывает никакого влияния на окисление. Если окисление проводится в присутствии металлической меди, то скорость окисления не зависит от давления [188].
Изучение ингибирования реакции окисления показало, что при окислении в жидкой фазе самым сильным ингибитором является фенол, при щелочном окислении в эмульсии сильнее действует л-бензохинон [267], так как фенолят натрия ингибирует значительно слабее, чем фенол. Кроме того, очень сильно затормаживают окисление изопропилтиофен, гидроксикислоты (например, гидрокси - бензойные кислоты) [273], а-метилстирол [275], ацетофенон, 2-ме - тил-2-фенилоксиран [290]. В начале реакции ингибиторы действуют сильнее, чем позже, когда уже образуется достаточное количество КМГП [274].
Поскольку разложение КМГП в процессе реакции усиливается, то при окислении чистого кумола выход КМГП проходит через максимум [275]. Скорость же окисления постоянно увеличивается ^пропорционально концентрации гидроперекиси в степени 1/2 [276]). Наблюдаемый в начале реакции период ингибирования является
функцией чистоты кумола: сначала должны быть разрушены имеющиеся следы ингибиторов [277].
Кажущиеся константы скорости (составленные из констант скорости инициирования, роста и обрыва цепи) окисления кумола были определены Белтрамом [278]:
Температура, °С............................... «
Z-106
|
100 110 120 7,37 13,49 22,1 7,62 14,30 23,0 |
Некатализируемая реакция ре акция, катализируемая NaOH
Отсюда вычислена кажущаяся энергия активации: при отсутствии катализатора Е = 15,9 ккал/моль, а в присутствии NaOH Е = 16,3 ккал/моль. Изучение термического разложения КМГП, происходящего и во время окисления, показало, что при 120 °С образуются следующие продукты разложения [279]: фенол, ацето - фенон, кумол, кислоты (среди них муравьиная, бензойная).
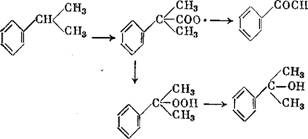
В процессе окисления кумола наблюдается еще образование а-кумилового спирта (а-гидроксиизопропилбензола) из КМГП — первичного продукта окисления [280]. Для объяснения образования побочных продуктов составлена схема реакции [281]. Предполагают, что сначала возникает радикал кумила, из которого и образуются в дальнейшем побочные продукты [282—283]:
|
|
|
+ СН3ОН |
|
А-кумиловый спирт |
|
З |
Исследования энергии активации Е разложения при различных условиях дали следующие результаты (для реакции роста цепи Е = 8,6 ккал/моль [284]):
|
Е, Ккал/моль 30,4 31 41 27 |
Добавка
Без добавки [284] Кумол [285] . . . . Кумол [286]
Кумол [287] . . . . Метиловый спирт [285]
|
Е, Ккал/моль 20 |
|
6,5 29 |
Добавка
Стирол [285] . . . . Агент образования
Радикалов [285] • . Бензойная кислота [286]
При изучении термического разложения КМГП при 110—160 °С в бензоле [2871 были найдены следующие продукты разложения j(b мол. %):
Двуокись углерода
Метан..........................
Этилен.........................
Ацетофенон. . . . Бензойная кислота
TOC \o "1-3" \h \z 8,0 Дифенил..................................... 2,9
30,0 а-Метилстирол.................................. 2,3
3,0 Фенол.......................................... 0,9
49,0 а-Кумиловый спирт. . 37,0
7,4 Вода............................................ 60,0
Распад КМГП происходит в соответствии с уравнениями:
Начало
ROOH—у RO« + - ОН
Рост цепи
RO.+ RH —> ROH + R* OH. + RH—>H20 + R.
R.+ ROOH —> ROH+RO
Обрыв цепи
2R---------- > R-R
В бензоле радикалы почти не реагируют, значительно сильнее — в кумоле (RH). Влияние температуры на состав продуктов разложения показано ниже (в мол. %):
НО °С 137 ° С 160 °С
TOC \o "1-3" \h \z Метан......................................................... 27 39 52
Ацетофенон................................................... 30 50 63
Бензойная кислота.................................... — 0,9 2,4
Дикумил......................................................... 21 26 29
А-Метилстирол................................................. 0 2,5 0
А-Кумиловый спирт................................... 141 130 106
Вода.......................................................... — 31,9 25,6
Изучение разложения КМГП при температурах, при которых разложение еще не проявляется (60 °С), и в присутствии солей кобальта (II) показало, что это реакция первого порядка [2511, не зависящая от концентрации КМГП. Растворитель же влияет на скорость. Под действием солей кобальта КМГП разлагается с образованием радикалов [2881.
В водном 0,1 н. растворе H2S04 скорость разложения в 7 раз выше, чем в водном 0,1 н. растворе NaOH, и в 60 раз выше, чем в воде. Добавка тенсида повышает скорость разложения в кислой и щелочной среде [289].
Действие ингибиторов окисления основывается на их способности отдавать кислород; благодаря этому улавливаются перекис - ные радикалы. Опыты по окислению кумола в присутствии антиокси - дантов [290, 291] показали, что количество определяемых продуктов разложения (ацетофенона, кумилового спирта, а-метилстирола и 2-метил-2-фенилоксирана) зависит от интенсивности антиокисляющего действия.
Карноитский [294] описывает механизм радикального кислого и щелочного разложения КМГП (при щелочном разложении образуется а-кумиловый спирт и высвобождается кислород).
При высокотемпературном (500 °С) разложении кумола найдены следующие продукты разложения: формальдегид, стирол, а - и Р-метилстирол, бензальдегид, ацетофенон, метилбензилкетон. и вода
[292] .
Подробные сведения о применении КМГП приведены в работе
[293] .