ТЕТРАГИДРОАБИЕТИНОВЫЕ КИСЛОТЫ И ИХ ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
Ломбар и Эбелен [138] получили две тетрагидроабиетиновые кислоты:
А-тетрагидроабиетииовую кислоту, темп. пл. 165—166° и [Ajj+28.3C (в спирте), метиловый эфир с темп. пл. 99°С и +21,3° (в спирте),
Р-тетрагидроабиетииовую кислоту, темп. пл. 185—186° С и [а], + 12,4° (в спирте), метиловый эфир темп. пл. 55°С и [A]J+7,2° (в спирте).
При гидрировании А-дигидроабиетиновой кислоты (LXXV) в спирте в присутствии пирофорного никеля под давлением при 130° С ими получена a-тетрагидроабиетиновая кислота, а при гидрировании этой же А-кислоты в растворе уксусной кислоты в присутствии платиновой черни — p-тетрагидроабиетиновая кислота.
Р-тетрагидроабиетиновая кислота, темп. пл. 183—184° С и
Of)
[a]D +6° (в спирте) найдена в качестве побочного продукта при получении дегидроабиетииовой кислоты [127].
В. Н. Белов и С. Д. Кустова [20] осуществили синтез а-тетра - гидроабиетиновой кислоты, темп. кип. 192—205° С (0,3—0,5 мм Рт. ст.), темп. пл. 165—168°С, из канифоли гидрированием в спирте в лрисутствии пирофорного никеля под давлением 200—207 атм и температуре 210—230° С.
В тетрагидроабиетиновой кислоте имеется пять асимметрических атомов, входящих в состав циклов и создающих геометрические изомеры. Взаимное расположение трех (1, 11 и 12) асимметрических атомов для ^ абиетиновых кислот изучено и ойисано.
Остается сделать предположение; что изомерия тетрагидро - абиетиновых кислот происходит за счет 13 и 14 асимметрических атомов, возникающих после гидрирования абиетиновых и ди - гидроабиетиновых кислот.
Вероятнее всего, ct-тетрагидроабиетиновая кислота является 13,14 — цис-изомером, а p-тетрагидроабиетиновая — 13,14— Транс-изомером. Последнее заключение делается на основании того, что температура плавления цис-изомеров всегда ниже температуры плавления траис-изомеров.
В связи с завершением исследований, связанных с выяснением структуры смоляных кислот, в последнее время стали появляться работы, уточняющие пространственное размещение отдельных групп атомов в молекулах кислот.
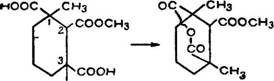
Впервые этот вопрос обсуждался J1. Ружичкой, М. В. Гольд - ібергом, X. В. Хайзером и К. Ф. Зайделем [43]. Они тщательна ^изучили эфиры и ангидриды трикарбоновой кислоты СігНівОв (.(XXI) и трикарбоновой кислоты СцН|вОв (XXII). Среди всех 'этих соединений наибольшее внимание исследователей привлекли монометиловый эфир С12н180в (LXXXI) темп. пл. 188— 190° С и ангидрид С12Н1в05 (LXXXII), темп. пл. 137—137,5° С, 'легко получаемый из эфира при воздействии ацетилхлориде.
|
|
|
LXXXI |
|
LXXXII |
Такое течение реакции возможно только в том случае, если две карбоксильные группы 1 и 3-го углеродных атомов кольца А будут находиться в цис-положении, а центральная эфирная группа — в транс-положении к боковым кислотным группам.
На основании этих выводов можно дать объяснение и оптической неактивности кислот Ci2Hi80e (XXI) и C«HieOe (XXII). Отсутствие вращательной способности ♦ является следствием внутренней компенсации обоих противоположно вращающих асимметрических центров.
Если распространить это на абиетиновые кислоты, то можно - сделать заключение, что кольца А и С находятся в транс-поло - жении, метальные группы у I и 12-го углеродных атомов — Fe Цис-положении, а кислотная группа по отношению к метальным — в транс-положёнии.
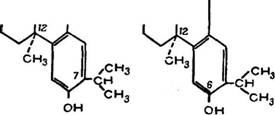
Позднее были получены дополнительные данные по пространственной изомерии смоляных кислот В. Кемпбеллом и Д. Тоддом [43]. При сравнении конфигурации 7-изопропил по - докарповой кислоты (LXXXIII) и 6-гидроксидегидроабиетиио - вой кислоты (LXXXIV) можно видеть, что та и другая имеют одну и ту же плоскостную формулу, но согласно выводам авторов кислотная группа ііри 1-м углеродном атоме в (LXXXIII)
Формуле занимает цис-положение, а в (LXXXIV) формуле — транс-положение в пространстве.
|
,СООН |
|
LXXXU1 |
|
LXXXIV |
|
Ноос^снз |
На основании этих выводов оказался возможным синтез ди - ф)енил-транс-дегидроабиетинола (LXXXV), выполненный X. Цейсом [43]. Далее метод оказался приложим к метиловому эфиру ■6-метоксидегидроабиетиновой кислоты, который после сочетания с магнийбромфенилом и последующим омылением дал ди- фенил-транс-6-гидроксидегидроабиетинол (LXXXVI).
Метиловый эфир 6-метоксиподокарповой кислоты (LXXXVII), у которого сложноэфирная группировка находится в цис-поло - жении относительно метильной группы при 12-м углеродном атоме, с магнийбромфенилом не реагировал, что может объясняться пространственными затруднениями.
YCeHs
|
|
|
Г /Сн, |
|
НдСХ^СООСНз |
На основании работы В. Кемпбелла и Д. Тодда, а также X. Цейса приходим к выводу о том, что для кислот типа абиетиновых можно принять цис-положение для метальных групп у 1 и 12-го углеродных атомов.
Чтобы точнее представить стереохимию смоляных кислот, полезно рассмотреть стереохимию стероидов, которая в настоящее время изучена значительно лучше.
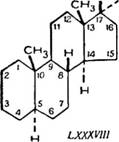
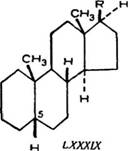
Ранее исследованные насыщенные стероиды, встречающиеся з природе, принадлежат к следующим двум рядам; алло-ряду (LXXXVIII) и нормальному ряду (LXXXIX) [43, 125].
|
|
Используя способ пространственного изображения циклических систем, предполагаем, что атомы углерода, образующие кольца, лежат в плоскости, перпендикулярной к плоскости бумаги, а связанные с кольцами группы атомов или атомы располагаются или под плоскостью колец (пунктирные линии — а - эриеитация) или над нею (сплошные жирные линии — р-ориен - гация). Различие между алло-рядом и нормальным рядом в группе стероидов заключается в том, что водород при 5 углеродном атоме в алло-ряду имеет а-ориентацию, в нормальном ряду — р-ориентацию.
|
|
Ялло - ряд ■ нормальный ряд
Амдростан этиохоллан
Оллопрегнап R~CZHj прегиан
Ои/юхолановая кислота R=сн(сн3)-снг-с00н халановая кислота
Холестан п=щснд)-смг-с^-сн(сн3)г чОпростан
На декалинах показано, что шестичленные углеродные кольца не могут образовать плоскости и обладают формой «кресла» и «кровати».
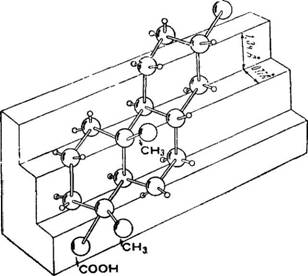
І Пространственное расположение атомов андростана, уста - ровленное на основании подробного рентгеновского кристаллографического анализа, оказалось для всех его колец соответствующим форме «кресла». Было найдено, что в кольцевой Системе андростана атомы углерода 2, 3, 5, 7, 8, 10 и 15 находятся в одной плоскости, а атомы углерода 1, 9, II, 13 и 14 ле - ІЖат во второй плоскости, параллельной первой и отстоящей от
&ее на расстоянии около 0,77 А.
Приведенный выше материал по пространственному расположению атомов в молекулах смоляных кислот позволяет сделать допущение о том, что в p-тетрагидроабиетиновой кислоте
Все три кольца «А», «В» и «С» расположены так же, как в ан - дростане (см. рисунок).
|
/С Н ( С Н 5 } ■>
|
Иными словами, p-тетрагидроабиетиновая кислота относится к алло-ряду.
К этому же ряду, вероятно, можно отнести и почти все остальные выше перечисленные смоляные кислоты. Некоторые сомнения вызывает только левопимаровая кислота.
Левопимаровая кислота (XXX), по некоторым соображениям, может быть отнесена к нормальному ряду. Ее кольцевая система, возможно, имеет несколько иное расположение, чем у p-тетрагидроабиетиновой кислоты. Такой вывод подкрепляется тем, что среди стероидов производные нормального ряда, под действием кислот или оснований, превращаются в производные алло-ряда, а при исследовании изомерии в области стереохимии декалинов установлено, что цис-а-декалин менее устойчив но сравнению с транс-изомером.
Можно предполагать, что изомеризация левопимаровой кислоты в абиетиновую сопровождается не только перемещением двойных связей в кольце, но и изменением пространственной ориентации атомов углерода и водорода в первом кольце (переход от цис - к транс-форме).
Нормальный ряд
Опираясь на вышеизложенный магернал, а также на некоторые другие данные [43, 154], можно дать следующую табл.34, Характеризующую пространственную изомерию смоляных КисЛої.
Таблица 34
|
Смоляные кислоты |
Положение С — соон По отношению к С"—Н |
Положение С11—н по отношению к С»-СНз |
Положение С13 — СН3 по отношению к С13— Н |
|
Р-Тетрагидроабиетииовая........................... |
Цис |
Трапе |
Траис |
|
Абиетиновая.................................................. |
» |
» |
» |
|
Неоабиетиновая. . ...................................... |
А |
» |
|
|
Дегидроабиетиновая. ................................. |
» |
» |
— |
|
Декстропимаровая....................................... |
» |
Транс? |
|
|
Изодекстропимаровая. . ............................. |
І |
» |
Цис? |
|
Саидаракопимаровая. . .............................. |
» |
» |
»? |
|
Левопимаровая.......................... |
Транс,- |
ЦИС? |
»? |
|
Подокарповая............................................... |
» |
Транс |
— |
|
Агатовая двухосновная............................... |
• |
» |
Транс |