СТРОЕНИЕ И СВОЙСТВА ПРОДУКТОВ АУТОКСИДАЦИИ СМОЛЯНЫХ КИСЛОТ
При продолжительном стоянии на воздухе сосновая и еловая живицы окисляются кислородом воздуха (явление аутоксида - ции), темнеют и изменяют свои физические свойства, в частности теряют свою способность легко растворяться в бензине.
Естественными природными продуктами, из которых можно легко извлечь окисленные смоляные кислоты, являются собираемый на каррах баррас и еловая ссрка.
При экстракции бутиловым и другими спиртами или фурфуролом из еловой серки извлекают так называемую абиетиновую смолу.
Эта смола может быть использована для изготовления гра - мофонных пластинок, в качестве лака для покрытия мебели, как компонент материала для создания изолирующего слоя при пропитке электрообмоток и как наполнитель для масляных трансформаторов [23, 43]. Следует ожидать, что абиетиновая смола будет в возрастающих количествах потребляться нашей промышленностью.
Состав продуктов аутоксидацин живицы, канифоли и еловой серки еще недостаточно изучен. Это объясняется прежде всего теми трудностями, которые возникают при анализе таких продуктов, н тем, что теория аутоксидацин органических веществ получила надлежащее освещение только в 30-х годах нашего столетия.
Когда подходили к решению данного вопроса, то было известно, что молекула, лишенная заряда, лишенная свободной, валентности, обычно практически не оказывает никакого воз-j действия на другую молекулу, с которой она соударяется. Осо-' бенно неблагоприятные условия создаются при реакции орга-і нического вещества с кислородом, так как энергия разрыва двух; связей О—О составляет около 117 ккал/мпль, а связи С—Нот 80. до 100 ккал/моль. Такая энергия может развиваться только при; высоких температурах, порядка 1200—1400° С [81]. Но в то жеі
116
Время, было известно, что реакция аутоксидации (т. е. присоединения кислорода воздуха ко многим органическим веществам) проходит довольно успешно при обычных температурах.
Для объяснения процессов, проходящих при аутоксидации, в 1897 г. А. Н. Бахом [43] сформулирована перекисная теория, по которой окисление кислородом воздуха представлялось как стадийный процесс. Первой стадией являлось присоединение молекулы кислорода Ог к активной молекуле окисляемого вещества А, с образованием промежуточного перекисного соединения А02.
Второй стадией являлось окисление перекисью обычных молекул вещества А.
АОа+А = 2АО
При помощи этой теории А. Н Бах объяснил весьма распространенное явление окисления кислородом воздуха трудно - окисляемых веществ В в присутствии легкоокисляемых А. Механизм этого явления может быть представлен следующей схемой:
По этой схеме одна молекула перекиси — индуктора способна окислить одну молекулу акцептора
В
Однако опыт показал, что во многих случаях фактор индукции оказывался величиной, много большей единицы
Эти противоречия были разрешены только при разработке цепной теории, или теории радикалов. Было найдено, что для разрыва С — С связи у гексафенилэтана требуется затратить лишь около 11—12 ккал/моль. Столь небольшая величина энергии диссоциации приводит к тому, что гексафенилэтан легко диссоциирует па практически устойчивые трифепилметильные радикалы. Дальнейшими работами было показано, что энергия диссоциации на радикалы у других органических соединений не больше, а часто даже меньше энергии диссоциации гексафенил - этана. Наконец, стало ясно, что чем меньше радикал, тем меньше время его существования, но выше реакционная способность. Так, радикал типа метила способен существовать лишь очень короткое время, но реагирует с огромным числом различных веществ, вплоть до благородных металлов н, конечно, с кислородом [79]. Так,
СН3 + 02=СН300, СНзОО+СН4 = СНзООН + СНз и т. д., где снз—непрерывно возникающий радикал метил.
Из этого примера видно, что при реакции одновалентного свободного радикала с валентнонасыщенной молекулой свободная валентность не исчезает. В продуктах реакции обязательно будет присутствовать новый свободный радикал, способствующий поглощению новых молекул кислорода.
Можно считать установленным, что первичными продуктами окисления терпенов являются гидроперекиси. Их образование можно представить как результат цепной реакции
R - fO^RQ*;
RO2+ RHROOH +R" ит. д.
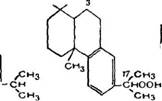
П. Ф. Ритчи, Т. Ф. Сандерсон и Мак-Берни {143] показали, что главным продуктом аутоксидацин метилового эфира дегидроабиетиновой кислоты является кристаллическая 9-гидро - перекись (ХС).
|
HjCOOC Сн3 |
|
КС |
|
Сн. ХСІІ |
|
XCI |
/>СН3 ^ сн..
Кроме того, образуется 5—6% изомерной 17-гидроперекиси (ХСІ1 При большой глубине окисления реакционная смесь содержит метиловый эфир 9-кетогидроабиетиновой кислоты (ХСИ). Эта работа показывает, что закономерности аутоксидацин смоляных кислот должны быть те же, что и при аутоксидацин монотерпеновых углеводородов [43, 154].
Д В Тищенко. Н. Ф. Комшнлов, К. М. Киссель, С. С. Ма - левская [92] считают, что внедрение кислорода в молекулу смоляний кислоты в процессе аутоксидацин проходит в а-ноложе - нии к двойным связям.
В качестве объектов для изучения продуктов окисления смоляных кислот этими авторами были избраны смола еловой древесины [43]. еловая серка, порошкообразная канифоль, а также чистая абиетиновая кислота [92].
Кислоты еловой серки были разделены на растворимую и нерастворимую в легком бензине части; последняя фракция обработкой этиловым эфиром была разделена на часть, легко растворимую в этиловом эфире, и часть, трудно в нем растворимую
Со временем из разбавленного бензинового раствора часть слабоокисленных кислот выпала.
Все фракции, кроме легко растворимой в бензине, были исследованы и результаты анализов сведены в табл. 35.
Т аб л и ц а 35
Элементарные анализ.
|
It ЗІ |
|
Состав |
Характеристика окисленных смоляных кислот
Растворимые в бензине, но выпадающие из разбавленных бевзиновых растворов
Легкорастворимые в диэтило - вом эфире, но нерастворимые в Бензине
Груднорастворимые в эфире .
Г0Н1вО6 | QoH«Oe |
Полученные данные подтверждают, что:
1) состав высших продуктов аутоксидации выражается формулами СгоНгоОб и С2оН2вОв (ХСШ);
2) в продуктах аутоксидации Сохранились двойные связи;
3) в них содержится не больше двух спиртовых гидроксилов.
Так как продукты окисления С20Н26О5 и СгоНгвОв (ХСШ)
Были окрашены в темно-красный цвет, то авторы сделали допущение о наличии п-хиноидной группировки. Для доказательства присутствия этой группировки был проведен ряд качественных реакций по восстановлению оксисмоляных кислот. Опыты дали положительные результаты.
Восстановленные желтые растворы быстро краснели до исходной окраски при продувании через них воздуха.
Кислоты еловой серки, труднорастворимые в эфире, были окислены 16 грамм-атомами кислорода. Летучие кислоты были отделены отгонкой с паром, и в них найдены уксусная и а-окси - изомасляная кислоты. Нелетучие кислоты после отделения щавелевой кислоты были превращены в серебряные соли (содержание серебра в которых ближе всего подходило к формуле CuHi30eAg), а серебряные соли — в метиловые эфиры.
Для основной фракции метиловых эфиров коэффициент омыления найден равным 549; для СиНіз03— (ОСН3)э требуется 587, для С12Н15О3—560.
Кислоты, полученные омылением эфиров, имели темп. пл. от 200 до 215° С, при этом СцН, вОв имела темп. пл. 219°С, а СігНиОв 213° С. Элементарный анализ этих фракций показал
состав, приближающийся в разных случаях к составу трикар - боновых кислот с 11, 12 и 13 углеродными атомами, но в наибольшем количестве была получена фракция, отвечающая по составу кислоте СігН^Ов (XXI).
Окисление происходило по схеме:
НООС. СН8
|
Соон ^соон П3 |
|
С |
|
XXI |
/СНз
CajHggOj
|
НООС ,сн3 |
Один образец абиетиновой кислоты, растертой в порошок, хранился на воздухе в лаборатории один год, второй — пять лет. Длительной экстракцией легким бензином из обоих образцов были удалены растворимые части, остатки исследованы. Состав их отвечает формуле С2ОН3оОв, вещество содержит три спиртовых гидроксила по Церевитинову, молекулярный вес 361.
Д. В. Тищенко [92] объясняет разницу в составе окисленных продуктов еловой серки СгоНгвОв и окисленных продуктов канифоли СэдНзоОб тем, что еловая серка подвергается аутоксидацин в присутствии терпенов, атмосферной и почвенной влаги, бактерий и грибков. Известно, что перекиси являются дегидрирующими агентами; таковыми могут быть и перекиси терпенов. Ряд биохимических процессов, вызываемых бактериями и грибками, является совокупностью реакций дегидрирования и гидрирования.
Эти реакции дегидрирования, возможные при аутоксидацин живицы, смолы пневого осмола и еловой серки в естественных условиях, приведут к образованию окрашенных окисленных кислот состава СгоНгвОй и СгоН2вОв (ХСІІІ).
При аутоксидацин сухой канифоли и индивидуальных смоляных кислот в сухом воздухе лаборатории, в отсутствии терпенов и затрудненности жизнедеятельности бактерий и грибков указанные реакции дегидрирования не должны иметь места. Отсюда состав окисленных кислот канифоли соответствует формулам СгоНдоОб и СгоНчпОв.
С. С. Малевская (60] исследовала пять образцов окисленной (в лабораторных условиях) абиетиновой кислоты. Из каждого образца иетролейным эфиром были выделены продукты аутоксидацин состава от СгоНзоО* до С2оНзоОв - Эти продукты были
подвергнуты озонированию и окислению перманганатом калии в щелочной среде 12 активными атомами кислорода. Анализ продуктов окисления кислородом воздуха абиетиновой кислоты и озонидов показал, что, по крайней мере, одна двойная связь в окисленной абиетиновой кислоте сохраняется. Окисленная кислородом воздуха абиетиновая кислота гидрируется, бромируется, и озонируется.
При окислении продуктов аутоксидации абиетиновой кислоты перманганатом калия в летучих продуктах обнаружен ацетон, что указывает на наличие гидроксила в изопропильной группе и на идущее, таким образом, внедрение кислорода в процессе аутоксидации в а-положение к двойной связи. Кроме ацетона, найдена уксусная кислота и двухосновная кислота СиНгоОв. Для этой кислоты может быть предложена следующая формула строения (XCIV):
HOOC^CHg
|
=о |
|
/ HI |
XCIV Ч/с
В подтверждение выдвинутой формулы кислота СівНгоОв (XCIV) окислялась перекисью водорода. В результате была получена четырехосновная кислота Ci5H2208, вероятно, идентичная кислоте (XLVIII), полученной Л. Ружичкой и Л. Штернба - хом [150] при окислении перманганатом калия абиетиновой кислоты.
После исследования продуктов аутоксидации абиетиновой кислоты С. С. Малевская, В. Д. Карнаухова [61] и С. С. Малев - ская [60] исследовали продукты аутоксидации смоляных кислот ели.
При этом продукты аутоксидации были разделены по своей растворимости в органических растворителях на три группы: смоляные окисленные кислоты, нерастворимые в петролейном эфире, но растворимые в дихлорэтане СгоНгвО^в; нерастворимые в дихлорэтане, но растворимые в диэтиловом эфире и ацетоне С2оН2вОв.5 и, наконец, нерастворимые в дихлорэтане, диэтиловом эфире, но растворимые в ацетоне и уксусноэтиловом эфире СгоНгвОї.
Все фракции окисленных смоляных килот, полученных из еловой древесины, были подвергнуты исследованию. Результаты анализа даны в табл. 36.
Ю>
|
Таблица 36
|
На основании проведенного анализа С. С. Малевская пришла к выводу, что по мере накопления атомов кислорода в молекулах смоляных кислот образуется хиноидная группа и накопляются оксигруппы, появление последних приводит к образованию лактонов и, вероятно, к образованию димерных молекул. На существование димерных молекул указывает несколько повышенный молекулярный вес подвергшихся анализу фракций. Так, для фракции состава С20Н26О7 эквивалент по титрованию совпадает с истинным молекулярным весом и равен 378,41, а молекулярный пес. определенный по Расту, равен 439—445.
Сравнение данных табл. 35, составленной на основании анализа еловой серки, н табл. 36, составленной на основании анализа продуктов аутоксидации смоляных кислот еловой древесины, показывает почти полное тождество того и другого вида продуктов аутоксидации смоляных кислот ати. Из опытов определения двойных связей, отраженных в работах [92, 60, 61], следует, что присоединение кислорода проходило в а-положении к двойным связям.
Окисление кислоты СгоНгеОе марганцовокислым калием, как уже было сказано, привело к получению трикарбоновой кислоты СігНівОе (XXI), в которой сохраняется неизменным кольцо «А» и которая всегда получается при окислении любых смоляных кислот сосны.
Опыты озонирования кислот СгоНгвОм и СгоН2в07 подтвердили наличие двух двойных связей в продуктах аутоксидации смоляных кислот. В результате расщепления того и другого озонида получены двухосновные оксикислоты, содержащие около Трех гидроксильных групп. Один карбоксил КИСЛОТЫ С2оН2в07 находится в виде лактона.
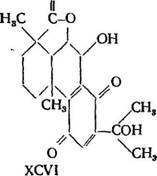
На основании проведенного анализа С. С. Малевская [60] предложила для окисленных кислот следующие формулы, отображающие их строение: СгоНгвОт (XCV), СгоНгА, (XCVI), СгоНгвОв (XCVII), С2оН2804 (XCVIII).
НООС СН3 ОН
Ч/ / ОН
О
УСН8
—СОН
|
НООС^^СНз |
|
О
|
XCV НООС^СНз
О
УСН8
|
Он £Н3 dOH Чсна |
|
/ |
|
С Но XCVIII |
XCVII
Формулы строения продуктов аутоксидации смоляных кислот, предложенные С. С. Малевекой, не противоречат выводам, которые сделали П. Ф. Ритчи, Т. Ф. Сандерсон и Л. Ф. Мак - Берни [ИЗ] по поводу продуктов аутоксидации метилового эфира дегидроабиетииовой кислоты. В литературе, однако, имеются и другие суждения по вопросу механизма аутоксидации смоляных кислот. [73].
В заключение мы сочли целесообразным дать характеристику карибской кислоты С2оНзоОз, которая, вероятно, имеет много общего с продуктами аутоксидации живицы.