АБИЕТИНОВАЯ КИСЛОТА
Константы кислоты:
Темп. пл. 173—174,5° С, —116,7° (в абс. спирте) [101, 4°01,т, Rip 1,5737 [74],
Темп. кип. 227° С при давлении 4,5 лмрт. ст. [41]. Метиловый эфир абиетиновой кислоты имеет темп. кип. 210" С при даблеиии 6 мм рт. ст 1,0437, Л0 1,5320, [а]о —29,9" [74] темп. кип. 168—172е С при остаточном давлении 0,5 мм рт. ст., D|° 1,049, пр 1,5346; дигидрохлорид эфира имеет темп. пп. 148° С; этиловый эфир абиетиновой кислоты имеет темп, кип; 204—207° С ири давлении 4 мм рт. ст., Dj31,032, и^ 1,5265;
Дигидрохлорид эфира имеет темп. пл. 143—145° С; дигидробромид эфира имеет темп. пл. 138—140° С [154].
Название «абиетиновая кислота» впервые дано было С. Бо
Пом 159], который в 1826 г. из живицы Pinus abies L. выделил крметаллическую смоляную кислоту. Этот препарат являлся смесью смоляных кислот и вф современном понимании не был абиетиновой кислотой.
«Абиетиновую кислоту» до 1922 г. получали изомеризацией других смоляных кислот действием кислых агентов (включая ледяную уксусную кислоту), или под /воздействием высоких (250—270° С) температур, включая перегонку канифоли под вакуумом, с последующей перекристаллизацией сме<уі в органических растворителях (спирте). Физические константы этих препаратов были значительно ниже полученных позднее.
Более чистый препарат абиетиновой кисЛоты получается в том случае, если она выделяется после разложения минеральной кислотой из перекристаллизованной кислой натриевой соли абиетиновой кислоты — 3 СгоНэо02'С J9H29C О О—Na. Данный метод был предложен Г. Дюпоном, J1. Дезальбрсом и А. Бернеттом в 1926 г. {122] и далее усовершенствован рядом исследователей [154].
Для того чтобы получить чистую кислую соль абиетиновой кислоты, рекомендуется предварительно изомеризовать первичные смоляные кислоты. Изомеризация производится в спиртовом растворе незначительным количеством соляной кислоты, а затем, после кипячения или продолжительного выстаивания, в холодный раствор добавляется рассчитанное количество спиртового раствора щелочи. Кислая натриевая соль абиетиновой кислоты как менее растворимая выпадает и может быть очищена дальнейшей перекристаллизацией из спирта. С. Палкин и Т. X. Гаррис (140] этим методом получили абиетиновую кислоту с темп. пл. 170—174°С, [afo—102,0° (в спирте). Они же изучили свойства некоторых аминсЗвых солей абиетиновой кислоты (табл. 32) и отметили, что путь очистки абиетиновой кислоты
|
Таблица 32
|
|
Через органические основания эффективнее метода очистки через натриевые соли. |
Эти опыты показали, что в неоабиетиновой кислоте присутствует изопропиленовая группа в конъюгированном положении к двойной связи в кольце, но не давали возможности выбора между двумя формулами (XL, XLIV).
Сделать выбор в пользу формулы (XL) можно было на основании данных абсорбционного спектра. Максимум абсорбционного спектра для неоабиетиновой кислоты равен 250 тц. Вещества, имеющие две двойные связи, расположенные аналогично варианту (XL), имеют адсорбционный максимум около 252 тц, а вещества с двойными связями, расположенными, как в варианте (XLIV), имеют абсорбционный максимум около 242 тх.
Окончательное решение вопроса о строении неоабиетиновой кислоты было найдено [130] при исследовании продуктов разложения озонида, полученного при исчерпывающем озонировании. В этих продуктах обнаружена двухосновная дикетокисі лота (XLV), при дегидрировании которой получен 1-метил 5 н-пропилнафталин СцНіє (XLVI), тринитробензоат которога имеет темп. пл. 82—84° С.
|
XLV |
Константы кислоты:
Темп. пл. 173—174.5° С, [а]^—116,7° (в абс. спирте) [ЮЦ 1.1170, п-° 1,5737 [74],
Темп. кип. 227° С при давлении 4,5 мм рт. ст. [41]. Метиловый эфир абиетиновой кислоты имеет темп. кип. 210° С при давлении 6 мм рт. ст. 4,'1,0437. Tip 1.5320, [а]л —29,9° [74] темп. кип. 168—172° С Прій остаточном давлении 0,5 мм рт. ст., 1.049, Nj) 1,5346; J
Дигидрохлорид эфира имеет темп. пл. 148° С;
Этиловый эфир абиетиновой кислоты имеет темп. кип. 204—207° С при давлении 4 мм рт. ст., D^31,032. ND 1,5265;
Дигидрохлорид эфира имеет темп. пл. 143—145° С; дигидробромид лфира имеет темп. пл. 138—140° С [154].
|
СН, СНЯ |
|
XL VI |
|
АБИЕТИНОВАЯ КИСЛОТА |
Название «абиетиновая кислота» впервые дано было С. Бо-
пом [59], который в 1826 г. из живицы Pinus abies L. выделил кристаллическую смоляную кислоту. Этот препарат являлся смесью смоляных кислот и Bt современном понимании не был абиетиновой кислотой.
«Абиетиновую кислоту» до 1922 г. получали изомеризацией других смоляных кислот действием кислых агентов (включая ледяную уксусную кислоту), или под воздействием высоких (250—270° С) температур, включая перегонку канифоли под вакуумом, с последующей перекристаллизацией смесде в органических растворителях (спирте). Физические константы этих препаратов были значительно ниже полученных позднее.
Более чистый препарат абиетиновой кислоты получается в том случае, если она выделяется после разложения минеральной кислотой из перекристаллизовапной кислой натриевой соли абиетиновой КИСЛОТЫ — З С20Н30О2' CI9H29COO—Na. Данный метод был предложен Г. Дюпоном, Л. Дезальбрсом и А. Бернеттом в 1926 г. [122] и далее усовершенствован рядом исследователей [154].
Для того чтобы получить чистую кислую соль абиетиновой кислоты, рекомендуется предварительно изомеризовать первичные смоляные кислоты. Изомеризация производится в спиртовом растворе незначительным количеством соляной кислоты, а затем, после кипячения или продолжительного выстаивания, в холодный раствор добавляется рассчитанное количество спиртового раствора щелочи. Кислая натриевая соль абиетиновой кислоты как менее растворимая выпадает и может быть очищена дальнейшей перекристаллизацией из спирта. С. Палкин и Т. X. Гаррис [140] этим методом получили абиетиновую кислоту с темп. пл. 170—174°С, [a]D—102,0° (в спирте). Они же изучили свойства некоторых аминовых солей абиетиновой кислоты (табл. 32) и отметили, что путь очистки абиетиновой кислоты
|
Т аб л и ц а 32
|
|
Через органические основания эффективнее метода очистки через натриевые соли. |
Наиболее чистый препарат абиетиновой кислоты темп. пл. 173—174,5°С и [а]о—116,7° (в спирте) получили И. И. Барды - шев и Л. И. Ухпва [10] разложением многократно перекристаллизованной борниламиновой соли абиетиновой кислоты.
Абиетиновая кислота была найдена в живице P. silvestris (сосны обыкновенной) {4, 10], P. pallasiana (сосны крымской) [14] P. insignis (сосны кавказской) [3], P. pithyusa (сосны пицунд - ской) [3], P. sibirica (кедра сибирского) [75, 109], Picea excelsa (ели европейской) {12, 104], Picea ajansis (ели аянской) [105]. Larix sibirica (лиственницы сибирской) [75], Abies sibirica (пихты сибирской) [76].
"Исследование строения абиетиновой кислоты начато раньше, других смоляных кислот. Именно для абиетиновой кислоты установлена фенантреновая структура, и на препаратах абиетиновой кислоты доказано положение заместителей. Мы считали целесообразным материал по этому вопросу дать раньше! в отдельном разделе до рассмотрения строения левопимаровой^ палюстровой и неоабиетиновой кислот.
Показав структуру абиетиновой кислоты, мы тем самым очі разили структуру и других кислот типа абиетана, изомеризукм щихся в абиетиновую кислоту и отличающихся от нее только< иным расположением двойных связей.
Присутствие двух двойных связей в абиетиновой кислоте доказано гидрированием. При частичном ее гидрировании получено четыре дигидроабиетиновые кислоты С2оНзг02 [154]. При полном гидрировании получены а и р-тетравидроабиетиновые кислоты C20H34O2. При титровании гидроперекисью бензоила и гидроперекисью ацётила поведение двойных связей различно. Одна двойная связь реагирует быстро, другая — медленно и* требует дополнительных активаторов. Реакция насыщения двой-| ных связей роданом идет иначе, чем реакция насыщения йодом.1 Насыщение роданом идет не полностью, а селективно. Вследствие этого родановое число абиетиновой кислоты близко к '/2, ее йодного числа. В этом случае поведение абиетиновой кислоты подобно поведению линолевой кислоты. Абиетиновая кислота образует дигидрохлорид, темп. пл. 205°С и дигндробро - мид, темп. пл. 175—176° С, [а]1)+29,2° (в уксусноэтиловом эфире) [154].
Значение величины молекулярной рефракции также показывает, что в абиетиновой кислоте присутствуют две двойные связи. Только при введении инкремента 3,47 (для двух двойных связей) опытная величина молекулярной рефракции (с неболь-, шой экзальтацией) совпадает с вычисленной величиной. Так, для абиетиновой кислоты D2Ow 1,1170, NDw 1,5737, MR0UЫт - 89,25, М/?выч 88,57. Экзальтация 0 68 [74].
Когда Б. А. Арбузов [43] и Л. Ружичка, Д. Анкерсмит и Б. Франк [43] впервые сообщили, что абиетиновая кислота мо-
жег присоединять малеиновый ангидрид, то казалось, что наблюдения указывают на конъюгацию двойных связей в одном и том же кольце «В».
Позднее Р. Г. Бекон и Л. Ружичка [113], X. Винхауз и В. Зандерман, В. Н. Крестинский, Н. И. Персианцева и А. А. Новак [43] нашли, что абиетиновая кцслота и ее эфиры присоединяют малеиновый ангидрид благодаря реверсии абиетиновой кислоты в левопимаровую, происходящей при высоких температурах.
Еще позднее Г. X. Гаррис и Т. Ф. Сандерсон {130] показали возможность получения также и неоабиетиновой кислоты из абиетиновой.
Следовательно, в ряду смоляных кислот типа абиетана возможны изомерные превращения не только в сторону образования абиетиновой кислоты из левопимаровой, палюстровой и нео - абиегиновой кислот, но и в обратном направлении.
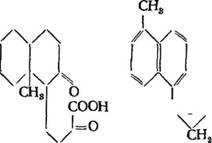
В 1938 г. Л. Ружичка и Л. ЦІтернбах [150] окислили абиетиновую кислоту перманганатом калия в щелочной среде и нашли в продуктах окисления а-тетрагидроксиабиетиновую кислоту СгоНйОв с темп. пл. 248—250° С, [u]D — 39,4° (в метиловом спирте), получили метиловый эфир кислоты с темп. пл. 221— 222,5° С. Окислив а-тетрагидроксиабиетиновую кислоту тетра - ацетатом свинца, получили аморфную смесь кислот состава СгоНгяОэ или С&іНзоОе; дисемикарбазон этой смеси имел темп, пл.' между 178 и 192°С; метиловый эфир смеси имел темп, кип. 199—202° С при 0,35 мм рт. ст. При дальнейшем окислении этой смеси бромноватистонатриевой солью получили с 20%-ным ВЫХОДОМ четырехосновную кислоту С15Н22О8 (XLVIII), темп. пл. 245—246,5° С [аЬ20—6,49° (в спирте). Эта четырехосновная кислота с диазометаном дала тетраметиловый эфир с темп. пл. 73,5—74,5° С. 1
|
НООС сн8 |
На основании результатов окисления Л. Ружичка и П. Штернбах предложили два варианта строения абиетиновой кислоты: (XLVII) (XLIX).
/ СН
|
|
|
|
|
Соон cootf |
|
|
|
|
|
Сн. |
|
Соон |
|
XLVII |
XLVIII
НООСч/СН8
|
|
В. Н. Крестинский, А. А. Новак и H. Ф. Комшилов в 1939 г. [43] произвели озонирование двух образцов абиетиновой кислоты и исследовали продукты расщепления диозоиидов. Анализ показал, что при разложении озонидов не образуется4 летучих продуктов, но получаются водорастворимые продукты, среди "которых найдена аморфная трехосновная кислота СгоНзоОв (L). Эта кислота, как показывает формула, подтверждает вышепри-1 веденные два варианта, но не дает основания для выбора; между, двумя формулами (XLVII) или (XLIX), предложенными] для абиетиновой кислоты J1. Ружичкой и J1. Штерибахом. ;
НООС СН8
|
Г |
Х/сн«
СН,
/
CHS
J1. ф. Физер и В, П. Кемпбелл в 1938 г. [126] сравнили абсорбционные спектры стеринов (235,0—242,0 щі), в структуру которых 'входят две двойные связи в сопряженном положении, расположенные в двух кольцах с абсорбционным спектром абиетиновой кислоты 241,0 тц, и пришли к выводу, что абиетиновой кислоте также принадлежит конъюгнрованная система двух двойных связей в двух кольцах (XLVII).
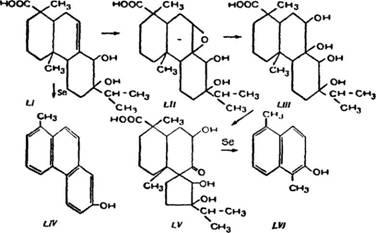
Далее большой интерес представляет серия работ J1. Ру - жички и Л. Штернбаха (150]. В 1940 г. они показали, что первым продуктом окисления перманганатом калия абиетиновой кислоты является дигидроксиабиетиновая кислота С20Н32О4 (LI), метиловый эфир которой имеет темп. пл. 106—107° С. Эта кислота при дальнейшем окислении переходит в оксидодиоксиабие-
тиновую кислоту СгоНзо05 (LII) с темп. пл. около 130—150° С, [а]и — 52е (в метиловом спирте). Этот оксид нестабилен даже в нейтральном водном растворе и быстро шдролизуется до - у-тетрагидроксиабиетиновой кислоты, с темп. пл. около 130— 150°С, [afo—30° (в метиловом спирте). у-Кислота при стоянии претерпевает превращение в р-тетрагидроксиабнетиновую кислоту с темп. пл. около 130—150°С, [afo~67° (в метиловом спирте), ее метиловый эфир имеет темп. пл. 70—Ю0°С. В свою очередь у-кислота под воздействием разбавленных минеральных кислот превращается в выше описанную а-тетрагидроксиабие - тиновую кислоту.
Все три a-, р и у-изомера гетрагидроксиабиетиновой кислЪты можно считать стереоизомерами, которые могут быть представлены одной и той же формулой (LIII).
При дегидрировании селеном дигидроксиабиетиновой кислоты J1. Ружичка и Л. Штернбах [150] получили кроме ретена (XX) 1-метил-7-оксифенантрен Ci5H120 (LIV) с темп. пл.. 190— 191° С, его ацетат с темп. пл. 137—138° С, а при дегидрировании с селеном кетотриоксиабиетнновой кислоты СгоНзгОб (LV), найденной в продуктах окисления а-тетрагидроксиабиетиновой кислоты, получили 1,5-димєтил-б-оксинафталин С12Н12О (LVI) с темп. пл. 162—163°С, его бензоат с темп. пл. 151—151,5°С и другой неидентифицированный диметилоксинафталин с темп, пл. 99—100° С.
|
|
Получение двух фенолов (LIV) и (LVI) показывает, что две двойные сопряженные связи абиетиновой кислоты примыкают к 7 и 14-му углеродным атомам.
При окислении тетраацетатом свинца димера лактона тетра - гидроксиабиетиновой кислоты СыНкОю (LVII) с темп. пл.
330°С, (a]D — 77° (в хлороформе), J1. Ружичка и J1. Штернбах {150] получили днмер днкетолактона СзвНвеОв (LVIII) с темп. пл. 162—164°С, ди-пара-ннтрофеннлгндразон которого имел темп, пл. 275—277° С.
—ОСч СН8
-о— ,он
Л
|
С |
V-oh
|
Сн8 |
|
.0- |
LVII
^CHg
NM,
LVIII
Соединение СзвНввОз, представленное формулой (LVIII), может образоваться только при условии, если абиетиновой кислоте приписывать строение (XLVII).