Химическая неоднородность сварного соединения
ОБЩИЕ ПОЛОЖЕНИЯ
Формирование сварного соединения при сварке плавлением сопровождается сложными диффузионными процессами в жидкой и твердой фазах, которые приводят к изменению химического состава в различных зонах, выделению или перераспределению примесей и легирующих элементов. При рассмотрении явления концентрационного переохлаждения уже указывалось на то, что состав кристаллизующейся твердой фазы будет отличен от состава исходного расплава. Вследствие этого по мере увеличения количества затвердевшего металла состав остающегося расплава, так же как и состав образующейся твердой фазы, будет постоянно изменяться. Поэтому при неизменности общего количества примесей в кристаллизующемся объеме сварочной ванны содержание их в различных участках шва неодинаково, что может приводить как к изменению прочностных характеристик, так и к снижению показателей свариваемости.
В качестве примера рассмотрим процесс кристаллизации рас
плава со средним содержанием примеси СЖо. Процесс протекает в интервале кристаллизации АТ, в котором жидкая и твердая фаза находятся в равновесии.
|
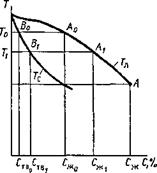
Рис 12 23 Диаграмма состоя - ния сплава, образующего непрерывный ряд твердых растворов |
На рис. 12.23 приведен участок диаграммы состояния сплава, содержащего примесь С, образующую непрерывный ряд твердых растворов. В начальный момент затвердевания при температуре Т0 (на диаграмме точка Л0) образующаяся твердая фаза имеет состав, соответствующий точке В0 на линии солидуса, т. е. содержит Ств» примеси, входящей в твердый раствор. Поскольку это количество меньше, чем среднее, находящееся в расплаве исходного состава, он обогащается компонентом С до содержания Сж|. Температура кристаллизации расплава этой концентрации будет ниже и соответствует Ті, а образующаяся из него твердая фаза, состав которой определяется соответствующей точкой В на кривой солидуса, будет содержать Ств, примеси и т. д. Таким образом, вследствие того, что образующаяся твердая фаза всегда будет иметь меньшее количество примеси, чем ее средняя концентрация в расплаве, на поверхности раздела жидкой и твердой фаз будет находиться слой жидкости, обогащенной примесью, — участок концентрационного уплотнения.
В условиях медленного протекания процесса затвердевания вследствие диффузии, а также конвективного перемешивания растворенная примесь частично отводится от поверхности раздела. В результате устанавливается некоторая пограничная концентрация, обеспечивающая рост твердой фазы. При малых скоростях кристаллизации межфазная выравнивающая диффузия проходит полностью и состав жидкой и твердой фаз будет идентичен.
В реальных условиях кристаллизации сварных швов, даже в случае сварки на «мягких» режимах, диффузия в твердую фазу незначительна и поэтому полного выравнивания концентраций не происходит. Значительно большее значение имеет процесс отвода примеси из зоны концентрационного уплотнения в жидкую фазу. Скорость протекания этого процесса зависит от температуры расплава, свойств примеси и жидкой фазы, а также от внешних воздействий — конвективного, электромагнитного или механического перемешивания.
При отсутствии внешних воздействий интенсивность диффузионных процессов и конвективного перемешивания чаще всего бывает недостаточной для полного выравнивания концентрации в жидкости, в результате чего протяженность участка
концентрационного уплотнения и степень последнего могут увеличиваться по мере роста объема твердой фазы.
В последних порциях кристаллизующегося расплава концентрация примеси будет приближаться к Сж, а в образующейся при этом твердой фазе — к СЖо, что соответствует исходному среднему в расплаве. Последние порции жидкости могут быть настолько обогащены примесью, что ее концентрация в расплаве достигнет эвтектической. Оттесняемая гранями растущих кристаллитов, она затвердевает последней, образуя межзеренные прослойки.
Неоднородность по химическому составу, наблюдаемая в отливках или сварных швах в результате особенности кристаллизационных процессов, называется ликвацией, а участки закристаллизовавшегося металла с выраженным увеличением содержания примеси — ликвационными зонами или просто ликвациями.
Наличие зон с увеличенной концентрацией примеси приводит к существенному снижению температуры конца затвердевания сплава, определяемой как температура неравновесного солидуса.
Распределение примеси или легирующего элемента при постоянной скорости кристаллизации принято выражать через коэффициент распределения k — отношение концентраций элемента в твердой и жидкой фазах Ств/Сж. Для большинства сплавов k < 1, т е растворимость элемента в твердой фазе меньше, чем в жидкой.
ВИДЫ ХИМИЧЕСКОЙ НЕОДНОРОДНОСТИ
СВАРНЫХ ШВОВ
|
Рис 12 24 Виды химической неоднородности сварного шва |
В сварных швах различают следующие виды химической неоднородности: внутрикристаллитную, межкристаллитную, неоднородность в зоне сплавления, зернограничную и внутризе - ренную. Последние два вида относятся к деформированному и рекристаллизованному металлу, главным образом к металлу околошовной зоны Основываясь на ранее изложенном представлении о природе возникновения химической неоднородности при кристаллизации расплава, рассмотрим процесс образования различных ее видов (рис. 12 24).
Внутрикристаллитная химическая неоднородность.
Внутрикристаллитная неоднородность проявляется как различное содержание примеси в последовательно кристаллизующихся точках кри-
|
х |
|
х |
|
о |
|
О |
|
|
Рис. 12 25 Характер распределения химической неоднородности в зависимости от условий кристаллизации
сталлита (1, 2, 3, 4). Степень неоднородности такого вида может быть различна и определяется условиями кристаллизации сварного шва:
а) кристаллизация протекает в условиях полного перемешивания расплава при ограниченной диффузии в твердую фазу. Концентрационное уплотнение в этих условиях практически отсутствует, а кристаллизация проходит при постоянном увеличении концентрации примеси в расплаве (рис. 12.25, а). Содержание примеси в твердой фазе для этих условий может быть подсчитано как
|
,*0-1 |
|
(12.46) |
С тв-— &оСож(1 g')
где g — доля затвердевшего металла в общем объеме; k0 — коэффициент распределения;
б) конвективные потоки в расплаве малы, а скорость кристаллизации достаточно велика, и диффузионные процессы в жидкости не обеспечивают равномерного распределения примеси. В этом случае возникает концентрационное уплотнение, протяженность и величина которого остаются практически постоянными, резко изменяясь лишь к концу процесса (рис. 12 25,6).
На участке I концентрация примеси в твердой фазе зависит от коэффициента распределения k и может быть подсчитана в функции расстояния х от точки начала кристаллизации по уравнению
Сп= С0[1 — (1 — £0)ехр (— хп Кр/О ж), (12 47)
содержание примеси в твердой фазе; Со—исходная
средняя концентрация; k0—коэффициент распределения; цкр — скорость кристаллизации; D ж—коэффициент диффузии примеси в жидкости.
На стадии установившегося процесса II концентрация примеси остается практически неизменной, резко увеличиваясь лишь в завершающей стадии затвердевания ///;
в) кристаллизация протекает прерывисто вследствие наличия концентрационного уплотнения, выделения скрытой теплоты кристаллизации, а также из-за колебаний параметров режима сварки.
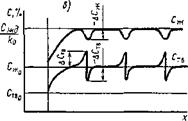
В двух ранее рассмотренных случаях нами не учитывалось влияние диффузии на степень химической неоднородности. При установившихся непрерывных процессах кристаллизации незначительное диффузионное перераспределение примесей приводит к некоторому выравниванию концентраций, однако качественно картину их распределения не изменяет. Для прерывистого процесса кристаллизации характерно появление определенной периодичности в распределении примесных элементов по длине кристаллита. В момент замедления, а затем и остановки процесса диффузия примеси в жидкую и твердые фазы начинает играть существенную роль в выравнивании составов как внутри однородных фаз, так и между твердой и жидкой. Из рис. 12.25, в, видно, что в момент остановки процесса затвердевания слои жидкости, прилегающие к твердой фазе, обедняются примесью
(—ДСЖ), а затвердевший металл обогащается ею. Возобновление процесса кристаллизации из обедненного состава жидкой фазы приводит к снижению содержания примеси во вновь образующихся кристаллитах ( —ДСТВ). Повторяясь периодически, этот процесс приводит к появлению так называемой слоистой неоднородности. Количество легирующего элемента в жидкой и твердой фазах иа границе сплавления определяется следующими зависимостями:
ед=СЖа[-Ц^ехр(-хцкр/'Ож)+і] ; (12.48)
ДСтв=СЖо-^^П ж ( — (12.49)
ко V, V2/
где Пж—коэффициент диффузии примеси в расплаве; v — скорость движения межфазной границы (роста кристалла); fe0 — коэффициент распределения; х — расстояние от межфазной границы.
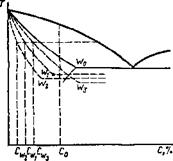
В общем виде в зависимости от конкретных условий процесса затвердевания распределение примеси по длине кристаллитов представлено на рис. 12.26. Любой процесс, приводящий к перемешиванию в жидкой фазе, уменьшает протяженность зоны концентрационного уплотнения. Для этих условий при проведении расчетов принято применять не равновесный коэффициент рас-
с,%
|
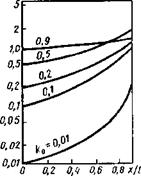
Рис. 12.27. Кривые распределения примесей в твердой фазе для различных значений k0 |
|
Рис. 12.26. Распределение примеси по длине I кристаллита: |
/ — равновесная кристаллизация; 2 — полное перемешивание расплава; 3 — отсутствие перемешивания; 4 — частичное перемешивание
пределения ko, а эффективный &Эф, который подсчитывается следующим образом:
кЭф— - г~Т7ї—7 Т7ТГТ’ (12-5°)
т Ао + (1 — £о)ехр(— vb/Dx)
где б — глубина обогащенного примесями слоя расплава, примыкающего к поверхности кристаллизации; для реальных сварочных процессов 6= 10-2... 10_3 см.
Для практики наибольший интерес представляет распределение примесей в последней стадии кристаллизации, так как именно это определяет температуру неравновесного солидуса и такие важные технологические характеристики, как температурный интервал хрупкости и пластичность металла шва в процессе кристаллизации. Приведенные на рис. 12.27 зависимости, характеризующие распределение примесей по длине I кристаллита в зависимости от ko, показывают, что с уменьшением ko степень неоднородности увеличивается.
Межкристаллитная химическая неоднородность. Межкристал- литная химическая неоднородность определяется как отношение концентраций примеси в пограничной зоне и в центре кристаллита (С5/С2, см. рис. 12.24). Микрохимическая неоднородность, возникающая внутри столбчатых или равновесных кристаллитов, определяет и состав пограничных зон между ними. Установившаяся пограничная концентрация в жидком расплаве при расстоянии между соседними кристаллитами (ветвями дендритов или ячейками), равном 26, начинает резко возрастать, иногда достигая значений, достаточных для образования новой фазы. При ячеистом или дендритном типе кристаллизации в результате
|
ШІ |
||||
|
W |
s/s ж |
|||
|
о/ |
|
S) |
|
Рис. 12.28. Распределение примесей в зоне срастания кристаллитов |
прямого и бокового роста выступов примеси оттесняются в межъячеистые или междендритные пространства. На рис. 12.28 показано распределение примесей в зоне срастания кристаллитов при дендритном (а) и ячеистом (б) типе кристаллизации. В центральной части шва в зоне встречи двух противоположных фронтов кристаллизации обычно количество примесей невелико, во всяком случае не больше, чем в пограничных областях между соседними ячейками или ветвями дендритов, так как большая часть примесей захватывается боковыми гранями или ветвями.
Химическая неоднородность в зоне сплавления и в околошовной зоне. Рекристаллизационные процессы, происходящие при сварке в околошовной зоне, как правило, сопровождаются перераспределением примесей, что иногда приводит к развитию химической неоднородности, особенно на границе с жидким металлом, в зоне полуоплавленных зерен. Процессы, связанные с перераспределением примесей в твердом состоянии, в отличие от ликвационных чаще называют сегрегационными, а образующиеся места скопления примесей — сегрегациями.
Рассмотрим явления, связанные с появлением межзеренной химической неоднородности в зоне сплавления и термического влияния (соответственно Сц/С7 и Сц/Сэ, см. рис. 12.24) применительно к однопроходной сварке неплавящимся электродом однородного сплава.
Концентрация примесных элементов по границам зерен даже у гомогенизированных сплавов всегда выше, чем в самом зерие. Объясняется это тем, что границы представляют собой области с сильно искаженной кристаллической решеткой, и атомы примеси, располагающиеся по ним, вносят в систему существенно меньшие искажения, чем это было бы при растворении их в кристаллической решетке. Это в равной степени относится к
примесям как внедрения (углерод, бор, азот), так и замещения (алюминий, титан, ниобий).
При изотермической выдержке при температурах гомогенизации на границах зерен и в зернах устанавливаются равновесные концентрации в соответствии со следующей зависимостью:
|
(12.51) |
Л Сзехр [£?/(#<)]
1 — С3 + ДС3 exp [Q/(i?/)] ’
где С г— концентрация примеси на границе зерна; С3 — концентрация примеси в зерне; А — константа, учитывающая энтропию системы; Q — энергия активации диффузии, зависящая от разности энергий искажения решеток на границе и в зерне.
При сварке на стадии нагрева в зоне сплавления и в прилегающем к ней основном металле, начиная с некоторой температуры Гд, получает развитие процесс выравнивания концентрации примеси в результате диффузии. Диффузия развивается как в пограничной зоне, так и внутри зерна. Степень интенсивности процесса зависит от разности концентраций, температуры нагрева, а полнота протекания — от времени пребывания рассматриваемого участка в области высоких температур.
Согласно первому закону Фика, поток диффундирующего вещества в единицу времени через единицу площади в направлении х может быть выражен как
|
|
(12.52)
где D — А ехр[ — Q/(Rt)] —коэффициент диффузии.
Элементы, находящиеся в твердом растворе в виде примесей внедрения, имеют меньшую энергию активации и поэтому диффундируют более активно. Кроме того, интенсивность процесса будет зависеть от толщины прослоек, а следовательно, от размеров зерна. Чем более мелкозернистая структура, тем тоньше пограничные прослойки и, следовательно, больше поверхность диффузии. Одновременно с процессом рассасывания обогащенных примесями границ зерен начинается и их объединение, т. е. процесс слияния зерен в более крупные.
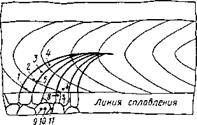
На рис. 12.29 приведены кривые, характеризующие процессы выравнивания концентрации примеси С по границам и внутри зерна на стадии нагрева до температуры солидуса Тс. В начальный момент содержание примеси в зернах гомогенизированного сплава С3 было равномерно распределенным. Содержание ее на іранице составляло сг. Начиная с температуры Та происходит выравнивание концентраций и к моменту плавления в пограничной зоне шов — основной металл, разница в содержании примесей становится минимальной
Максимальная температура нагрева у зоны сплавления достигает температуры плавления (неравновесного солидуса). На границе сплавления и на некотором расстоянии от нее в основном
Рис 12 29 Выравнивание концен - Рис 12 30 Локальное оплавление
трации в теле зерна и на границе границ зерен при нагреве
при нагреве
металле появляется жидкая фаза, располагающаяся по границам зерен (рис. 12.30), обогащенным примесями, и вследствие этого имеющая температуру плавления более низкую, чем зерно. С этого момента начинается обратный процесс «восходящей диффузии» примесей из тела зерна к его границе в соответствии с коэффициентом распределения. В то же время в околошовной зоне, удаленной от зоны сплавления настолько, что оплавление не происходит, продолжается диффузия примесей от границы в тело зерна вплоть до достижения равновесного соотношения.
В случае, если температура нагрева до достижения равновесной концентрации будет ниже, чем температура закалки исходного сплава, концентрация примесей на границах зерен будет повышаться. При дальнейшем нагреве вплоть до температуры начала роста зерна (Гнр) происходит рассасывание примеси. При достижении Тяр и дальнейшем ее повышении одновременно с процессом диффузии примеси в глубь зерна происходит интенсивный рост самих зерен вследствие перемещения (миграции) старых границ и образования новых.
В процессе роста зерна мигрирующие границы захватывают примесные атомы, увеличивая их концентрацию на периферии зерен (сегрегация примесей). Степень сегрегации зависит от граничной концентрации, температуры, физической природы примеси и других факторов. В случае, если концентрация примесей на границе зерна превышает пределы растворимости, возможно образование в пограничной зоне легкоплавких эвтектических фаз или даже химических соединений.
Образование обогащенных примесями границ зерна возможно также и в сплавах, претерпевших полиморфные превращения. Подобный вид микрохимической неоднородности может возникать и при эксплуатации сварных соединений при высоких температурах.
Внутризеренная химическая неоднородность. Внутризеренную химическую неоднородность обычно связывают с наличием внутри зерна инородных частиц — карбидов, интерметаллидов, фазовых включений, существующих в металле в состоянии поставки. При воздействии термического сварочного цикла они могут не раствориться в связи с небольшим временем нахождения при высоких температурах и остаться в зоне термического влияния. Кроме того, в процессе охлаждения из твердых растворов могут выпадать инородные фазы, которые приводят к увеличению внутризеренной химической неоднородности (С10/С9, см. рис. 12.24).
Наиболее вероятное место расположения этих включений — зоны упругого искажения кристаллических решеток и места скопления дефектов физического строения, так как эти зоны обладают повышенным уровнем потенциальной энергии. Сосредоточение в них примесей приводит к снижению внутренней энергии и повышению степени равновесности всей системы. Иными словами, движущая сила образования сегрегаций имеет термодинамическую основу.
Вокруг дефектов кристаллической решетки, в частности вокруг дислокации, наблюдаются «атмосферы» из растворенных атомов. Концентрация их по сравнению со средним содержанием ■может быть подсчитана так:
C, exp[Q/(J? Q] l + C0exp[Q/(«/)] ’ 1 ^
где С — концентрация растворенного элемента в области физического дефекта строения; С0 — средняя концентрация в равновесной области; Q — разность энергий искажений после растворения атомов второго элемента в первоначально неискаженном и искаженном участке кристаллической решетки.
С повышением температуры и увеличением времени выдержки концентрация примесей в самом зерне стремится к выравниванию; чем больше несоответствие растворенного элемента в решетке растворителя, тем больше Q и тем вероятнее процесс диффузии его к границе зерна либо в область физических дефектов кристаллической решетки. Поэтому примеси, сильно искажающие решетку маточного раствора, будут интенсивно стремиться к границам зерна и обогащать ее, влияя тем самым на механические и физико-химические свойства сплава.
Микрохимическая неоднородность с большой степенью точности и локальности (пятно анализа 1...4 мкм) может быть определена существующими методами анализа. При этом глубина анализируемого слоя составляет 1...3 параметра кристаллической решетки. Иногда такого анализа бывает достаточно, чтобы судить об эксплуатационных свойствах сварного соединения. Однако в ряде случаев, например при определении степени граничной неоднородности аустенитных зерен, локальность анализа может оказаться недостаточной. В этом случае представление о степени химической неоднородности можно получить, применяя аналитические методы расчета.
ВЛИЯНИЕ РЕЖИМА СВАРКИ НА СТЕПЕНЬ ХИМИЧЕСКОЙ НЕОДНОРОДНОСТИ СВАРНОГО ШВА
Химическая неоднородность сварных швов может быть следствием недостаточной технологической культуры выполнения работ или самой физической природы процесса формирования сварного соединения и свойств свариваемого металла.
В первом случае, как правило, существует макронеоднородность химического состава по длине шва или в отдельных его объемах, вызванная колебаниями в составе свариваемых материалов — покрытии, флюсе, а также нестабильностью режима и технологическими нарушениями.
Ниже будет рассмотрено влияние режима сварки на степень химической неоднородности, возникающей как следствие воздействия термического цикла на материал конструкции. При этом вероятность появления того или иного вида неоднородности зависит от характера образующейся структуры, что, в свою очередь, определяется как химическим составом сплава, так и режимом сварки, главным образом скоростью охлаждения и кристаллизации сварного шва.
Зональная, или линейная, ликвация свойственна процессу кристаллизации с плоскими фронтами. При сварке зональная ликвация проявляется весьма слабо и только при малых скоростях охлаждения, например при сварке с “предварительным подогревом.
Наиболее вероятное место появления зональной ликвации — ось шва, продольные границы, образованные встречей фронтов кристаллизации.
|
|
Зональная ликвация может существенно ослаблять ось шва и вызывает ряд нежелательных эффектов, в частности понижает пластические и прочностные характеристики шва, снижает его технологическую прочность.
Межкристаллитная, или межзе - ренная, ликвация характеризуется скоплением примеси у межзерениых границ и проявляется в случае концентрационного переохлаждения.
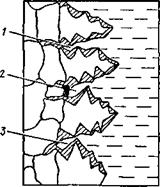
Концентрационное уплотнение, вызывая ячеистую кристаллизацию, одновременно приводит и к появлению ячеистой ликвации, которая может быть весьма значительной (концентрация примесей может измениться в 10 раз и более). Особенно сильно явление ликвации выражено в случае ячеисто-дендритных и дендрит - Рис 1231 Схема образования НЫХ Структур при Продвижении фрон - междендритной химической не - та кристаллизации в направлении за - однородности
твердевания: размер дендритов увеличивается, количество жидкости в междендритном пространстве уменьшается, а концентрация примеси в ней вырастает настолько, что может достигнуть эвтектического состава. В этом случае в междендритном пространстве могут образовываться равноосные зерна эвтектики. На рис. 12.31 штриховкой показаны места повышенной концентрации примесей в случае роста кристаллов.
Вершины боковых ветвей дендритов почти смыкаются, заключая между собой места, обогащенные примесями. При остывании порций расплава 1, 2, 3, заключенных между дендритами, происходит усадка и в образовавшиеся объемы дополнительно втягивают пограничные слои жидкости, обогащенные примесями. Такой механизм образования ликвационных зон может вызвать явление обратной ликвации, т. е. повышение концентрации примеси в первых кристаллизующихся слоях даже по сравнению со средним ее содержанием.
Такой вид химической неоднородности может проявляться при повышенной скорости кристаллизации только у сплавов, имеющих большую усадку. В этих условиях обогащенный примесями расплав, заключенный в объемах 1, 2, 3, может значительное время находиться в жидком состоянии после достижения температуры равновесного солидуса.
Продолжающийся рост дендритов приводит к «закрытию» этих объемов. Усадочные явления, сопутствующие остыванию твердой фазы, создают большие избыточные давления внутри жидкого расплава и выдавливают его в сторону, противоположную движению фронта кристаллизации, в межзеренные прослойки, расширяя их и обогащая примесями.
Внутрикристаллитная ликвация обусловлена различной растворимостью примеси в твердой и жидкой фазах. Чем больше коэффициент распределения отличается от единицы, тем сильнее будет различаться состав кристаллитов, затвердевающих первыми, от последующих.
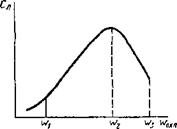
Рассмотренные ранее процессы возникновения химической неоднородности характерны в основном для малых скоростей охлаждения или применительно к сварке для «мягких» режимов. Скорости охлаждения кристаллизующегося металла шва при сварке с большими погонными энергиями q/v обусловливают достаточно интенсивное протекание диффузионных процессов, что приводит к выравниванию состава и снижает внутрикристал- лическую ликвацию (рис. 12.32). При увеличении скорости охлаждения диффузионные процессы пройти не успевают и степень внутрикристаллической ликвации Сл увеличивается вплоть до максимума при значении wi. Дальнейшее увеличение скорости охлаждения (шз), естественно, еще более подавляет диффузионные процессы, однако степень внутрикристаллической ликвации уменьшается в связи с изменением самого характера кристаллизации, приближением его к бездиффузионному процессу.
Следует заметить, что скорость охлаждения, влияя на степень
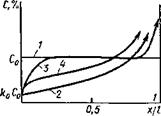
|
Рис 12 33 Смещение температуры неравновесного солидуса в зависимости от скорости охлаждения |
|
Рис 12 32 Влияние скорости охлаждения иа степень внутрикрис - таллической ликвации |
виутрикристаллической ликвации, изменяет положение точки предельной растворимости на диаграмме состояния (рис. 12.33). С увеличением скорости охлаждения от 0 до w2 точка предельной растворимости на бинарной диаграмме состояния смещается влево в сторону меньших концентраций до тех пор, пока преобладает диффузионный механизм кристаллизации. Существует предельная скорость охлаждения w2, при которой растворимость наименьшая, а степень виутрикристаллической ликвации максимальная. При дальнейшем увеличении скорости охлаждения с развитием процесса бездиффузионной кристаллизации предельная растворимость смещается вправо к равновесному положению. Однако и в этом случае увеличение скорости охлаждения однозначно приводит к снижению температуры неравновесного солидуса.