Шлаковые фазы и их назначение
Шлаки представляют собой жидкие минеральные фазы, отделяющие зеркало металла от непосредственного действия газовой атмосферы. Шлаки не изолируют металл от окружающей газовой среды, а только заменяют непосредственное взаимодействие диффузионным. Нерез шлак могут диффундировать газы или металлы (ш'виде своих низших оксидов) на границу раздела с газами, там окисляться и, возвращаясь к металлу, передавать захваченный кислород. Так, железо, обладающее переменной степенью окисления, может переносить кислород по следующей схеме (в круглых скобках — компоненты шлака):
|
м3/кг, при Т, К
|
|
Газ 02 |
|
6 (FeO) + 02-r2(Fe304)
|
|
Металл 6[FeO] 2Fe 8[FeO] |
Взаимодействие шлаковой фазы с металлом полностью зависит от ее состава, обычно сложного, и температуры. Равновесие между компонентами шлаковой и металлической фаз и возможность возникновения окислительно-восстановительных процессов определяются обобщенно законом распределения (см. п. 8.4). Активное взаимодействие шлака и металла при высоких температурах сварочного процесса приводит к изменению состава металла шва и это необходимо учитывать при разработке технологии сварки.
По типу взаимодействия с металлической ванной шлаки разделяются на окислительные и восстановительные. Например, если обозначить [FeO] концентрацию оксида в металле, a (FeO) — в шлаке, то можно написать выражение закона распределения:
LFe0= [FeO]/(FeO) =f(T). (9.60)
Если LFeo - (FeO) > [FeO], то шлак будет окислительным, и, наоборот, если LFe0* (FeO) <С [FeO], то восстановительным.
Значение Z, Feo зависит не только от температуры, но и от состава шлака и определяется обычно экспериментально. Для сварки употребляют только восстановительные шлаки и при производстве сварочных флюсов для автоматической сварки их тщательно раскисляют, а содержание FeO, S и Р строго регламентируется ГОСТом.
ГЛАВНЫЕ КОМПОНЕНТЫ ШЛАКОВЫХ СИСТЕМ
Составы шлаковых многокомпонентных фаз варьируются в широких пределах в зависимости от того, какие металлы или сплавы подвергаются процессу сварки. Так, алюмосиликатные флюсы, т. е. заранее приготовленные шлаки, удовлетворяющие процессам сварки сталей, непригодны для сварки титана или алюминия, так как эти металлы могут восстанавливать компоненты шлака и тем самым изменять состав металла шва. Поэтому компоненты шлаковых фаз должны обладать достаточно высокой термодинамической устойчивостью.
Главные компоненты шлаковых фаз по своему химическому характеру распределяются следующим образом:
|
Кислотные |
Амфотерные |
Основные |
Ненгралььые |
|
Si02; Ті02; |
А12Оз; Сг2Оэ, |
CaO; MgO; Na20; |
CaF2; Na3AlF6; |
|
В203; (Na2B407); |
(ГсоО;) |
К2О; FeO; МпО |
NaF, KF; NaCf; |
|
Р205 |
KC1; BaCh |
(вещества в скобках очень редко входят в состав шлаков, а Р2О5 и В2О3 могут входить в состав шлаков только при сварке медных сплавов).
По своему составу сварочные шлаки можно разделить на алюмосиликатные, которые очень широко применяются при сварке сталей, и бескислородные, или фторидные, имеющие применение при сварке цветных металлов, например титановых сплавов.
Алюмосиликатные шлаки. В состав этих шлаков входят Si02. AI2O3 и основные оксиды.
Диоксид кремния Si02: ДЯ°= —910,9 кДж/моль (кварц); температура плавления Тпл= 1983 К - Имеет шесть полиморфных превращений в зависимости от температуры и условий кристаллизации: а-, р-кварц а-, p-тридимит а-, p-кристобаллит жидкость. При быстром охлаждении жидкого диоксида кремния получается кварцевое стекло. Шлаки с большим содержанием Si02 дают в изломе стекловидную структуру и обладают хорошими технологическими свойствами (формирование шва, отделяемость шлака). Диоксид кремния образует многочисленные соединения с участием оксидов металлов — соли. Солеобразование Si02 можно рассматривать как взаимодействие нейтральных молекул или как образование регулярного ионного раствора (см. п. 8.4), так как жидкий шлак проводит электрический ток и представляет собой электролит.
Молекулярные комплексы с оксидом кальция образуются по следующим реакциям:
CaO-t-2SiC>2~* (СаО) (Si02)2-*CaSi20s;
3Ca0-)-4SiO2— (Ca0)s(Si02)4—<-CasSi40n;
СаО + БіОг—(СаО) (Si02) —CaSi03 (метасиликат); 3Ca0+2Si02—(СаО)з (Si02)2—Ca3Si207;
2Ca0 + Si02—(CaO)2 (Si02)-vCa2Si04 (ортосиликат).
Другие основные оксиды (FeO; MnO; MgO) дают аналогичные полисиликаты, но соли кальция наиболее устойчивы, так как обладают меньшим обобщенным потенциалом (см. п. 8.4).
Состав комплексных ионов и их строение будут меняться в зависимости от соотношения числа ионов 02~ и молекул Si02, т. е. от состава шлака. Ниже приведены составы соединений для различного числа ионов О2-, приходящихся на одну молекулу Si02
Число ионов О2- 0,5 0,75 1 1,5 2,0
Соединение. . Са2++ ЗСа2+-|- Са2+-|- ЗСа2+-|- 2Са2++
+[Si205]2- +[Si40„]6- +[Si03l2-* +[Si207]6- +[Si04]4-
В общем случае формулу комплексного иона с участием Si02 можно записать в виде Si*0#*~. Образование из тетраэдров lSi02]4- цепей, лент и объемных комплексов приводит к тому, что вязкость жидких ионных растворов, содержащих много Si02, очень велика, а электропроводность достаточно мала. В ионное состояние Si02 может переходить и самостоятельно при температурах, существенно превышающих температуру плавления:
2Si02^Si4+ + Si0j-; 3Si02^Si4+ + 2Si032^,
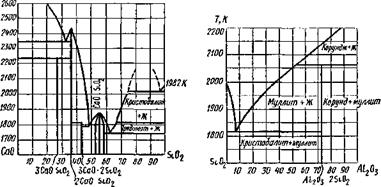
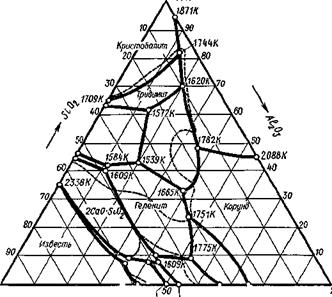
но вообще этот процесс энергетически маловероятен. Солеоб - разование в результате реакции между оксидом кальция и кремнеземом можно проследить по диаграмме плавкости СаО—Si02, приведенной на рис. 9.32.
Кремнезем Si02 может образовывать соли и с амфотерными оксидами, например с А1203, который тоже можно рассматривать как тетраэдры [А104]5~, так же как и (В04)5- — тетраэдры оксида бора В20з. Структура соединений Si02 и А1203 сложная, но интересно то, что оба оксида не теряют способности к дальнейшему солеобразованию, давая тройные соли, например аннортит CaAl2Si208(CaO-Al2CV2Si02).
Солеобразование в системе Si02—А1203 можно проследить по диаграмме плавкости (рис. 9.33); главное соединение — муллит ЗА1203• 2Si02 или Al6Si20i3.
|
т. к
Рис 9 32 Диаграмма плавкости си - Рис 9 33 Диаграмма плавкости стемы СаО — S1O2 (массовые доли) системы S1O2—AI2O3 (массовые доли) |
Диоксид титана ТЮ2:ДЯ° = — 943 кДж/моль; температура плавления 7’Ш1=2115 К. Образует две формы кристаллов — рутил и анатаз. Термодинамическая устойчивость ТЮ2, несмотря на низкое значение ДЯ°, меньше, чем у Si02, так как он может восстанавливаться в свои более низкие оксиды, оставаясь при этом окислителем:
Ті02-* Ті 3О5—Ті203—ТЮ.
Создание окислительной среды без восстановления до чистого Ті широко применяется в сварочной технике (рутиловые электроды). Солеобразование диоксида титана в основном напоминает солеобразование диоксида кремния, но Ті — элемент 4 периода периодической системы Д. И. Менделеева, его гибридные орбитали менее устойчивы и способность образовывать комплексные ионы [TiOt]4- выражена тоже значительно слабее. Типичными солями для него будут метатитанаты:
FeO + Ti02—FeTiCh (ильменит);
СаО + ТіОг-^СаТЮз (перовскит);
ВаО + ТЮ2-*ВаТЮз (метатитанат бария),
последний обладает значительным пьезоэффектом. С позиций теории регулярных ионных растворов процесс солеобразования можно представить следующим образом:
Са0^Са2+ + 02-
о2- + тю2^[тю3] 2-
СаО+ТіОг^СаТіОз
Таким образом, диоксид титана представляет собой кислотный оксид, но его активность солеобразования ниже, чем у Si02.
|
Т. к |
|
Рис 9 34 Диаграмма плавкости системы СаО—АЬОз (массовые доли) |
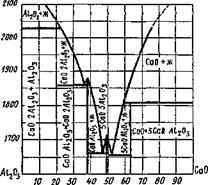
Полуторный оксид алюминия А1203: А Н° —
= — 1675 кДж/моль; температура плавления Гпл=
= 2323 К. Оксид в виде а-корунда обладает высокой термодинамической устойчивостью и не гидратируется.
В шлаках А120з ведет себя как амфотерный оксид, образуя соли с Si02 (муллит), и реагирует с основными оксидами, образуя комплексные анионы:
анион метаалюминатов А120з + 02_—<-2[А102] ~ и
анион ортоалюминатов АЬОзН-302~-*2[АЮ3]3_.
Процессы солеобразования можно проследить по бинарной диаграмме плавкости системы СаО—А120з (рис. 9.34).
Полуторный оксид хрома Сг203, присутствовавший в шлаках при сварке хромоникелевых сталей, изоморфен корунду и образует с ним твердые растворы, окрашивая их в розовый цвет.
Основные оксиды, присутствующие в сварочных шлаках и флюсах — это СаО, MgO; FeO, МпО, иногда присутствует NiO. Эти оксиды служат источником ионов О2-, которые связывают оксиды Si02, Ті02 и А120з в сложные анионы и понижают этим их химическую активность. У этих оксидов различная термодинамическая устойчивость и эффективные потенциалы ионов, влияющие на процессы их диссоциации.
Нейтральные компоненты шлаковых фаз представляют собой обычно фториды активных металлов, обладающие высокой термодинамической устойчивостью. В ряде случаев их совместные системы могут использоваться как бескислородные или фторид - ные шлаки.
Флюорит CaF2:A Н° = —1214,6 кДж/моль; 7’njl= 1673 К; Гкип=2773 К. В воде почти не растворим, не гидратируется. Флюорит образует легкоплавкие эвтектики со многими веществами, за что и получил русское название «плавиковый шпат». В сварочной металлургии он применяется очень широко и позволяет регулировать не только температуру, но и вязкость и поверхностное натяжение шлаков, что очень важно для металлургической обработки сварочной ванны.
Флюорит CaF2 хорошо диссоциирует на ионы в расплаве:
CaF2^Ca2+ + 2F-
и его можно характеризовать как «основной» компонент, так как он тоже связывает, но в летучие соединения, молекулы Si02 и ТЮ2:
1) 2CaF2 + Si02^±2Ca0 + SiF4t;
2) 2CaF2 + Ti(W2CaO + TiF*t.
Эти реакции, равновесие которых значительно сдвинуто в сторону образования летучих соединений уже при 1000 К обогащают атмосферу дуги фторидами, которые частично связывают водород и уменьшают его поступление в металл шва из газовой фазы:
3) SiF4 + 2H20^Si02+4HFt;
4) SiF4 + H2O^SiOF2 + 2HFf.
Фтористый водород более устойчив, чем, например, радикал ОН*, получающийся при диссоциации водяного пара: 2Н20^ ^Н2 + 20Н*.
На основе флюорита CaF2 готовят флюсы для сварки деталей больших толщин из титановых сплавов, так как при реакциях е высокоактивным титаном загрязнения металла практически не происходит: Ti-)-2CaF2^:TiF4t +2Caf (температура кипения кальция 1755 К).
Криолит Na3AlF6 (Л#°=— 3283,6 кДж/моль) представляет собой комплексную соль, разлагающуюся при плавлении на NaF и A1F3, температура возгонки которого ~1533 К. Температура плавления криолита 1293 К. Криолит растворяет в себе оксид А1203 (массовая доля до 15%). Шлаки, содержащие в своем составе криолит, способны растворять в себе оксиды и других металлов.
В шлаковых галидных системах используются еще такие га - лиды, как CaF2 (АН°= — 1230 кДж/моль; 7^= 1633 К; 7’кип = = 2773 К), NaF (ДН°=-573,6 кДж/моль; 7ПЛ=1265 К; Ткяа= = 1973 К), KF (ДН°=-567,4 кДж/моль, Гпл=1130 К, Ткш= = 1773 К), а также КС1 и NaCl, которые вводят в состав шлаков для регулирования температуры плавления, электропроводности и вязкости шлаковых систем.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ШЛАКОВ
Ранее упоминалось, что теория шлаковых фаз была основана на образовании молекулярных комплексов, построенных из оксидов различного типа. Эта теория в основном дает правильные результаты, но бывают значительные отклонения, указывающие на то, что молярные (или массовые) доли веществ не отражают истинных активных концентраций. Это вполне понятно, так как в многокомпонентном растворе различные компоненты влияют друг на друга, при этом коэффициенты активности приобретают различные значения
at = y, Nl. (9.61)
Теория молекулярных комплексов всегда давала правильные результаты (полуколичественно) и позволяла прогнозировать процессы взаимодействия металла со шлаком.
Развитая в трудах О. А. Есина и его школы (Свердловск) теория регулярных ионных растворов, учитывающая энергетическое различие ионов (энергия смешения) и образование комплексных анионов Si*0/~ в результате захвата молекулами SiCb ионов О2-, позволила теоретически определить взаимодействие между ионами и дала метод расчета коэффициентов активностей компонентов исходя из основных положений статистической термодинамики. Основы этой теории изложены в монографии
В. А. Кожеурова «Термодинамика металлургических шлаков» и в ряде последующих работ. Основной вывод из этой теории— возможность вычисления энергии Гиббса для всей системы регулярного ионного раствора.
При различных массовых соотношениях одних и тех же компонентов шлак может быть или основным, или кислым. Если основной шлак содержит до 10% Si02, то можно пренебречь ком - плексообразованием Si*Ofi - и ограничиться только расчетом энергий взаимодействия ионов между собой. В этом случае получаем совершенный ионный раствор (СИР). Но если шлак кислый и содержит много комплексных ионов SixO/“, то нужно также учитывать энергию и энтропию образовавшихся комплексов, т. е. рассматривать шлак как регулярный ионный раствор (РИР).
Недостаток достоверных данных сильно затрудняет точные расчеты, так как термодинамические данные, полученные из рассмотрения бинарных диаграмм состояния, переносить на многокомпонентные системы можно лишь условно. Тем не менее расчеты по этой системе уже нашли применение в сварочной металлургии для определения основности шлаков В и активностей" наиболее важных компонентов шлаковых фаз (Si02; МпО).
Физические свойства сварочных шлаковых систем. Температура плавления сварочных шлаков должна быть, как правило, ниже, чем температура кристаллизации свариваемого металла. Температура плавления в сложных системах представляет собой функцию состава и определяется соответствующими диаграммами плавкости (состав — свойство). Сплавы силикатов и алюмосиликатов обладают способностью к переохлаждению и образованию стекловидных шлаков, а это обстоятельство осложняет задачу экспериментального исследования.
|
SiQz~WO
Рис. 9.35. Треугольник составов тернарной системы (Гиббс) |
|
Рис. 9 36. Схематический вид диаграммы плавкости системы СаО— Si02—АЬОз |
Ранее были показаны двойные диаграммы плавкости систем компонентов шлака: Si02—СаО (рис. 9.32), А120з — Si02
(рис. 9.33), АЬОз—СаО (рис. 9.34).
Диаграмма плавкости существенно осложнится, если эти три компонента будут присутствовать одновременно в шлаковой системе — могут возникнуть не только двойные, но и тройные соединения — алюмосиликаты:
анортит CaAl2Si20e (АН°=—4223,9 кДж/моль), геленит Ca2Al2Si07 (ДН° = — 3986,9 кДж/моль), которые тоже будут образовывать растворы и эвтектики с другими компонентами сплава.
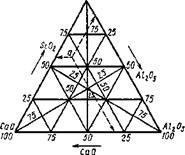
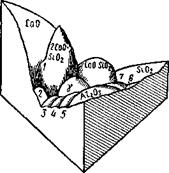
Для трехкомпонентной (тернарной) системы диаграммы плавкости будет уже объемной: вместо оси составов, на которой можно задать состав двухкомпонентной системы, состав будет определяться треугольником Гиббса (рис. 9.35). Стороны правильного треугольника будут представлять собой оси составов бинарных сплавов, а медианы, совпадающие с биссектрисами и высотами, будут показывать содержания данного компонента в тернарном сплаве. Оси температур — перпендикуляры, восставленные из вершин треугольника. Общий схематический вид диаграммы плавкости системы СаО—А1203— Si02 приведен на рис. 9.36 в виде волнистой поверхности с глубокими впадинами эвтектик.
Однако пользоваться такой диаграммой невозможно. Тогда проводят изотермы, представляющие собой плоскости, параллельные основанию, и проектируют кривые сечений на треугольник Гиббса с соответствующим обозначением температур. Треугольник Гиббса с горизонталями приведен на рис. 9.37. Экспериментальное исследование такой диаграммы плавкости очень трудоемко и пригодно только для трехкомпонентных шлаков. Такого же типа диаграммы плавкости построены для систем MgO— А120з—Si02; МпО—Si02—А1203; FeO—МпО—Si02 и др, встрсча-
|
|
|
1985К |
|
СаО |
|
№ |
~Щ ' 60 т ТО Г 80 90 ШЪК
18028 ШОК 16858 18718 1989К
—-- СаО
Рис. 9.37. Треугольник Гиббса с нанесенными горизонталями ющихся в системах сварочных флюсов и металлургических шлаков.
Так как реальные сварочные флюсы многокомпоненты (см. с. 348), то для них построить диаграммы плавкости в трехмерном пространстве нельзя и в этом случае строят тройные диаграммы плавкости, полагая содержание остальных компонентов постоянным. Так, введение CaF2 в систему СаО—А120з—Si02 понизит температуры плавления в системе и тогда, считая массовую долю CaF2 постоянной (5 или 10%), вновь строят тройную диаграмму.
Диаграммы плавкости для сварочных флюсов приведены, например, в работе Н. Н. Потапова. Аналогичным образом строят диаграммы плавкости и для фторидных флюсов. Подбор необходимой температуры плавления сварочного шлака осуществляют изменением его состава (чаще всего изменяя содержание
CaF2).
Вязкость шлаков прежде всего должна удовлетворять технологии сварки, так как от ее значения зависят условия формирования сварочного шва, интенсивность металлургических реакций на границе металл — шлак, отделение шлаковых включений от металла (экзогенные включения); особенно высокие требования предъявляются к вязкости шлаков при сварке в вертикальном и потолочном положениях. Вязкость зависит от температуры и
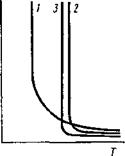
строения жидкости, т. е. от взаимодеист - вия частиц, ее составляющих. Особенно сильно это проявляется для расплавов, или ионных растворов (см. п 8.3). Ионные растворы, образованные элементарными ионами, такими, как Са2+, Na+; Mg2+; Fe2+; Мп2+; F-; О2-, обладают малой вязкостью, резко меняющей свое значение в момент кристаллизации — «короткие шлаки». Это характерно для так называемых основных шлаков (см. п. 9.4).
|
Рис 9 38 Изменение вязкости «длинных» (1) и «коротких» {2, 3) шлаков в зависимости от температуры |
Ионные растворы, содержащие большое количество ионов типа Si*OJ~, или S1O2, склонного к полимеризации (тетраэдры [S1O4]4-), обладают повышенной вязкостью при высоких температурах и медленно меняют ее в процессе затвердевания, сопровождающегося значительным переохлаждением Такие системы называются «длинными шлаками». На рис. 9. 38 приведены кривые изменения вязкости в зависимости от температуры для основных шлаков, содержащих большое количество элементарных ионов «коротких», и для кислых шлаков, содержащих значительное количество ионов SixOJ - («длинных»).
Значение вязкости тесно связано с электропроводимостью ионных растворов:
т)-ц« const, (962)
где т) — вязкость; р, — электропроводимость.
Таким образом, для определения температур затвердевания шлаковых систем можно использовать электрические измерения, Вязкость расплавленных сварочных шлаков при температурах существования сварочной ванны не должна превышать 0,2.. 0,4 Па-с.
Поверхностное натяжение жидкости зависит от температуры и от природы жидкости или ее состава, если жидкость представляет собой раствор.
С повышением температуры поверхностное натяжение <т уменьшается. Для полярных жидкостей применим закон Этвеши:
о —А (Гкрит— Т), (9.63)
где Ткрит—критическая температура данного вещества; Т — текущая температура; А — постоянная.
Из закона Этвеши следует, что при критической температуре на границе жидкость — пар поверхностное натяжение обращается в нуль.
Для жидких металлов и шлаковых систем критические условия неизвестны, но снижение поверхностного натяжения при увеличении температуры наблюдалось многими исследователями.
Поверхностная энергия зависит от неуравновешенных сил, действующих между частицами жидкости (среда большой плотности), и частицами газа или паров жидкости, взаимодействующих с поверхностью (среда малой плотности).
Таким образом, граница раздела обладает свободной энергией
ЛС„„в=Д#пов—' T’Asno,,, (9.64)
где Д#„ов— поверхностная энергия (аЕ); saoв—энтропия образования единицы новой поверхности.
Уравнение (9.64) также указывает на снижение поверхностной энергии с повышением температуры.
Так как при стремлении к равновесию AGnoB—►О, то этот процесс может быть осуществлен двумя путями:
1) уменьшение площади поверхности раздела, например, вследствие роста зерна при рекристаллизации или в зоне термического влияния при сварке, а также при слиянии мелких капель в более крупные;
2) снижение сг в результате адсорбции на границе раздела частиц из газовой фазы или из жидкого раствора.
Если молекулы из жидкого раствора адсорбируются в пограничном слое, то поверхностное натяжение снижается и вещество считается поверхностно-активным (ПАВ):
1^-* Со, Ор—р Очист-
(9 65)
Если Сі < со и (Тр_р > Очист, то вещество будет поверхностно-инак - тивным.
Как показал В. К. Семенченко, в шлаковых системах поверхностные слои будут обогащены ионами с высоким обобщенным потенциалом, что подтверждается также работами С. Б. Якобашвили.
Значения поверхностных энергий в зависимости от строения жидких веществ изменяются в очень широких пределах (табл. 9.6).
Поверхностное натяжение алюмосиликатных шлаков в зависимости от состава колеблется в пределах 0,3...0,45 Дж/м2, а галидных шлаков — 0,15...0,2 Дж/м.
|
Таблица 96 Поверхностные натяжения некоторых жидкостей
|
Поверхностное натяжение на границе раздела двух жидких фаз по правилу Антонова приблизительно равно их разности:
|
Рис 9 39 Краевые углы при смачивании жидкости жидкостью |
о = а, — сг2 (9 66)
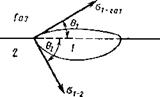
Таким образом, на границе раздела шлаковой и металлической фаз поверхностное натяжение будет весьма значительным. Явление смачивания определяется уже не одним углом 0, а двумя, как это показано на рис. 9.39.
Работа адгезии на границе раздела
Л =о(1 + cos 0), (9 67)
где А — работа адгезии или отрыва одной фазы от другой; а — поверхностное натяжение; 0 — угол смачивания
Если угол смачивания 0->-О, то работа Л=2сг, а при отсутствии смачивания 0 = л работа А->-0. Таким образом, взаимное разделение жидкостей, определяемое работой адгезии А, также зависит от состава шлаковой и металлической фаз.
Поверхностное натяжение влияет на скорость окислительновосстановительных реакций, идущих на границе раздела металл — шлак. Оно удерживает ванну и придает ей определенную форму при сварке в различных пространственных положениях. Кроме того, оно влияет на отделимость шлаковой корки от готового сварного шва при охлаждении.
Отделение шлаковой корки определяется различием коэффициентов термического расширения (ктр.), создающим скалывающее усилия при охлаждении сварного соединения, но часто при самопроизвольном отделении общей шлаковой корки на металле остаются тонкие стекловидные слои твердого шлака, прочно связанного с металлом. Их удаление требует дополнительных усилий, так как они будут мешать дальнейшим технологическим операциям. Кроме того, они могут форсировать коррозионные процессы (особенно галидные шлаки). Такое явление наблюдается при недостаточно раскисленном металле сварочной ванны.
Теплофизические свойства шлаковых систем: теплоемкость, теплопроводность, энтальпия — влияют на условия формирования сварного шва и скорость охлаждения металла шва.
ЛЕГИРОВАНИЕ И РАСКИСЛЕНИЕ МЕТАЛЛОВ ПРИ СВАРКЕ
ЧЕРЕЗ ШЛАК
Взаимодействие металла со шлаком следует рассматривать, с одной стороны, как гетерогенные окислительно-восстановительные процессы между компонентами шлака и компонентами металла на границе раздела металл — шлак, а с другой стороны,
шлак служит экстрактором, извлекающим из металла нежелательные примеси (оксиды, соединения серы и т. д.).
В результате обработки шлаком состав металла сварочной ванны существенно изменяется. Подбор компонентов шлака и их соотношений ведется таким образом, чтобы полученный состав металла соответствовал поставленным требованиям.
Как было рассмотрено ранее, прогнозировать состав и свойства шлака можно, исходя из теории молекулярных комплексов или из теории регулярных ионных растворов. Однако окончательную корректировку составов нужно проводить экспериментально.
Классификация шлаков. Взаимодействие металла со шлаком будет зависеть от основности или кислотности шлака, т. е. от преобладания в нем основных или кислых оксидов. Ранее характер шлака приблизительно оценивали отношениями:
в== (%Ca0^gMgO) >t _ шлак основной. 1 В — ^ ^СаЯ.) + (<; 1 —шлак кислый.
(%Si02)
Однако в связи с высокими требованиями к качеству сварных соединений в настоящее время такая приблизительная оценка уже не устраивает специалистов, и применяются уточненные формулы для основности шлаков исходя из теории ре
гулярных ионных растворов, в которых главную роль играет анион О2- и его распределение между элементарными и комплексными ионами Si*0;p:
В = - Щ" (9-69>
В числитель этой дроби входят все металлические оксиды, генерирующие при диссоциации ионы О2-. Н. Н. Потапов в работе [20] предлагает еще более уточненное уравнение, построенное на основании теории РИР и больших экспериментальных исследований:
D 0,0178CaO + 0,0125MgO-f0,0l3CaF2-}-0,016Na2O+0,106K2O-}-0,007 Х/, 0,0166SiO2 + 0,5(0,01 АЬОз + 0,0125ТЮ2 + 0,008ZrO2y
X(MnO + FeO) (9.70)
(компоненты в процентах массовой доли).
Основность сварочных шлаков, полученных при плавлении флюсов для автоматической сварки, колеблется в пределах от 0,6...0,7 до 2 в зависимости от назначения флюсов, сочетания состава электродного металла и основного свариваемого металла.
Окислительно-восстановительные реакции на границе раздела металл — шлак. Взаимодействие компонентов шлака и
металла в результате окислительно-восстановительных реакций на границе раздела можно рассматривать просто как гетерогенную реакцию или как электрохимический процесс. В обоих случаях изменение свободной энергии Гиббса должно быть одинаковым и независимым от механизма процесса:
|
Рис. 9 40 Распределение температур в зоне сварки- 1 — зона высоких температур (Fe + + МпОFeO + Мп), 2 — зона низких температур (Мп + + FeO - т - Fe + МпО) |
AG0 = АН — TAS — (9.71) = — ЯГ In К*, = — АЕ°п • F,
где АЕ° — стандартная разность потенциалов; п — число переданных электронов; F — постоянная Фарадея.
Хорошо известно, что изменение напряжения, а также полярности сварки оказывает заметное влияние на состав металла шва, а значение сварочного тока влияет на него гораздо меньше.
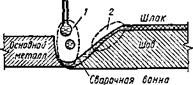
Развитие окислительно-восстановительных процессов при сварке происходит в условиях высоких температур, значительно превышающих температуры процессов выплавки стали, температурное поле в зоне сварки неоднородно и можно выделить зону высоких температур, превышающих 2300 К (высокотемпературная зона), и зону низких температур, приближающихся к температуре кристаллизации металла, т. е. ~2000 К (низкотемпературная зона), как это показано на рис. 9.40. В высокотемпературную зону 1 входит капля на плавящемся электроде, активно реагирующая с пленкой шлака, капля, проходящая столб дугового разряда и покрытая пленкой шлака, а также передняя часть ванны. Низкотемпературная зона 2 охватывает кристаллизующуюся часть сварочной ванны, где шлак окончательно должен отделиться от металла шва.
В этих условиях окислительно-восстановительные реакции в разных зонах могут менять свое направление.
Скорость реакций, учитывая гидродинамическую обстановку внутри ванны, тоже должна понижаться в хвостовой (кристаллизующейся) части сварочной ванны.
Распределение марганца между шлаком и металлом. Марганец входит в состав большинства флюсов для сварки сталей в виде МпО, а в электродные покрытия — в виде руды Мп02. Его переход из шлака в металл необходим для раскисления металла и подавления вредного влияния серы (см. с. 402). Марганец вводят в сварочные материалы в виде пиролюзита — марганцовой руды (иногда сильно загрязненной фосфорными соединениями).
Рассмотрим гетерогенное равновесие между шлаком, содержащим МпО, и сталью, которая тоже может содержать марганец как легирующий компонент:
шлак- (МпО) (FeO)
И ------------------------------ и
металл: [МпО] - f-Fe^ [Мп]+ [FeO]
Восстанавливающийся марганец будет растворяться в железе, а получающийся оксид железа будет уходить в шлак, но в зависимости от состава и характера шлака активность компонентов может изменяться в значительных пределах.
Запишем константу равновесия в слое металла:
[МпО] +Fes=t [Мп] -+- [FeO];
^_____ **Мп ^FeO f(F)
аМ nOah-
Активности компонентов можно выразить через их концентрации в металлической и шлаковой фазах, пользуясь законом распределения:
~ [%Мп| — ввиду неограниченной раство-
^Мпнас ~ 100 римости Мп в жидком железе
и близких атомных масс;
TOC o "1-5" h z IVFeO i. Feo(%FeO) (%FeO) т-
aFe0=-r. - , —, так как FeO раство-
геОнас FFeo(%FeO)aac 100
ряется в шкале неограниченно;
Ачп0 _ (%МпО) ампо— —г, = гкк — по аналогии с оксидом железа;
|
JVpe |
«Mno„,c 100
1 — по аналогии с марганцем.
Подставляя найденные значения активностей в выражение К и собирая все постоянные величины, получим
[%Мп] (%FeO)
|
(9.72) |
|
откуда (%МпО) |
Лм" (%MnO) 'F'’
[%Мп] = Кип
(%FeO) •
Если [%Мп] > [%Мп] „ в исходном металле, то происходит легирование через шлак, если [%Mn] < [%Mn] № то происходит выгорание марганца.
С повышением температуры [%Мп] в металле растет, так как реакция его восстановления эндотермична. Влияние состава шлака обычно учитывается значением константы равновесия К мп- Так, А. Д. Крамаров для сталеплавильного процесса предложил на основании экспериментальных данных следующие уравнения для зависимости констант от температуры:
для кислых шлаков (В<. 1)
gKm= 1 g 0) = ~ -^~+ 1,865; (9.73)
1~Г -1г f%Mn] (%Fe0) 5550 '
lgAM"-lg (ptaoj F~ + 2’338'
Просчитывая уравнения для Г = 2000К и отношения (%MnO)/(%FeO) = 1, получаем, что при кислых шлаках [%Мп] = 0,1230, а при основных [%Мп] =0,365, т. е в 3 раза больше, так как в кислых шлаках активность Мп2+ подавлена ионами Si*0^-. Если же этот процесс рассмотреть с точки зрения теории ионных растворов, то активность ионов Мп2+ и Fe2+ можно записать так:
/ «МпО / «FeO ,,
аМп0= {-^г) N о»-; oFe0= ЛГо-
Подставим полученные значения активностей в выражение константы равновесия:
КМп - l%Mnja,.,0. ^ = }(Т). (9.74)
аМпО ^МпО
Таким образом, приходим к уравнению константы равновесия (9.72), так как отношения мольных долей nFeо и по и массовых долей (%FeO) и (%МпО) совпадают благодаря близости молекулярных масс оксидов железа и марганца.
Марганец, перешедший из шлаков в металл в высокотемпературной зоне, при переходе в зону низких температур начинает вновь окисляться, действуя как раскислитель и связывая при этом S в MnS, кристаллизующийся при температуре, более высокой (1803 К), чем металл сварочной ванны.
Распределение кремния между шлаком и металлом. Кремний, входящий в состав флюсов и электродных покрытий в виде кремнезема Si02, в составе шлака образует комплексные ионы, строение которых зависит, как это указывалось ранее, от количества ионов О2-, возникших при диссоциации металлических оксидов. Однако кремний восстанавливается па границе металл — шлак в высокотемпературной зоне сварки. Несмотря на близкую с МпО термодинамическую устойчивость, кремний восстанавливается в относительно малых количествах, что свидетельствует о его малой активности в шлаке.
Гетерогенное равновесие на границе раздела металл—шлак можно выразить схемой:
шлак: (Si02) 2 (FeO)
металл: [Si02]+ 2Fe4=s [Si] + 2 [FeO]
Константа равновесия реакции может быть записана для металлической фазы следующим образом:
кт).
as, о, вре v
Выражаем активности компонентов через их концентрации в металлической и шлаковой фазах, пользуясь законом распределения:
as,= 1 так как атомная масса Si 28, а у Fe 56, т. е:
в 2 раза больше. В жидком железе растворимость Si неограниченная,
NFe0 (%FeO) г-
aFeo= —тт » v/0 ' так как FeO растворяется в шлаке
Fe0“ac неограниченно;
N sio2 (%S.02)
as, o2=—-—:-------------- ,--- по аналогии с оксидом железа;
“ЭЮгнас 100
GFe— 1, по аналогии с предыдущим.
Подставляем найденные значения активностей в выражение константы равновесия, собираем постоянные величины и получаем следующее уравнение:
^ _ 1% Si](%FeO)2
|
(9.75) |
Ks'~ (% S1O2) = /(Г);
Г0/с,1 ь'’ (%5іОг)
I/oblJ =
(% FeO)
В основном все закономерности сохраняются, так как переход кремния в металл [% Si] увеличивается с ростом содержания Si02 в составе шлака (кислые шлаки), уменьшается при накоплении FeO в шлаке (шлак окисленный), а также увеличивается с повышением температуры, как и для марганца.
Однако СЛОЖНОе Строение КОМПЛеКСНЫХ ИОНОВ SijcOy - и их изменчивость требуют уточнения коэффициентов активности Si02.
Так, Н. Н. Потапов предлагает для определения активности кремнезема в шлаке, с учетом его основности, следующее выражение:
_ (5Юг)ф s,°2 100В ’ (9.76)
где (Si02)cj>— содержание во флюсе (% масс); В — основность шлака, вычисляемая по формуле автора (см. с. 361).
Галинич В. И. и другие расчетно и экспериментально определили для различных марок флюса активности и соответствующие им коэффициенты активности ysiOs которые изменялись в пределах от 1,09 (флюс АН-63) до 0,5 (флюс АН-8). Существует также много других уравнений для температурной зависимости константы равновесия As,
Кремний, так же как и марганец, перешедший в металл в высокотемпературной зоне, при понижении температуры будет реагировать с оксидами Fe:
2 [FeO] + [Si] -2Fe + Si02,
образуя шлаковые включения Si02 и его солей, остающиеся в металле и влияющие на его пластичность.
Переход из шлака в металл других компонентов в заметных количествах маловероятен. Оксид AI2O3 обладает очень высокой термодинамической устойчивостью и, кроме того, образует комплексные ионы АЮу и восстанавливаться железом практически не может. Титан из шлаков, богатых ТЮ2, например при плавлении рутиловых покрытий, восстанавливаться может, но переходить в металл не будет, так как титан имеет ряд оксидов, и если он будет восстанавливаться, окисляя металл, по реакции
2ТЮ2 + Fe-* FeO + ТІ2О3,
то его оксиды ТІ2О3 или ТІ3О5 будут оставаться в составе шлака.
Углерод может окисляться в металле сварочной ванны в результате поглощения ею кислорода:
[FeO] + [С] — Fe - f - СО]
В углеродистых сталях углерод во время сварки практически частично выгорает.
Удаление шлаками нежелательных примесей из металла при сварке. В любом металле или сплаве сера — вредная примесь, резко увеличивающая склонность металлов к образованию горячих трещин и снижающая технологическую прочность. Сера хорошо удаляется восстановительными и основными шлаками в соответствии с уравнением реакции:
шлак: ( FeS)+ (CaO)i^(CaS)+ (FeO)
металл: [FeS] [FeO]
В общем виде константа равновесия будет записана так:
*s= Т&Т = кп (9-77)
“СаО °FeS
т. е. при увеличении аСао и при уменьшении FeO содержание серы уменьшается.
Полнота извлечения серы из металла (экстракция) (r]s) может быть определена по закону распределения:
Is=-{|L= Я7"), (9.78)
ГДЄ [S] = 5мет/ Умет* (S) Smjl/ Ушл
Тогда
Ls=
°шл/ ушл
откуда
Su.,1 1 vm„
т] =— = —— ---------------- .----------------------- (9.79)
і S>„„ Ц V„„ 4
Как видно из этого положения, полнота извлечения зависит не только от Т, но и относительных количеств шлака и металла.
Обозначим относительную массу шлака
?шл = _£їїі=_. (9.80)
Уиет 0»ет
Тогда коэффициент извлечения серы можно представить в следующем виде:
При сварочных процессах ушл выше, чем в сталелитейных процессах, н составляет от 0,25 до 0,4.
Удаление фосфора из металла сварочной ванны возможно при наличии шлаков окислительного типа. Полагая, что фосфор находится в металле в виде фосфидов (Fe3P; Fe2P), можно предположить следующую схему реакций:
2 [Ре3Р] + 5 [FeO] ^Р205 + 11 Fe.
Кислотный оксид фосфора будет поглощаться СаО шлака: Р205 + СаОч=ь Са (Р03)2; Р205 + ЗСаО ^ Саа(Р04) 2.
метафосфат ортофосфат
Таким образом, окислительные шлаки (FeO) и шлаки основного типа (СаО) позволяют снижать содержание фосфора в металле шва, увеличивая его устойчивость к горячим и холодным трещинам.
Применение основных электродных покрытий и сварочных флюсов позволяет понизить содержание фосфора в металле шва. Особенно это заметно при электрошлаковом переплаве сталей.