Взаимодействие металлов с газами при сварке
В зоне сварки металлы, жидкие или нагретые до температуры, близкой к температуре плавления, встречаются не только с кислородом, но и со сложными газами, такими, как СО; СОг; Н20; С„Нт, получающимися в результате диссоциации карбонатов или газов:
2СОа ^ 2СО 4- 02; 2Н20 ^ 2На + 02; СаС03 ^ СаО + СОа; Me + Н20 «=*: МеО + Н2; МеО + СН4 =*± Me 4- СО 4- 2Н2 и т. д.
В результате взаимодействия металлы могут подвергаться окислению или, наоборот, восстановлению в зависимости от температуры и соотношений концентраций компонентов газовой атмосферы.
СИСТЕМА С — О
Углерод, соединяясь с кислородом, образует С02 или СО:
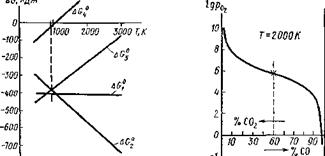
Сггаф4- 02 ^ С02; AG? = — 393 500 - 2,83 Г,
2Сграф4- 02 ^ 2СО; AG2 = — 221 ООО — 178,29 Т.
Используя значения энергий Гиббса для первой и второй реакций, определим температуру, при которой оба процесса будут в равновесии:
AG? — AG2 — Г = 983,13 К. (9.34)
При температурах выше 983,13 К окисление углерода будет происходить до СО. Диоксид С02 будет более устойчив при низкой температуре. Графики значений энергий Гиббса для возможных реакций в системе С — О приведены на рис. 9.18.
Реакция окисления оксида углерода СО в диоксид С02
2СО + 02 ^ С02; КРз = Рсо2/(Рсо Po) = f(T);
AG°3 = - 566 ООО 4- 172,63 Т (9.35)
носит название реакции «догорания» и имеет большое значение в металлургии. Определим из выражения константы равновесия Крз давление кислорода в равновесной газовой смеси и получим следующее уравнение:
Ро2 = (1 /Крз)р2со2/р2со = КП (9.36)
Если температуры не слишком высоки (~ 2000 К), то парциальное давление кислорода будет мало и вместо парциальных давлений рсо2 и рсо может принять их объемные доли в газовой смеси.
|
|
|
йЄ"«Дм |
|
-1 |
|
Рис. 9.18. Диаграмма изменения стандартной энергии Гиббса в системе углерод— кислород в зависимости от температуры |
|
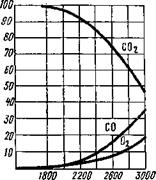
Рис. 9.19. Зависимость логарифма давления кислорода от состава газовой атмосферы (Т — const) |
|
Тогда |
Ро2= (№)(% С02/% СО)2 = f(T). (9.37)
Таким образом, давление кислорода будет функцией двух переменных: температуры и состава газовой смеси. Логарифмируем уравнение (9.37) и получаем:
|
(9.38) |
lgPo2= - № + 21ga,
где а = % С02/% СО характеризует окислительную способность газовой атмосферы.
Если % С02 -— 100, а % СО -— 0, то а — оо и gp02 — оо, т. е. атмосфера будет окислительной, а если % С02 —► 0 и % СО — 100, то а —» 0 и lgPo? — оо — восстановительной.
График уравнения (9.38) для температуры 2000 К приведен на рис 9.19. Характер кривой показывает, что соответствующим изменением концентраций СО и С02 можно в широких пределах изменять окислительную способность атмосферы в условиях постоянной температуры. К сожалению, при сварке в струе углекислого газа С02 нет возможности регулировать состав газовой атмосферы. Состав газовой атмосферы в зависимости от температуры показан на рис. 9.20.
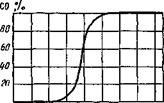
Еще одно равновесие в системе С — О — равновесие Белла и Будуара:
2СО Сграф-f - C02; Kpi — Pcojplo — /(T)-
с>та реакция, с одной стороны, приводит к выделению твердого углерода из газовой фазы, а с другой — обусловливает образование карбидов металлов при контакте с газовой атмосферой, содержащей оксид углерода СО:
|
T, R Рис. 9.20. Диссоциация углекислого газа в зависимости от температуры |
|
т боо воо юоо то пт то т, к Рис. 9.21. Равновесные концентрации СО в зависимости от температуры для реакции Белла — Будуара (р = const) |
Равновесие Белла — Будуара удобно представить в координатах % СО — Т для условия постоянного давления (обычно равного 1,013-105 ПА). На рис. 9.21 приведена диаграмма равновесных концентраций СО в зависимости от температуры. При высоких температурах (~ 980 К) углерод интенсивно газифицируется и повышает концентрацию СО в газовой фазе.
СИСТЕМА Н — О
Водород, соединяясь с кислородом, образует два соединения: воду Н20 и перекись (пероксид) водорода Н202 — соединение мало устойчивое и поэтому в сварочных процессах не встречающееся.
Пары воды при высоких температурах диссоциируют по двум направлениям: 2Н20 *=* 2Н2 + 02 и 2Н20 ^ 20Н* - f - Н2.
Радикал ОН* — очень активный окислитель, такой же, как и чистый кислород.
Константы равновесия и уравнения энергии Гиббса для этих процессов очень близки и можно ограничиться рассмотрением в системе Н — О одного процесса:
2Н2 + 02 « 2Н20; КР5 = РІ2о/(ркРо) ■
Определим из уравнения константы равновесия парциальное давление кислорода:
Ръ = Шръ)Рн*>/Рнг (9-39)
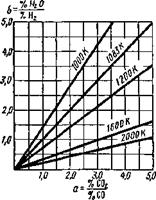
При температурах 3000...4000 К можно это уравнение представить иначе:
Отношение %Н20/%Н2=6 будет указывать на окислительную способность газовой атмосферы, аналогично а= %С02/%С0, как это имело место в системе С — О.
|
Рис. 9.22. Лучевая диаграмма (Р. Шенк) для расчета равновесий в системе СО, Н2, С02 и Н20 |
СИСТЕМА С - Н - О
Совместное присутствие СОг, СО, Н20 и Н2 создает общую систему, равновесие в которой не может быть произвольным.
Равновесие устанавливается в результате общего развития двух реакций:
2СО + 02 «с 2СОа;
2Н2 + 02 2НаО.
Вычитая второе уравнение из первого и сокращая коэффициенты, получим следующее уравнение реакции (равновесие Ганна):
СО + Н20 ^ С02 + Н2.
Константа равновесия будет записана так:
ь - (% СОг) (% Н2) ____________ ит /п л і
к-і%щжт~кп (9>41)
Если ввести коэффициенты, характеризующие окислительную способность атмосферы а и Ь, то получим
K = a/b = f(T).
Такая форма записи константы равновесия позволяет построить лучевую диаграмму из прямых, соответствующих определенным температурам (рис. 9.22). Как видно из этой диаграммы, каждому значению а для определенной температуры будет соответствовать определенное значение Ь.
В системе С — Н — О возможно развитие реакций с твердым углеродом не только оксида углерода С02, но и паров воды:
Ств + Н2О^СО + Н2;
Ств + С02 ^ 2СО.
Обе реакции ведут к потере углерода при сварке сталей, если в атмосфере дуги присутствуют С02 или Н20.
СИСТЕМА Fe— О—С
Взаимодействие металлов, в том числе и железа, с атмосферой, содержащей СО и С02, определяется ее окислительной способностью:
а=% СОг/% СО — /(7"). (9.42)
Уравнение обратимого равновесия для реакции СО с оксидом металла:
FeO + СО «=► Fe + С02; Крз = Рсо2/Рсо = а. (9.43)
Для различных металлов окислительная способность а будет различна в зависимости от термодинамической устойчивости их оксидов. В табл. 9.1 приведены данные для некоторых металлов при Т — 1000 К, рассчитанные по приближенным уравнениям.
В присутствии твердого углерода восстановление оксидов металлов идет иначе:
FeO + СО ^ Fe + С02
У — «косвенное» восстановление; Сгр-фС02^2С0 >
FeO + Crp Fe + СО — «прямое» восстановление.
Прямое восстановление широко применяется в «большой» металлургии — доменный процесс, но при сварке сталей, в которых роль углерода играют карбиды железа, этот процесс приводит к потере углерода:
Fe3C + СО2 ^ 3Fe + 2COf
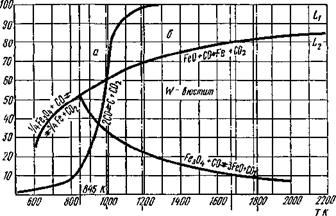
Система Fe — О была рассмотрена ранее (см. п. 9.3) и в ней участвуют оксиды FeO, Fe203 и их соединение Fe304. Все они обладают различной устойчивостью в зависимости от температуры и образуют между собой растворы: FeO в жидком железе (Li), жидкий раствор FeO и Fe304 (Ьг) и твердый раствор FeO в Fe304 — вюстит, а также твердые растворы FeO в б-, у- и а - железе. В системе Fe — О существует также нонвариантная точ-
|
Таблица 9.1. Значения концентраций СО и С02 и константы для некоторых металлов и их оксидов
|
ка при Т = 845 К, в которой при давлении lgft)2 == — 20,48 сосуществуют а = Fe; FeO; Fe304 и Ог (см. рис. 9.8).
Восстановление такой сложной системы оксидов атмосферой, содержащей СО и СОг, разбивается на ряд отдельных, но в то же время взаимосвязанных процессов (уравнения температурной зависимости констант равновесия даны по В. А. Кистяковскому):
1. 3Fe203 + СО =,=* 2Fe304 + С02 — эта реакция практически необратимая, так как идет только при малых концентрациях СО или при низких температурах;
2. Fe304 -}- СО ЗРеО + С02; АЯ0 — -ф - 43,66 кДж/моль СОг!
gKP2 = - 1645/Т + 1,935; (9.44)
3. FeO - f СО ^ Fe + С02; ДЯ° = - 19,33 кДж/моль С02;
lg/Cp3 = 949/Г - 1,14; (9.45)
4. l/4Fe304 + СО 4=t 3/4Fe + С02; ДЯ° — — 3,59 кДж/моль С02;
lgKp4 = - 1,004/Г + 1,208. (9.46)
Константы равновесия последних трех реакций (2—4) при Т = 845 К будут равны между собой, так как термодинамическая устойчивость оксидов железа будет тоже одинаковой. Графически равновесие реакций восстановления оксидов железа представлено на рис. 9.23 в координатах СО — Т и на систему кривых наложена кривая равновесия Белла — Будуара (см. рис. 9.21), делящая поле диаграммы на области прямого b и косвенного а восстановления. Область прямого восстановления для сварочных процессов нежелательна (потеря углерода сталью при сварке).
|
СО, %
г’ис. 9.23. Диаграмма равновесия реакций восстановления оксидов железа оксидом углерода СО в зависимости от температуры в присутствии твердого углерода |
|
Рис. 9.24. Схема восстановления оксида железа в растворе в атмосфере из СО н С02 |
|
СО, /
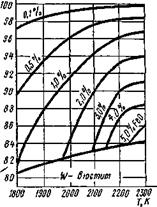
Рис. 9.25. Равновесные содержания FeO в растворе жидкого железа в зависимости от температуры и концентрации (массовые доли) |
Высокие концентрации СО при соответствующих температурах обеспечивают восстановление FeO в растворе железа (Lі), что по существу представляет собой процесс, характерный для сварочной ванны:
[FeO] - f СО ^ Fe - f С02.
Двухфазная система (рис. 9.24), состоящая из трех компонентов, имеет три степени свободы:
[FeO] = f(T; р; СО/СОД (9.47)
(фактически р не влияет, так как реакция идет без изменения числа газовых молей).
Выражение константы равновесия для данного процесса можно записать так:
_-ЧреРс0?._^3,
|
(9.48) : 1% FeO]/ и СО при |
Ко
“FeOPcO
где aFe « 1 по предыдущему; aFe0 = NFe0/NTe0 нас я /]%FeO]„ac; Рсо2 и Рсо — парциальные давления С02 наличии раствора FeO в Fe.
Отсюда
|
(9.49) |
К ■>. — [%Ре°]насРсО, _ f/-r
Р 1% FeOMo 1{1)-
Если [% FeO] -*■ [% FеО]нас, ТО Рс. Ог/Рс.0 -»■ КрЗ, но если [% FeO] 0, то p'cojp'co тоже стремится к нулю, а это возможно, если концентрация СО стремится к 100%. Таким образом, чистое от кислорода железо можно получить только в атмосфере чистого СО. Фактически это сделать невозможно, и, кроме того, многие металлы, в том числе и железо, образуют летучие комплексные соединения с СО — карбонилы [Fe(CO)5; Ni(CO)4; Cr(CO)6 и т. д.], разлагая которые получают высокочистые металлы — карбонильное железо, карбонильный никель и т. д.
На рис. 9.25 область L приведена в укрупненном масштабе и иа ней показаны линии одинаковой концентрации FeO в зависимости от температуры и концентрации СО в газовой фазе. При концентрации FeO, стремящейся к нулю, концентрация СО стремится к 100%. К сожалению, в сварочных процессах концентрация СО всегда ниже и только при сварке ацетилено-кислородным пламенем можно, регулируя состав газовой смеси (Р«1), создать высокую концентрацию СО в пламени горелки.
карбидообразование
Высокие концентрации СО в газовой атмосфере вызывают процессы карбидообразования, насыщая металл углеродом.
Образование карбидов железа и других металлов может происходить:
при непосредственном взаимодействии между металлами и твердым углеродом: Me + С МеС;
при взаимодействии металлов с атмосферой, содержащей СО и С02:
Ме + 2С0=^МеС + С02;
при взаимодействии металлов с атмосферой, содержащей углеводороды и другие углеродсодержащие газы:
СпНт + Me =Р6 МеС + С„- |Н„.
Последний процесс идет с активными металлами (Zr; Ті), которые даже в вакууме, созданном масляными диффузионными насосами, обогащаются углеродом (ZrC; TiC). Карбиды образуют почти все металлы, но они обладают различными свойствами в зависимости от расположения данного металла в периодической системе Д. И. Менделеева или от строения его атомов.
Семейство s-металлов (ІА и НА групп) образует неустойчивые карбиды, разлагающиеся водой или разбавленными кислотами с выделением углеводородов:
Na4C+4H20—4NaOH + CH«t; СаС2 + 2Н20^Са(0Н)2 + С2Н2Ї.
Семейство p-элементов, заполняющих электронами внешний подуровень р, образует промышленно важные карбиды, свойства которых приведены в табл. 9.2.
|
Таблица 9.2. Свойства карбидов некоторых р-элементов
|
Карбиды бора и кремния обладают высокой твердостью, приближающейся к твердости алмаза. Их используют как абразивы и для изготовления режущих инструментов. Карбид кремния — полупроводник и используется для нагревательных элементов металлургических печей. Карбиды этих элементов очень устойчивы, кроме карбида AI4C3, разлагающегося разбавленными кислотами.
Семейство d-металлов или переходных металлов, заполняющих электронами подуровень d, образует многочисленные карбиды, имеющие важное промышленное значение. Особенно устойчивы карбиды d-металлов, не имеющих парных электронов в подуровне d. Они обладают высокой твердостью (TiC; ZrC; NbC, Сг2зСб; МоС; WC), близкой к твердости алмаза, электропроводностью — электронной или полупроводниковой. Растворяясь в жидких металлах, они образуют сложные диаграммы плавкости и могут становиться упрочняющими фазами в зависимости от их термообработки. Термодинамическая устойчивость карбидов различна; АЯ°их образования и другие их свойства приведены в табл. 9.3.
Карбид железа Fe3C термодинамически неустойчив (АЯ0>0), но, образуя растворы в жидком и твердом железе (наибольшая
растворимость в y-Fe — аустенит), он повышает свою устой
чивость.
Рассмотрим процессы образования карбида железа при его растворении в жидком железе:
|
3Fe + 2СО [Fe3C] + С02; rs _____ ДрезС РСО'г ________ НТ ” ~ <J3Fe(p6o)2"” Л }' (9.50) Таблица 9.3. Свойства некоторых карбидов ^-металлов
|
где aFe« 1; flFe3c~ [% FesC], так как в жидком железе он растворим неограниченно.
Малая устойчивость карбида железа позволяет заменить константу равновесия (9.50) на КР4, т. е. на константу равновесия Белла — Будуара.
Если подставить значения активностей в формулу (9 50) и заменить парциальные давления газов на их объемные содержания, то получим
[%Fe3C] (%С02) /псм
(%со?--------------- •--------------------------- (9-5,)
Если [%ЕезС] — 0, то (%СО2)-*-100 и чистое от карбида
железо начнет поглощать углерод даже в почти чистом углекислом газе. Это обстоятельство следует учитывать при сварке низкоуглеродистых (0,02% С) жаропрочных сталей, которые будут в процессе сварки обогащаться углеродом. Процесс восстановления оксида железа в растворе и процесс карбидообразования протекают совместно, т. е. в одних и тех же условиях, при тех же
значениях Т (% СО), а следовательно, их можно выразить
одним уравнением:
_ [FeO] +C0^Fe + C02 3Fe + 2СО ^ [Fe3C] + С02
[FeO] + [Fe3C]^4Fe + CO
Обобщенная константа равновесия
Кр— а^-рсо-= f(T). (9.52)
OFeO Фе, С
Исследования, проведенные Чипманом, показали, что равновесие этой реакции практически не зависит от давления СО, и поэтому можно записать приближенно:
aFeOaFe3C — f(F), ИЛИ [%0] [%С] = f(T).
Таким образом, чем больше окислена сталь, тем ниже будет в ней содержание углерода, и наоборот.
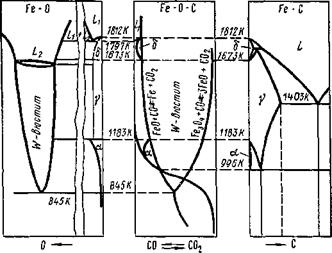
Сложное взаимодействие между элементами в системе Fe—О —С отображается диаграммой в координатах СО—Т (рис. 9.26), на которую в отличие от рис. 9.23 нанесены кривые карбидообразования и показаны области совместного существования жидкого раствора углерода и кислорода Lx (сварочная ванна), а также области твердых растворов карбидов железа в б-, у - и a-железе. Можно представить совместно три отдельные диаграммы: системы Fe —О, системы Fe—О —С и системы Fe —С, которая, как известно, служит основой для изучения фазовых состояний железоуглеродистых сплавов в процессах термической обработки и при анализе результатов воздействия сварочного цикла на стали. Такая совместная диаграмма приведена на рис. 9.27.
|
п |
|||||||||||||||||
|
"1 |
|||||||||||||||||
|
АУі |
теп |
um |
|||||||||||||||
|
(Кг/7 |
щ |
0 |
Fe |
И г |
l2 |
||||||||||||
|
W-b |
ЮСІЇ |
um |
|||||||||||||||
|
*3 А* |
|||||||||||||||||
|
г* |
|||||||||||||||||
|
tSig |
a |
||||||||||||||||
|
80 |
5К |
|
ООО Рис. 9.26 Диаграмма состояния системы Fe — О — С |
|
Рис. 9 27. Совмещение диаграмм Fe—О; Fe—О—С; Fe—С |
|
wo so 80 10 60 50 00 30 20 10 |
Точный термодинамический расчет этих диаграмм затруднен отсутствием достоверных данных об активностях компонентов в растворах, но даже приближенные решения очень информативны при анализе технологических процессов.
При сварке легированных сталей диаграмма Fe —О — С существенно усложнится из-за образования более устойчивых, чем РезС, карбидов (легирующие элементы Сг, Мп, ванадий, ниобий, титан), а также из-за смещения границ растворимости карбидов в твердых растворах y-Fe (никель).
СИСТЕМА Fe — О — Н
Водорода, как правило, по возможности избегают в металлургических процессах при сварке металлов, так как, растворяясь в металлах при температурах сварки, он может привести к возникновению дефектов сварного соединения (поры, трещины) в процессе кристаллизации. Кроме того, растворяясь в твердом металле, водород резко снижает его пластичность (водородная хрупкость). Однако в некоторых процессах сварки (атомно-водородная, сварка в перегретом паре и газопламенная сварка) используется восстановительная способность водорода.
Водород восстанавливает оксиды металлов, особенно при высоких температурах, а его высокая диффузионная подвижность значительно ускоряет процессы восстановления, приближая их к равновесию.
В системе Fe — О — Н возможны четыре реакции в соответствии с системой Fe — О. Уравнения констант равновесия этих процессов (по В. А. Кистяковскому) приведены ниже:
ЗРегОз + Нг^ 2FC304 + Н2О; АН' = — 13,3 кДж, т. е. реакция практически необратимая;
Fe304 |H2ii3FeO -f H2Of AH°=+ 84,83 кДж;
gKp2 = - 3378/Т + 3,648; (9.54)
FeO + H2 s=t Fe - f H2Of ДЯ° = +21,84 кДж;
lgKP3 = - 784/Г + 0,573; (9.55)
y4Fe304 - f H2^3/4Fe + H2Of; ДЯ°= + 37,58 кДж;
lg/CP4=— 1482/Г + 1,411. (9.56)
|
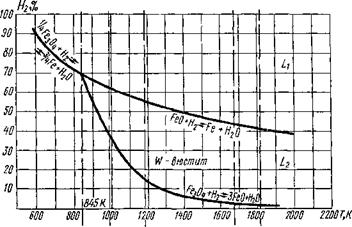
Рис. 9 28. Диаграмма восстановления оксидов железа водородом в зависимости от температуры |
Реакции (9.54)... (9.56) — эндотермические, и в области высоких температур равновесие смещается в сторону восстановления железа при более низких концентрациях Нг.
На рис. 9.28 представлены кривые зависимости концентраций Нг при восстановлении оксидов железа от температуры. Для всех кривых характерны отрицательные производные, т. е. снижение равновесных концентраций при повышении температуры (см. рисунок). Точка пересечения трех кривых совпадает с нонвариант - ной точкой в системе Fe — О при Т = 845 К.
Одновременное присутствие в газовой атмосфере Нг, НгО, СО, С02 снижает концентрацию водорода в зоне контакта с металлом, что особенно важно при газопламенной сварке металла и при сварке в струе углекислого газа, так как даже относительно высокая влажность углекислого газа менее опасна, чем ничтожное содержание водяного пара в аргоне.
Азот и водород в металлах при сварке плавлением
Нитриды — соединения металлов и других элементов непосредственно с азотом. Азот, составляющий основную часть воздуха, всегда в какой-то степени участвует в процессах сварки металлов плавлением, и так как его присутствие легко определяется методами аналитической химии и спектрального анализа, то по содержанию азота в наплавленном металле судим о степени защиты зоны сварки от окружающей воздушной атмосферы. При высоких температурах азот реагирует со многими элементами. Так, s-металлы дают нитриды, которые можно рассматривать как производные аммиака: NaaN; Mg3N2 и т. д., р-эле - менты образуют промышленно важные нитриды. Например, боразон, или эльбор, BN (АН°== —252,6 кДж/моль; s° = = 14,8 Дж/(моль< К), плотность 2,34 г/см3; Тш= 3273 К) представляет собой очень твердый материал, почти не уступающий по твердости алмазу; нитрид кремния Si3N4 [ДЯ = = — 750 кДж/моль; s° = 95,4 Дж/(моль-К), Тпл = 2273 К (возгонка)] — полупроводник (Д£ = 3,9В); нитрид алюминия A1N разлагается водой.
&Н,°кД>н
SHAPE * MERGEFORMAT

|
|
|
-334 |
|
|
гг 23 гч 25
Рис. 9.29. Устойчивость нитридов d-металлов
|
s |
««• |
||||||||
|
-fe |
|||||||||
|
X-Ft |
|
ШГ0'*м3/кг |
|
SO 40 зо го 10 |
|
9оо то |
|
то |
|
Cu„ |
: / |
|||||||
|
ft/fTl |
1_ |
I |
|
№l/s'Vfe зо |
|
1812k |
|
1100 Т, П б] |
|
20 |
|
10 |
|
All, |
||||||||
|
Ain |
8 |
|
ЩЮ'У/кг |
|
1256К |
|
0J 06 0,5 0,4 0,3 0,2 0,1 |
|
Семейство d-металлов образует с азотом многочисленные соединения; d-металлы, не имеющие на подуровне d парных температурой плавления и большой твердостью. Такие ме- таллы, как железо, кобальт, никель, образуют малоустойчивые Образование нитридов железа при сварке низкоуглеродистых конструкционных сталей приводит к выпадению кристаллов Fe3N (температура плавления Qj при распаде твердых растворов. В результате наплавленный ме- Взаимодействие металлов с Процесс растворения водоро- 1. Диссоциация молекул во- ,,п разрядки ионов водорода на като- в) де электролизера, а это тоже про- цесс с затратой энергии. 2. Сорбция атомов водорода и 3. Образование гидридов с не- Для металлов, не образующих 600 800 1000 Т, К энергии. 933к Растворимость водорода в ме- Рис. 9 30. Изобары растворимо - таллах этого типа подчиняется сти водорода в металлах закону распределения |
[Н] = k'p н,
а давление атомарного водорода можно найти из следующих формул:
tW2HКР=-^-=т-> Рн = VК„рН2
РНг
Собираем все постоянные при данной температуре коэффициенты:
[Н] = krP ft?- (9.57)
Выражение (9.57) носит название закона Сивертса. Зависимость от температуры определяется через константу растворимости
kT = k0e~AH/iRT (9.58)
где АЯ — разность энтальпий растворения.
Находим частную производную от kj по температуре при условии рн2= const:
|
|
В виду того что для металлов, не образующих гидриды, ДЯ>0, dnkr/dT>0 и растворимость водорода в металлах увеличивается с повышением температуры и особенно резко меняется при фазовых превращениях.
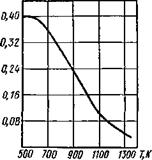
На рис. 9.30, а, б, в приведены изобары растворимости водорода соответственно в железе, меди и алюминии.
Как видно из приведенных изобар, наибольшее изменение растворимости происходит в процессе кристаллизации металла, и, следовательно, водород, который был растворен в жидком металле, должен выделиться и уйти из сварочной ванны. При неблагоприятных режимах сварки и теплофизических свойствах металла этот выделяющийся водород может образовать поры и несплошности в металле. Вероятность образования пор будет тем больше, чем больше различие растворимости в жидком и твердом состояниях.
Так, изменение растворимости водорода в металлах при температуре плавления или кристаллизации, отнесенное к растворимости водорода в твердом состоянии, может характеризовать склонность металла к порообразованию:
В табл. 9.4 приведены данные о растворимости водорода и значения коэффициента у.
|
Таблица 9.4. Изменение растворимости водорода в металлах при кристаллизации
|
Таким образом, наиболее склонен к порообразованию алюминий и его сплавы. В сварочной технологии на возникновение пор влияет время пребывания сварочной ванны в жидком состоянии, что зависит от скорости сварки. При малой скорости сварки алюминия водород успевает покинуть ванну и наплавленный металл будет плотным, при больших скоростях сварки (цСе>50м/ч) водород не успевает выделиться из кристаллизующегося металла и образовать поры, а при скорости сварки ~20 м/ч обычно возникают поры. При сварке алюминия и его сплавов типа АМгб требуются особые меры для очистки кромок свариваемых изделий и тщательная подготовка электродной проволоки, а также использование аргона, имеющего минимальную влажность (Г. Д. Никифоров).
Возникновение пор и их развитие — сложный процесс зарождения газовой фазы в жидкой среде. В сплошной жидкости образование зародыша газовой фазы, способного к дальнейшему развитию, т. е. больше критических размеров, — процесс маловероятный. Чаще всего эти зародыши возникают на границе раздела с малым радиусом кривизны — включения или же зародыши попадают в металл сварочной ванны извне и начинают расти, поглощая выделяющийся водород.
|
[Нг],м3/кг
|
В гидридообразующих металлах процесс сорбции водорода включает в себя все три стадии; при образовании гидридов ЛЯраств СТЭНОВИТСЯ МеНЬШе нуля и растворимость водорода понижается с повышением температуры, но это будет проявляться тогда, когда температура будет выше температуры термодинамической устойчивости гидридов. На рис. 9.31 приведена изобара растворимости водорода в титане в зависимости от температуры, причем снижение растворимости начинается при температурах выше 600 К. Если рассматривать кривую десорбции водо - Рис. 9.31. Изобара раствори - Р°Да из гидридообразующего металла, мости водорода в титане го она будет проходить через макси
мум, так как при низких температурах водород удерживается в гидридах, а при высоких количество водорода будет уже относительно малым. Наиболее характерные гидридообразующие металлы — титан, цирконий, ванадий, ниобий, тантал и др., так как их гидриды обладают высокими температурами плавления, твердостью и металлической электрической проводи - мост ью.
Некоторые данные о растворимости водорода в гидридообразующих металлах при ряг — 1,013 • 105 Па приведены в табл. 9.5.
Из данных табл. 9.5 видно, какие объемы водорода поглощают гидридообразующие металлы; возможность их сварки, с одной стороны, определяется чистотой исходного металла, а с другой - тщательностью разработки технологии сварки, исключающей присутствие водорода в зоне сварки.
Титан, а также цирконий и ниобий, содержащие водород, утрачивают свои пластические свойства, а сварка их становится невозможной. Поэтому массовая доля водорода в титане, предназначенном для ответственных конструкций, ограничивается 0,002...0,004%, и, кроме того, не допускается присутствие водорода в зоне сварки (сварка электронным лучом или в камерах С контролируемой атмосферой). При аргоно-дуговой сварке тщательно организуется защита металла сварочной ванны, остывающего до 773 К металла шва, и защищаются нижние кромки сварного соединения.
Растворенный водород также оказывается нежелательным, так как он резко уменьшает пластичность металлов (стали, медные и алюминиевые сплавы), вызывает пористость в сварных швах и в зоне термического влияния. Так называемая «водородная хрупкость металлов» в настоящее время стала важной технической и научной проблемой, так как применение упрочненных сталей, обладающих малым запасом пластичности б, вызывает замедленное разрушение сварных конструкций.
Водород в твердом металле может быть в различных состояниях:
а) диффузионно-подвижный водород, находящийся в состоянии твердого раствора внедрения. Он относительно свободен и может покидать металл, диффундируя к границе раздела и десорбируясь из него при «вылеживании», но в легированных сталях этот процесс идет медленно и требует повышенных температур или вакуума. Не десорбируется водород из аустенитных сталей, не обладающих ферромагнитными свойствами. Диффузионноподвижный водород может участвовать в изотермической диффузии, описываемой уравнениями законов Фика (см. п. 8.5), диффузии, вызванной градиентами температур, градиентами механических («восходящая» диффузия Конобеевского) или электрических напряжений («электроперенос»);
б) остаточный водород — водород, адсорбированный на границах раздела или в зоне скопления дислокаций, уменьшает их подвижность. Диффузионно-подвижный и остаточный водород МО-
|
Металл |
[Н] • 10+5. |
||||
|
293 |
423 |
573 |
673 |
773 |
|
|
Титан |
40 300 |
40 000 |
38 400 |
35 400 |
|
|
Цирконий |
24 000 |
24 000 |
23 700 |
23 400 |
23 000 |
|
Ванадий |
15 011 |
8 200 |
6 000 |
3 800 |
1 840 |
|
Ниобий |
10 400 |
— |
8 800 |
7 680 |
4 740 |
|
Тантал |
— |
— |
3 400 |
2 400 |
1 300 |
|
Лаитан |
— |
— |
19 200 |
18 200 |
17 200 |
|
Церий |
— |
— |
18 400 |
17 600 |
16 800 |
гут переходить друг в друга. Остаточный водород покидает металл при ~900 К в вакуумё;
в) связанный водород, удаляющийся из металла при вакуумном плавлении, находится в несплошностях металла (раковины и поры) в молекулярном состоянии. Переход связанного водорода в диффузионно-подвижный сильно затруднен, так как процесс диссоциации молекул Н2 на атомы требует большой затраты энергии.
Общей теории водородной хрупкости, достаточно обоснованной, пока еще не существует, потому что водород (точнее протон) в твердых металлах ни одним из известных экспериментальных методов не обнаруживается.
Водород в сварных соединениях в силу его большой подвижности в условиях сварочного цикла распределяется неравномерно и при средней допустимой концентрации водорода могут создаваться локальные концентрации (линия сплавления для металлов, не образующих гидридов, или зона термического влияния для гидридообразующих металлов), вызывающие возникновение дефектов сварного соединения (поры, трещины) или его замедленное разрушение (титановые сплавы и высокопрочные мар - тенситно-стареющие стали).