Раскисление металла сварочной ванны
Восстановление металла сварного соединения требует удаления кислорода из сварочной ванны, пока она находится в жидком состоянии.
Восстановление или раскисление сварочной ванны можно осуществить несколькими путями:
1. Извлечение его более активными металлами — раскисление осаждением.
2. Восстановление металла газовой атмосферой, контактирующей с металлом сварочной ванны.
3. Извлечение оксидов из металлической ванны путем обработки ее шлаками.
Все эти методы реализуются в сварочной технологии, но для различных металлов они будут применяться с разным успехом. Так, для металлов с высокой термодинамической устойчивостью оксидов (титан и алюминий) эти способы восстановления почти не дают эффекта и для получения качественного сварного соединения из этих металлов необходима по возможности полная изоляция их от окисляющей атмосферы (инертные газы, вакуум).
РАСКИСЛЕНИЕ ОСАЖДЕНИЕМ
Возможность реализации этого метода заключается в том, что металлы очень ограниченно растворяют свои оксиды и свои сульфиды, а оксиды и сульфиды других металлов практически не растворяют. Тогда возможен процесс:
[МеО] + [Э] ^Ме+ ЭО.
Здесь ЭО — эндогенное шлаковое включение.
В качестве раскислителей берут активные элементы: марганец, кремний, алюминий, титан, редкоземельные металлы (РЗМ), у которых большое сродство к кислороду, зависящее от температуры и концентрации.
Рассмотрим схему диссоциации оксида раскислителя:
2Э0^2[Э] + 02f.
|
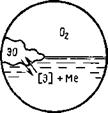
Рис. 9.15. Схема окисления раскислителя в растворе другого ме- |
Схема этого процесса показана на рис. 9.15. Число компонентов в этой системе равно трем (Э; О; Me), число степеней свободы — двум: С — 3 + 2 — 3 = 2, т. е.
P'o2 = f(T;x). (9.21)
В константу равновесия будет входить активность раскислителя в растворе металла: КР — ро2эо = рОгЭО • а,,
или
р&гэо— ро2эо/я|; ЛС? эо= АС? эо + 2/?7Чпаэ.
(9.22)
Активность аэ будет определяться концентрацией растворенного элемента N3, если он не будет давать насыщенных растворов при температуре процесса (диаграмма плавкости Me — Э).
Ввиду того что концентрации раскислителей Э обычно малы, то можно принять аэ « где Nэ— мольная доля. Тогда
AG30= AG?,o4- 2/?ПпМэ. (9.23)
Если Nэ — 1, т. е. раскислитель будет свободным, то AGs-— AGa
Если Nэ 0, т. е. концентрация раскислителя стремится к нулю,
то AGso— — °о — будет окисляться вообще не раскислитель, а металл, в котором он растворен.
Так, при сварке хромоникелевой стали 12Х18Н10Т, содержащей 0,2—0,3% Ті, в металле шва можно сохранить до 0,10% титана, несмотря на его огромное сродство к кислороду. Найдем условия равновесия процесса (AG|0 и AG%,o известны):
[МеО] + [Э] ^ Me + ЭО;
A G = ДОмео — AGso— 0.
Подставляем их значения:
ДОмео = AGjvieo 2#Лпаме — 2^?7'1памео; (9.24)
ДОэо== AG%0 + 2/?Ппаэ, (9.25)
и получаем:
AG = AGMeo 4" 27?Лпаме — 2/?7’1памео — АС? эо — 2RTna, s — 0.
При малой концентрации растворов аме стремится к единице, обращая в нуль выражение 2^ЛпаМе. Преобразуем полученную формулу так:
In (МмеоМэ) = (A GSm - A Gao) /(2 RT). (9.26)
Произведение мольных долей можно принять за константу раскисления, так как оно зависит только от температуры:
Кэ= МмеоМэ= е(До&ео-Ас§о)/(2лг) (9.27)
Если AG%o — оо, то AGVo— ДОэо —«- — оо; /Сэ — 0, т. е. металл будет освобожден от кислорода полностью. Если AG„e0 = AG|o, то никакого раскисления не будет. В металлургии чаще выражают концентрации в массовых, а не в мольных долях. Формулу для определения константы раскисления можно записать в следующем виде:
Кэ= [% О] [% Э] — f(T). (9.28)
При пересчете мольных долей в массовые изменяются только
значения числовых множителей в уравнении константы равнове
сия /Сэ-
В общем случае в выражение константы раскисления войдут коэффициенты уравнения реакции как показатели степени при соответствующих концентрациях.
г
I Раскисление сталей при сварке ведут путем легирования сварочной ванны элементами с большим сродством к кислороду: марганцем, кремнием, титаном, алюминием. Эти элементы вводят или из электродной проволоки, или из покрытия электродов, или из сварочных флюсов в результате обменных реакций/]
Раскисление сталей хорошо изучено и для них существуют уравнения констант равновесия, полученные экспериментально
А. М. Самариным:
[FeO] + [Mn] ^ Fe + МпО;
1п/(мп = lg[% О] [% MnJ = - 25 270/7 + 12,55; (9.29)
2 [FeO] + [SiJ ^2Fe + Si02;
IgKs, =lg[%0]2[% Si] =- 48 174/74- 21,63; (9.30)
2 [FeO] + [Ті] 2Fe + Ti02;
lg/Ст. == lg [% O]2[% Ті] =- 30 700/7+ 10,33; (9.31)
3 [FeO] + 2 [Al] ** 3Fe + Ah03; lg/Сді = lg [% O]3[% Al]2 = — 58 715/7 + 16,5. (9.32)
Решения приведенных выше уравнений для постоянной температуры дают гиперболические зависимости между равновесными или остаточными массовыми концентрациями кислорода и раскислителя в металле — для уравнения (9.29) простая, а для уравнений (9.30)... (9.32) —степенные гиперболы.
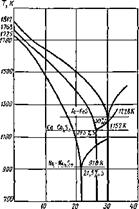
Графики этих зависимостей приведены на рис. 9.16. Малая активность марганца как раскислителя создает большие остаточные концентрации марганца в металле, но они не влияют на механические свойства стали (до 1 %). При высоких температурах и достаточно малых концентрациях Мп остаточная концентрация кислорода превышает предел концентрации насыщенного раствора L (см. с. 329 ), которая показана на рис. 9.16 штриховой линией. Несмотря на малую раскислительную активность, марганец широко применяется в сварочной металлургии, так как кроме кислорода он извлекает из жидкого металла серу, переводя ее в MnS, плавящийся при 1883 К, поэтому при кристаллизации металла шва влияние легкоплавкой сульфидной эвтектики понижается и повышается сопротивление металла образованию горячих трещин. Обобщенная диаграмма плавкости Me — S для железа, кобальта и никеля приведена на рис. 9.17, указаны температуры плавления сульфидных эвтектик, лежащих ниже температур кристаллизации стали, никеля и кобальта.
|
[FeO] + [Fe3C] ^ 4Fe + COf *с=[%0] [%C]=/(7). |
Углерод, всегда присутствующий в стали, также можно рассматривать как раскислитель:
|
Го], 0,500 О, КО в, ко 0,350 0,300 0,250 0200 от 0,100 ощ |
|
% |
|
М,% |
|
0,500 |
а)
|
л /,1 |
г~ t |
|||
|
1 4<v / |
||||
|
' |
||||
|
1 |
А Г |
|||
|
1 1 |
/ / |
V |
||
|
V |
||||
|
<< |
||||
0,2 0,0 0,6 0,8 1,0 fMn]%
|
к |
,1800К |
||||
|
1 |
4- |
||||
|
V |
Що к |
|
0,010,050,1 0,15 0,2 0,25 0,3 [Si], 7» |
|
[0],% 0,000500 0,000050 0,000000 0,000350 0,000300 0,000250 0,000200 0,000150 0,000100 0,000050 |
|
[о], г 0,0000 |
6)
|
18008, |
|||||
|
1 |
|||||
|
LJOOOH ^500/f |
|
0,0350 ото |
|
0,0050 |
|
0,05 0,10 0,15 0,20 0,25 0,30 [Ті], % |
|
і |
|||||
|
І |
|||||
|
| |
4й |
||||
|
IV |
л |
||||
|
V |
’04- |
||||
|
N |
4-І I— |
|
0,05 0,10 0,15 0,20 0,25 0,30 [At ],% |
Рис. 9 16 Изотермы раскисления железа марганцем (а), кремнием (б), титаном (в) и алюминием (г)
Реакция между углеродом и оксидом железа эндотермичная и поэтому углерод будет выступать как раскислитель только при высоких температурах — в каплях электродного металла или в сварочной ванне в основании дугового разряда, что приводит к выгоранию углерода при сварке сталей плавлением.
Кремний — более активный раскислитель стали и для него характерны малые остаточные концентрации кислорода в металле. При высоких температурах активность Si как раскислителя уменьшается и он сам может восстанавливаться марганцем и даже железом.
|
Рис. 9.17. Обобщенная диаграмма плавкости Me—S (массовые доли) |
Раскисление чистой меди (МО; Ml) при сварке, несмотря на ее малую химическую активность, осложняется ее физическими свойствами:
1. Высокая температуропроводность меди резко сокращает время пребывания сварочной ванны в жидком состоянии и равновесие реакций раскисления не достигается.
2. Высокая электропроводность меди резко снижается от присутствия легирующих компонентов и поэтому остаточные концентрации элемента раскислителя должны быть минимальными.
Для раскисления меди приходится применять раскислители высокой химической активности (А1, Ті, Zr и даже редкоземельные металлы).
При введении раскислителей через специальные электродные проволоки удается получить плотные и прочные сварные швы с удельным сопротивлением на уровне основного металла (~ 1,7 мк ОмХсм). Сварка медных сплавов — латуни и бронзы — не предъявляет таких требований к раскислителям.
При сварке титана и алюминия — металлов очень высокой химической активности — раскисление осаждением невозможно, поэтому их сварку осуществляют с внешней защитой от окружающей среды — в инертных газах, в вакууме или под флюсами, не содержащими кислородных соединений.
Большой недостаток процесса раскисления осаждением — образование эндогенных неметаллических (шлаковых) включений, образующихся по реакции:
[МеО] + [Э] ї±Ме -)- (ЭО),
так как оксиды других элементов обычно не растворяются в основном металле. Эти включения представляют собой концентраторы напряжений и могут снижать как прочностные, так и пластические свойства наплавленного металла, особенно если они будут иметь неправильную форму с малыми радиусами кривизны. Чтобы избежать этого, вводят не один раскислитель, а два или более (например, Мп и Si одновременно), с тем чтобы их оксиды взаимно понижали температуры плавления и включения имели глобулярную форму. Исследования содержания кислорода мето
дом вакуумной экстракции в наплавленном металле показали, что основная масса кислорода заключена в таких шлаковых включениях.