Оценка термодинамической устойчивости соединений
Термодинамическая устойчивость данного соединения определяется изменением энергии Гиббса AG при образовании его в данных физических условиях (р, Т). Разложение этого соединения требует затраты такой же энергии и тем самым определяются возможности данного металлургического процесса.
В области высоких температур соединения металлов с элементарными окислителями (О, S, N, Н) могут разлагаться, выделяя окислитель в газовую фазу, например:
2FеОтц *=± 2Fетв Ч - 02газ f •
Уравнения реакций взаимодействия между металлом и окислителем удобно записывать как реакцию разложения, определяя коэффициенты уравнения таким образом, чтобы в левой части получалась одна газовая молекула, например:
2МпО *=* 2Мп + 02;
7зА1203^7зА1+02;
Si02 5=- Si + 02.
В этом случае стандартное изменение энергии Гиббса AG0 будет для всех реакций выражаться общим уравнением:.
AG° = AH-TAs = - RTnN02, (9.1)
а так как выражения для определения констант равновесия будут идентичны, то их удобно сопоставлять между собой при определении направления взаимодействия соединений между собой в металлургических процессах. Гетерогенная система, в ко
торой существует данное равновесие (рис. 9.1), будет иметь одну степень свободы: С = 2 + 2 — 3=1, т. е.
р02 = МП или Т = /Др02). (9.2)
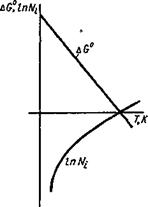
Зависимость AG от температуры в определенных пределах (без фазовых превращений) меняется линейно, а логарифм давления кислорода будет изменяться по кривой, как это показано на рис. 9.2. Точка пересечения с осью температур будет соответствовать условию:
AG° = 0; lgA^O2=0 или Ысь = 1. (9.3)
Физический смысл заключается в том, что при температуре То равновесное давление кислорода над оксидом будет равно внешнему давлению чистого кислорода, т. е. даже в чистом кислороде металл окисляться не будет. Для активных металлов эта температура очень высока и лежит выше температуры кипения металла, а металлы менее активные, например медь, удовлетворяют этому условию при более низких температурах.
Применяя упрощенное уравнение для стандартного изменения энергии Гиббса AG0 (см. п. 8.3), можно получить следующие уравнения для диссоциации оксидов:
2. Cu20 ^ 4Cu + 02; AG£U20 = 334 720 - 150,37 Т
: 2Fe + 02; ДСре0 = 527 360 — 114,75 Т;
2FeO:
|
Рис 9 1 Система взаимодействия металла с кислородом |
2MnO ^ 2Мп + 02; А0^пО = 769 860 — 148,05 Т; SiCWSi + 02; AGsi02 = 1 718 600— 181,66 Г; 2/зА12Оа**4/зА1+ 02; AG£,= 1 116600 — 209,11 Т.
|
Рис 9 2. Зависимость ДС° и логарифма давления диссоциации оксида металла от температуры |
|
|
|
|
|
ВО + А |
|
% —»- В + АО |
|
р % |
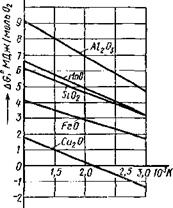
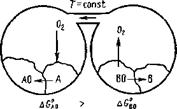
Рис. 9 3 Изменение ДС° в зависимости Рис 9 4 Схема металлотермического от температуры для АЬОз, S1O2, восстановления оксидов металла при MnO, FeO, CU2O Т = const
На рис. 9 3 приведены графики функций AG° = }(T). Термодинамическая устойчивость оксидов возрастает в ряду элементов Cu->Fe-*-Mn-*-Si-*-Al, но в интервале температур 2500...3000 К устойчивости оксидов Мп и Si меняются местами. Температуры, при которых термодинамическая устойчивость обращается в нуль, соответственно будут следующими: Тсщо = 2230 К; 7Veo = = 4600 К; 7’мпо= 5200 К; Ts,02 = 4730 К; ГАІ2о3= 5330 К (это ориентировочные данные, полученные очень приближенным расчетом).
Термодинамическая устойчивость существенно изменяется в зависимости от парциального давления газообразного продукта реакции в окружающей среде.
Если для оксида железа при температуре 4600 К AGpe0 = 0 при давлении р= 1,013-105 Па, то при давлении /7 = 1,33 X X 10~2 Па (10-4 мм рт. ст.) ДG0 будет равна нулю при температуре ~2000 К. Поэтому в сварочной технике широко используют вакуум, так как он резко снижает устойчивость поверхностных оксидов металлов.
Различная термодинамическая устойчивость соединений, например оксидов, позволяет осуществлять окислительно-восстановительные реакции между ними.
Возьмем два изолированных сосуда при Т = const (рис 9.4). В одном из них находится система 2АО*=±2А-|- Cbf, а другом — 2ВО =f± 2В + 02f. Допустим, что AGA0>AGg0, а равновесные давления кислорода будут р^<р'о2. Если сосуды соединить между собой, то кислород будет переходить от оксида ВО к металлу Айв результате получим восстановление металла В в результате окисления А:
Такой процесс называется металлотермическим.
Аналогично диссоциации оксидов можно рассмотреть процессы диссоциации сульфидов, нитридов и гидридов металлов, что в такой же степени будет определять их термодинамическую устойчивость. При соединении с элементарными окислителями (О, S, N, Н, галогены) элементы могут проявлять различную степень окисления и диссоциация соединений будет происходить ступенчато от высшей степени окисления к низшей, например:
4/зСг03^2/зСг20з +02f; 2Cr2035=t 4Cr0 + 02f; 2СЮ^2Сг +
+ 02|;
2FeS2^2FeS + S2f; 2FeS ^2Fe + S2f;
SF6^SF4 + F2f; SF4^SF2 + F2t и т. д.
Термодинамическая устойчивость соединений сильно увеличивается, если эти соединения находятся в растворах.