Окисление металлов при сварке
Высокие температуры, используемые при сварке плавлением, с одной стороны, понижают термодинамическую устойчивость оксидов, как это было показано в п. 9.2, но, с другой стороны, скорость их образования резко увеличивается и за очень небольшое время сварочного цикла металлы поглощают значительное количество кислорода. Поглощенный кислород может находиться в металле или в растворенном состоянии в виде оксидов (обычно низшей степени окисления), или субоксидов (ТІбО, ТізО, Ті20), а также может создавать неметаллические включения эндогенного типа, образовавшиеся при раскислении металла более активными элементами. И то, и другое резко снижает качество сварных соединений, особенно пластичность металла шва. Исследования этого вопроса показали, что основная масса кислорода в металле обычно находится в неметаллических включениях [20]. Источниками кислорода в металле при сварке служат окислительно-восстановительные реакции между металлом и атмосферой сварочной дуги, металлом и шлаками, образующимися в результате плавления флюсов или при разложении и плавлении компонентов электродного покрытия, а также при взаимодействии с наполнителями порошковой проволоки.
Особенно велики скорости взаимодействия металла с окружающей средой в высокотемпературной зоне сварки (см. п. 8.6), к которой следует отнести каплю плавящегося металла на торце электрода илн электродной проволоки, дуговой или плазменный разряд и переднюю часть ванны. Более медленно эти процессы развиваются в хвостовой части ванны, так как там температура приближается к температуре кристаллизующегося металла. Температурный перепад между этими зонами настолько велик,
что реакции окисления — восстановления меняют свое направление (см. п. 8.4). Так, в капле плавящегося на электроде металла происходит интенсивное поглощение кремния и марганца в результате окисления железа, в то время как в хвостовой части сварочной ванны кремний и марганец восстанавливают железо, окисляясь сами.
Кроме того, взаимодействие металла с кислородом при сварке осложняется образованием растворов оксидов в металлах, а это сильно изменяет их термодинамическую устойчивость из-за возрастания энтропии в процессе растворения.
ОКИСЛЕНИЕ МЕТАЛЛОВ В РАСТВОРАХ
Все промышленно важные металлы растворяют свои оксиды, образуя жидкие растворы, а некоторые образуют с ними твердые растворы, но обычно в очень малых концентрациях.
Процесс диссоциации оксида металла в растворе может быть выражен уравнением (квадратные скобки обозначают раствор в металле) 2[МеО] *=±2 [Me] + 02|, где [МеО] —оксид металла, растворенный в металле.
Этот процесс в ненасыщенных и насыщенных растворах реализуется различно, как показано на рис. 9.5, а, б.
Для ненасыщенного раствора (рис, 9.5, а) число степеней свободы будет С = 2 + 2 — 2 — 2 или р^ = f(T, х), где х — состав ненасыщенного раствора (обозначение р'02 введено для давления диссоциации, зависящего не только от температуры, но и концентрации раствора). Таким образом, р^ не может уже рассматриваться как константа равновесия, зависящая только от температуры, но эта величина будет определять энергию Гиббса, соответствующую данной системе:
AG = —RTnpQ2- (9.5)
Принимаем, что Кц — К; = Кр при ро = 1.
|
|
Для насыщенного раствора (рис. 9.5, б), в котором появляется еще одна фаза — избыток растворяемого вещества, число степеней свободы будет
|
|
С = 2 + 2 — 3= 1
или
POl=f(T) Xmc = fl(T), а энергия Гиббса будет равна
AG° = —ДЛпро*- (9-6)
|
Р, т, к р, т, хнас~?(Т) Рнс 9 5. Схема взаимодействия металла с кислородом в ненасыщенном (а) и насыщенном (б) растворах |
Следовательно, один и тот же процесс окисления металла может развиваться в насыщенном и ненасыщенном растворе по-разному.
Поведение растворенного вещества в растворе определяется его активностью, а не массовой концентрацией, так как растворенное вещество взаимодействует с растворителем, образуя комплексы переменного состава, а его молекулы могут также взаимодействовать друг с другом. Активность растворенного вещества может быть представлена уравнением
а, = у, N„ (9.7)
где a, — активность компонента в растворе; у, — коэффициент активности — величина, как правило, меньшая единицы; А, — молярная доля или безразмерная концентрация.
В разбавленных растворах (малой концентрации) коэффициент активности стремится к единице. Металлы обычно очень ограниченно растворяют свои оксиды, а оксиды других металлов практически не растворяют.
Для насыщенного раствора (рис. 9.5, б) напишем уравнение, аналогичное выражению (9.7) :
CLнас^^ У насА Нао (9-8)
В насыщенном растворе, концентрация которого определяется только температурой, активность растворенного вещества условно можно принять за единицу, так как оно находится в равновесии со свободной фазой растворенного вещества, и, принимая также уі = у»ао можно записать отношение
а, = А/Анао (9.9)
Тогда при условии ненасыщенности раствора оксида металла в металле можно написать константу равновесия так:
Кр = Ро2 = Ро2(аме/амео)> (9.10)
где аще~ Аме/Аме вас; амео = Амео/Амео нас в соответствии с формулой (9.9).
Отсюда видно, что давление диссоциации ро2 представляет собой функцию концентрации раствора при условии постоянной температуры.
Выразим эту зависимость через расчетные термодинамические функции (AG0):
Ро2 = Ро2(аМео/ аМе) (9.11)
и соответственно
AG = AG0+2і? ПпаМе-—2i? TlnaMeo (9-12)
Если аМео-*"1 и аме-*"1> то Ро2^Ро2> 3 AG->-AG0, но если амео—>-0, что соответствует чистому металлу, не содержащему в себе оксида, то
Ро2 = 0, а AG —оо. (9.13)
Таким образом, можно сделать вывод, что нельзя получить металл чистым по кислороду в условиях равновесных металлургических процессов.
ПОНЯТИЕ О СИСТЕМАХ МЕТАЛЛ - КИСЛОРОД
Рассмотрим взаимодействие наиболее важных промышленных металлов с кислородом. В сварочной технике наиболее часто встречаются сплавы на основе железа — стали самых разнообразных марок и назначений. Общий объем сварных конструкций из стали исчисляется десятками миллионов тонн.
Медь и ее сплавы сваривают в очень небольших объемах, так как медь — дефицитный цветной металл. Сварные изделия из меди необходимы в электротехнической промышленности, в химическом, энергетическом и общем машиностроении. В последнее время непрерывно увеличивается производство сварных конструкций из титана и его сплавов, из алюминия и его сплавов, а также из тугоплавких металлов, таких как вольфрам и молибден.
Система железо — кислород. Железо может проявлять в своих соединениях степень окисления от +6 до +2. Оксид Fe03, образованный ковалентными полярными связями, обладает кислотными свойствами, неустойчив и при сварке образоваться не может. Оксид Fe203 — соединение со смешанными связями, ам - фотерное — образует соли (ферриты). В природе Fe203 встречается в виде железной руды — гематита, или если он гидратирован, то в виде (РегОз-ШО), бурого железняка или гетита.
При высоких температурах Fe203 разлагается
ЗРезОз 2Fe304 -)- 1 /202,
при температуре 1725 К давление кислорода будет 105 Па. Феррит железа Fe304 = Fe(Fe02)2— очень устойчивое соединение. Встречается в природе в виде магнетита — железной руды. При температурах выше 845 К Fe304 разлагается
|
(9.14) |
2Fe304 ^6Fe0 + 02f; lg po2 = - 32 056/Г + lg T + 14,55;
при температурах ниже 845 К реакция идет сразу до железа:
|
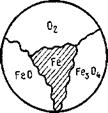
Рис. 9.6. Нонвариат* ная система железа, его оксидов и кислорода |
1/2Fe304 ^3/2Fe + 02t; lgp02= - 28 264/7" + lg T + 10,076. (9.15)
Основной оксид железа FeO легко окисляется и переходит, поглощая кислород, в Fe304 и потом в Fe203. При температурах выше 845 К оксид может разлагаться до железа:
2Fe0^2Fe + 02f; lgPo!=- 26 868/7’ + lg7’ + 8,4. (9.16)
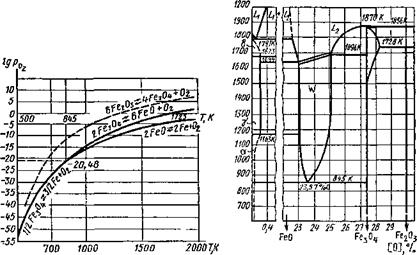
Оксиды железа при Т = 845 К образуют нонвариантную систему (рис. 9.6) Fe304; FeO; Fe; Ог, существующую при строго определенных параметрах состояния (Г = 845 К; lgрог = = — 20,48).
|
Г, к |
|
Рис. 9.7. Зависимость логарифма давления Рис. 9.8. Диаграмма плавкости сис- диссоциации оксидов железа от темпера - темы Fe—О (массовые доли) туры |
Уравнения (9.14)...(9.16) приведены по В. А. Кистяковскому, и совместным решением этих уравнений можно определить параметры нонвариантной системы.
Кривые давлений диссоциации по этим уравнениям приведены на рис. 9.7, но эти кривые характерны для насыщенных растворов. Области между кривыми характеризуют ненасыщенные растворы, которые могут существовать в системе железо — кислород в зависимости от температуры и концентрации кислорода. Такими фазами в системе железо — кислород будут:
L — жидкий раствор FeO в железе, предельную концентрацию можно определить по уравнению Н. Н. Доброхотова:
lg[% FeO]Hac= - 6000/Г + 3,36; (9.17)
Z.2 — жидкий раствор FeO в Fe3C4( ликвирующий с раствором L,
6 — твердый раствор FeO в 6-железе;
у — твердый раствор FeO в у-железе (оксиаустенит);
а — твердый раствор FeO в а-железе;
W—твердый раствор FeO в Fe304, образующийся при кристаллизации L2 и существующий при температуре выше 845 К — вюстит.
Все эти фазы представлены на диаграмме плавкости системы Fe—О, которая приведена на рис. 9.8.
Наибольшее значение для металлургических процессов при сварке имеет область L, соответствующая сварочной ванне, поглощающей кислород. Она отделена от остальной сисемы линией, уравнение которой (9.17) приведено выше.
Процессы в этой области: 2[FeO] 2[Fe] + 02f.
раствор раствор газ
Константа равновесия может быть записана так:
Кр = Рсъ = p'oftlc/a FeO = f (7), (9.18)
где рЬг—давление диссоциации, зависящее не только от температуры, но и концентрации кислорода; po,— давление диссоциации для насыщенного раствора, зависящее только от температуры (AG0 = — RT In р02); aFe и aFe0 — активности компонентов раствора (см. рис. 9.7).
Ввиду малой растворимости оксида железа в жидком железе [уравнение (9.17)] можно записать:
aFe = Nfz jNve«ас « [% Fe] / [% Fe]Hac « 1; aFeo = /Vrco/AVeo нас « [% FeO] / [% FeO]пае.
Подставляя эти значения в уравнение константы равновесия, получим
Ке = Ро2 = р'о, [ % FeO] V [ % FeO]2. (9..19)
По формуле (9.19) можно найти энергию Гиббса для этого случая:
р'ог = Рог [% FeO]2/[% FeO] „ас;
AG = — RT In p'o, = AG° + 2RT In [% FeO] sac — 2RT ln[%FeO].
(9.20)
Из полученных уравнений видно, что при [% FeO] -»- —>- О p'os —>- 0, а AG-voo, т. е. при любых малых концентрациях кислорода в газовой атмосфере жидкое железо будет его поглощать, окисляясь при этом, из-за чего в процессе сварки стали
любым способом не можем избежать окисления металла шва^и
|
Рис. 9.9. Нонвари - антная система меди, ее оксидов и |
должны принимать дополнительные меры для снижения содержания кислорода до допустимых пределов — раскисление.
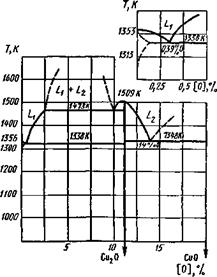
Система медь — кислород. Медь с кислородом образует в основном два соединения: куприт Си20 и тенорит СиО, которые вместе с кислородом и металлической медью образуют при Т « 650 К нонвариантную систему (рис. 9.9). Медь — малоактивный металл и его оксиды относительно легко распадаются. Наиболее устойчивый оксид — Си20, образующий растворы в жидкой меди:
4Си + 02 ї=ї 2[Си20].
КИСЛОрОДа жидк. раствор
В растворе он повышает свою устойчивость, но в момент кристаллизации образуется эвтектика Си—Си20 и свободная фаза Си20 теряет свою устойчивость. «Водородная болезнь» меди, приводящая к разрушению металла, вызывается следующим процессом:
2 [Н] + Си20 2Си + Н20.
Водород, растворенный в металле, взаимодействует с Си20, находящимся в эвтектике, и восстанавливает его до Си, но образующаяся при этом вода не может диффундировать в металл и разрушает его по границам зерен.
Диаграмма плавкости Си—О приведена на рис. 9.10. На диаграмме область L указывает на образование раствора Си20 — Си, но растворимость Си20 в твердой фазе ничтожно мала. Таким образом, при сварке меди и ее сплава необходимо принимать все меры для снижения степени ее окисления или вводить раскислители (см. п. 9.4).
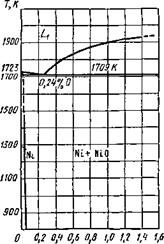
Система никель — кислород. Никель с кислородом дает два соединения: №20з и NiO; Г4і20з малоустойчив, сильный окислитель и используется для получения электрической энергии в щелочных аккумуляторах. В условиях сварки он не может существовать.
|
Рис. 9.10. Диаграмма плавкости системы Си — О (массовые доли) |
|
|
|
Рис. 9.11. Диаграмма плавкости системы Ni — О (массовые доли) |
|
СО] Л |
Оксид NiO устойчивый, обладает основными свойствами, сильно растворим в жидком никеле, а в твердом никеле почти не растворяется. Диаграмма плавкости Ni—О приведена на рис. 9.11.
Процессы окисления при сварке для никеля рассчитывают так же, как для железа и меди, с учетом активности оксида в растворе.
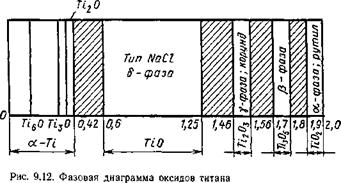
Система титан — кислород. Титан с кислородом образует ряд осидов с различной степенью окислення: ТіО; Ті203; Ті305; Ті02, а также ряд субоксидов: Ті20; ТізО; ТібО. Кроме того, кислород может растворяться в твердом металле. Оксиды, особенно низшей степени окисления, обладают большой шириной области гомогенности. На рис. 9.12 приведена фазовая диаграмма оксидов титана, в которой заштрихованные участки представляют собой двухфазные области. Диаграмма плавкости Ті—О для малых концентраций кислорода приведена на рис. 9.13 (по И. И. Корнилову). Титан — весьма активный металл и его оксиды все термодинамически устойчивы, наиболее устойчив низший оксид ТЮ, повышающий свою устойчивость при растворении в жидком титане. Процессы диссоциации оксидов титана идут ступенчато:
т,’°*
ТЮ2-------------- V ТІ2О3 -► ТЮ -► Ті.
рутил
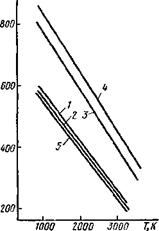
Графики изменения значений AG0 в зависимости от температуры приведены на рис. 9.14, уравнения стандартного изменения энергии Гиббса по стандартным значениям энтальпий и энтропий приведены ниже:
6ТЮ2 ^ 2Ti305 - f 02f; AG° = 745 960-162,28 Т (кривая 1);
4Ti305 ^ 6Ti203 + 02f; AG° = 724 200-160,12 T (кривая 2);
2Ti2(W4TiO + 02f; AG° = 963 200-186,88 T (кривая 3);
2ТіО^* 2Ti + 02f; AG° = 1 036 780-196,54 T (кривая 4);
4Ti02 ^ 2Ti203 + Out; AG° = 718 400-159,96 T (кривая 5);
Атомов кислорода на атом титана
|
0 0,2 0А 0,6 0,8 1,0 1,2 1,ц 1,6 1,8 2,0 1- Г~1-- 1- 1-- 1-- 1- 1--- 1- 1-- 1---- 1----- 1---- 1 і - 1--------- 1 1 1 rn
|
Г, К
|
/О 20 30 00 тл Рис. 9.13. Диаграмма плавкости системы Ті—О (атомные доли) для малых содержаний кислорода |
|
А0° кДж
Рис. 9.14. Изменение AG0 для ступенчатой диссоциации окси-і дов титана |
2500 2300 2/00 то то
1500
то то
ООО
700
Система алюминий — кислород. Алюминий образует один оксид А1203 (корунд) и два субоксида АЮ и А120, но субоксиды крайне неустойчивы. Корунд А1203 образует ряд гидратов и проявляет изоморфизм:
А1203 • ЗН20 -^ткА1203 • Н20 -§Z§5. v. А120з - ІШ*. а-А120з
гидраргилит бемит у корунд а корунд
Наиболее устойчивая форма оксида алюминия — а-корунд; А120з — амфотерный оксид, образующий соли как в кислой, так и в щелочной среде, чем пользуются при подготовке к сварке, протравливая поверхности соединяемых деталей и электродной проволоки._ Субоксиды алюминия получаются при сплавлении А120з с алюминием:
А1203 + А1 ^ ЗАЮ (71 = 1773 К);
А1203 + 4А1 ^ ЗА120 (Т = 1873 К) -
Оксиды алюминия не растворяются в металле и при поглощении кислорода при сварке образуют или пленки оксидов, или просто включения А1203. И то и другое сильно понижает качество сварных соединений.