Энергия Гиббса и учение о равновесии в гомогенных системах
Как уже рассматривалось в п. 8.2, энтропия как термодинамическая функция может указывать своим изменением направление самопроизвольно протекающих процессов, а также стремление системы к состоянию равновесия:
|
ds — 0; s —► s |
при U = const у = const.
Для физико-химических процессов условие постоянства внутренней энергии очень неудобно, так как при химических реакциях или фазовых превращениях она неизбежно изменяется.
Большинство металлургических процессов совершаются при постоянном давлении и температуре, поэтому для исследования условий равновесия металлургических реакций будем использовать функцию G — энергию Гиббса, которую сам автор назвал термодинамическим потенциалом:
G = U-Ts + pV-, I
dG—dU — Tds — sdT + pdv - f vdp. j
Так как Tds=dQ = dU - f pdo, подставляя это значение, получим
dG — — sdT - f - vdp.
Следовательно, для обратимого процесса при условии Т = = const и р —const
dG-+ 0; G—Gmi,
Стремление энергии Гиббса G к минимальному значению (условие экстремума) указывает на приближение системы к равновесию при постоянной температуре и постоянном давлении, т. е. в условиях, приемлемых для исследования металлургических процессов.
Широкое применение функции G для изучения металлургических процессов требует ее некоторого дополнительного исследования.
|
|
Для обратимого процесса или равновесия значения частных производных будут:
(8.39)
Таким образом, энергия Гиббса может быть рассчитана на 1 моль вещества, так же как и энтропия, так как v представляет собой молярный объем при данных условиях.
Энергия Гиббса системы, состоящей из многих компонентов, будет зависеть от их концентрации или активности, а также от
возможного взаимодействия между тзими. Полный дифференциал энергии Гиббса в этом случае будет
(8.40)
где Пи Я2 и т. д. — числа молей компонентов в системе.
Если положить значение частной производной (<?G/дя,)=р.,, то получим новую функцию ■— химический потенциал, зависящий от р и Т, а также от состава системы или активной концентрации данного компонента. В этом случае условие равновесия можно записать так:
k
2|Aid«i=0, (8-41)
і=і
или, вводя коэффициенты уравнения химической реакции,
k
Sn, v,=0. (8.42)
,=i
Таким образом, условие обратимого равновесия должно соответствовать и постоянному составу системы, в которой все изме
нения должны быть взаимно компенсированы.
Соотношения рассмотренных функций для термодинамических систем удобно представить в виде следующей схемы, предложенной В. А. Киреевым:
|
Энтальпия или энергосодержание Н
|
|
ВЫЧИСЛЕНИЕ ЭНЕРГИИ ГИББСА И УСЛОВИЯ РАВНОВЕСИЯ |
Обычно энергию'Гиббса выражаем сокращенно:
G = H-Ts, (8 43)
так как U-{-pv представляет собой уже известную функцию — энтальпию Н (см. схему). Для вычисления энергии Гиббса известны расчеты энтальпий из первого начала термодинамики (см. п. 8.1) и расчеты энтропий как чистых веществ, так и их смесей (см. п. 8.2), поэтому расчет равновесий с помощью изменения энергии Гиббса не представит особых затруднений.
Для чистых веществ энергия Гиббса будет равна G — H—Ts, и величины, входящие в это уравнение, можно считать известными Используя эти данные, можно вести расчет фазовых превращений, так как энергии Гиббса для условия равновесия должны быть равны между собой, а разность между ними обращается в нуль:
AG = — 6/2 = 0-
Расчет химических равновесий в гомогенной среде. Гомогенной называется .система, в которой отсутствуют границы раздела, делящие ее на отдельные части, и частицы всех веществ, составляющих эту систему, находятся в одинаковых условиях теплового движения. Такие системы представляют собой, например, газовые смеси или растворы
Общее условие равновесия — равенство нулю изменения энергии Гиббса:
dG= 0; AG = 0.
Рассмотрим расчет равновесия на примере диссоциации углекислого газа, которая возникает при сварке в струе СОг".
2СО + 02 ** 2С02-
При равновесии
A G — —2 G со— G ог~Ь 2 G сог=0.
Однако любая равновесная система представляет собой смесь различных газов, на значение энтропий которых будет влиять концентрация:
s'T—sT— RlnNt, и значение энергии Гиббса в этом случае
G =// — Ts' = Н — Ts + RTn М- После подстановки получаем
AG = —2 Н соЧ - 27500— 2Л! 7" In N с о— Н о,-)- Т$ съ—
— #rinWo2+ 27/ со2— 27sco2+ 27? Tin N соа= 0. (8.44)
Группируем члены, входящие в уравнение (8.44):
АНРеакц= —2Н со— Н о2+ 2Н со»
А5реакц= —2S СО— 5 Oj-)- 2s СО»
RTп КN=-2RTnNсо-RTnNo,+
+ 2RTnNco1=RTn[N2coAHcoNo)l
*го,
ЛN ---- ЛГг - Л0. ’
™со ™02
где KN— константа равновесия, выраженная через молярные доли.
Подставим обобщенные выражения в уравнение (8.44):
AG = ЛЯ - TAs + RTIn KN= 0,
, к АЯ, As
In Ал/ “r” ^ •
Константа равновесия /Слі определяется соотношением молярных долей реагирующих газов в состоянии равновесия и представляет собой сложную термодинамическую функцию. Точнее, ее следует определять не через молярные доли реагирующих газов, а через фуггитивности f, учитывающие взаимодействия между молекулами газа. При достаточно высоких температурах и малых давлениях существенного различия между Кп и Кf не наблюдается. Справочными данными служат значения K. f-
Kt = Пр, Т).
Если константу равновесия выразить через парциальное давление реагирующих газов (р, = РоК,), то между Кр и K# легко установить количественные связи:
К — РСО2 — ^со, Ро — К „п~1
Р - рЬорог ЛГ£ор]що2Ро " ’ а в общем случае
KP = KNp? n=f{T), (8-46)
где Егс — сумма коэффициентов уравнения реакции, причем коэффициенты начальных веществ берутся со знаком минус (2СО + 02 СО2: — 2 — 1 + 2 = — 1 = Ъп). Если Ъп = 0, например, в реакции Н2 + F2 2HF, то константы равновесия между собой равны КР ~ Kn и безразмерны, а если р0 = 1, то равенство сохраняется, но у КР появляется размерность — давление в степени Ел.
Константу равновесия можно выражать и в других величинах, например молярных концентрациях (моль/л) и т. д. Используя значение константы равновесия, вычисленное по термодинамическим функциям или найденное экспериментально, можно определить равновесные концентрации.
Пример 4. Определить процентный состав равновесной газовой смеси, образовавшейся при нагревании метана до Т = 2000 К. 2СН4 з=е С2Н6 -f Н2. Константа равновесия при дайной температуре равна К = 8,5-10~2. Реакция идет при Хп = 0, следовательно, константа безразмерная Составляем таблицу для расчета концентрации в момент равновесия
извлекаем корень ——— =0,2915,
|
Газ |
Взято |
Ушло |
Получено |
Равновесие |
|
С2Н6 |
_ |
_ |
X |
X |
|
Н2 |
-- |
— |
X |
X |
|
сн4 |
2 |
2х |
— |
2-2% |
отсюда х — 0,583 —0,6583лг, х = 0,5830/1,6583 = 0,3682, где х — мольная доля газа в смеси
Состав газа СН4 = 1,2636, С2Н6 = 0,3682; Н2 = 0,3682 моль, а в объемных долях 63,18% СН,, 18,41% С2Н6, 18,41% Н2
ИЗОТЕРМА ХИМИЧЕСКИХ РЕАКЦИЙ
Исследование энергии Гиббса позволяет определить наиболее благоприятные физические условия для осуществления данного процесса — Т, р, С, т. е. температуру, давление и соотношение концентраций.
Рассмотрим при постоянной температуре и давлении изменение энергии Гиббса AG для обратимой химической реакции между веществами, взятыми в произвольных концентрациях:
А + В*±АВ;
AG = АН - ТAS + RTn[N'AB/(N'AN'B)] = 0. (8.47)
Так как Na& N'A, N'B не равновесные, а произвольные концентрации, их отношение обозначим П == N'ab/(N'aN'b) .
Для этой же химической реакции запишем уравнение AG в условиях равновесия:
AG = АН — Т As + Л Пп/С» = 0.
Вычитаем эти уравнения одно из другого и получаем при Т = = const
AG = RTnYl—RTnKN - (8.48)
Это уравнение носит название «изотерма химических реакций» и дает возможность проследить влияние концентраций на условия равновесия обратимых реакций.
В самом деле, если положить, что N'AB — 0, то ГІ — 0; 1пП —► — оо и тогда
AG = 7?7ТпП— RTIuKn — — оо,
т. е. реакция пойдет в сторону образования АВ.
Если положить Na или N’B или обе величины равными нулю, то N'a —► 0; П — оо и тогда
AG = 7?ПпП— RTIbKn — + а направление реакции будет обратным, так как обязательно будет появляться компонент А.
Если величины П и случайно будут равны между собой, то процесс окажется в равновесии:
AG = 7?ПпП - RTlnKs = 0 (^).
Таким образом, если AG не равно нулю, то реакция возможна, а ее направление будет указывать знак изменения энергии Гиббса:
при AG<0 реакция идет вправо;
при Д(?> 0 реакция идет влево.
Пример 5. Константа равновесия диссоциации С02 С02^СО + ('/2)02
при температуре 3000 К = 0,33; In Kn = — 1,108.
Определить, в каком направлении будет происходить реакция диссоциации, если взять 1 моль СО2, 1 моль СО, 1 моль 02 (2п = 3):
АСо2 = 7з, At о = 7з; А, о2 = 7з; п = '/з(. /?}■= /о;337 1пП = 0,55;
/з
AG = RT{In П — In K„) = RT(0,bb + 1,108) >0.
Реакция пойдет в сторону образования С02, так как кислород взят в избытке.
СТАНДАРТНОЕ ИЗМЕНЕНИЕ ЭНЕРГИИ ГИББСА
Необходимость определения изменения энергии Гиббса для различных процессов и отображения ее в справочной литературе привели к введению очень удобной термодинамической функции, а именно «стандартного изменения энергии» Гиббса.
Если в уравнении «изотермы» химических реакций при данной температуре положить все исходные концентрации равными единице, то П = 1; 1пП=0 и
ДО0 = RTnH— RTuKn= ~ RTlnKti
дG° = - ЯЛп/Слг= ЛЯ - TAs. (8.49)
Уравнение для стандартного изменения энергии Гиббса AG0 очень широко используется, особенно если выполняются ориентировочные расчеты с малой точностью.
Однако в отличие от стандартных значений разности энтальпий Д#298 is 11 значений энтропий s^e. is стандартное изменение энергии Гиббса представляет собой функцию температуры и определяется через Л№ и s°, значения которых приведены к соответствующим температурам. В справочной литературе приводятся значения ДОг98,і5 Для многих веществ. Для многих процессов удобно использовать уравнения температурной зависимости, ко-
|
Таблица 84 Некоторые данные по уравнениям стандартного изменения энергии Гнббса (D = 0)
|
торые по форме совпадают с теоретическими уравнениями, полученными на основании третьего начала термодинамики:
= А + ВТпТ + DT* + СТ. (8.50)
В справочной литературе для многих процессов приведены значения стандартного изменения энергии Гиббса, значения коэффициентов уравнения (8.50) приведены в табл. 8.4.
Учитывая, что уравнения химических реакций и AG° могут быть комбинированы, то даже небольшое количество справочных данных дает возможность вести сложные расчеты.
Пример 6. Определить константу равновесия реакции СН4-|- НгО^ЗНг + СО при температуре 1000 К и давлении р = 1-105Па, а также концентрацию водорода в равновесной смеси, если СН4 и Н20 были взяты в равных объемах. Указать, в какую сторону будет смещать равновесие повышение давления (использовать Данные табл. 8.4).
Представляем заданный процесс как сумму трех процессов (номера процессов соответствуют табл. 8.4):
2. СТ„+2Н2«СН4 -1 AG? = —69 900 + 50,578 Tig Г — 59,356 Т.
3. Ств+(У2)02^С0 +1 AGS = — 1И 606 — 87,57 Т.
1. Нг + (У2)02^Н20 -1 AG? = -246 202 + 54,758 Т.
СН4 + ЗН2 + СО
Подставляем значение температуры и суммируем уравнения стандартного изменения энергии Гиббса, изменив знаки в соответствии с решением:
AG° = —A G° + A G° — Дй? = —30 210 Дж.
Реакция возможна, она идет в сторону образования Нг и СО. Определяем константу равновесия:
до-—|,к.~ -і^т-ыХзыт-'-ъ7‘'- к—зе■
Затем определяем количество веществ (в молях), вступивших н получившихся при реакции, с помощью таблицы:
|
Газ |
Взято |
Ушло |
Получено |
Равновесие |
Состав равновесной смеси |
|
|
моли |
)бъемная доля, % |
|||||
|
сн4 |
1 |
* |
1 —* |
0,125 |
3,33 |
|
|
н2о |
1 |
* |
— |
1 -* |
0,125 |
3,33 |
|
н2 |
— |
— |
3* |
3* |
2,625 |
70,01 |
|
со |
— |
— |
Л |
* |
0,875 |
23,33 |
|
2л = 2 + 2* |
3,75 |
100,00 |
Л^ДГсо 27*7(2 + 2*)’ 27*’
V Л7СН4А7Н20 (1 —*)s/(2 + 2xf (2 + 2*)2(1 - *?
Извлекаем корень квадратный и решаем уравнение, так как корни, имеющие физический смысл, при этом не исчезают:
5 96*2
72+27(1^0= 6'25; OTcI0*a *=0-875- 10—923 273
Найденное значение х подставляем в расчетную таблицу; ответ на последний вопрос задачи — повышение давления будет смещать равновесие в сторону исходных продуктов СН4 + Н2О, так как в этом случае меньше число газовых молекул.
ИЗОБАРА ХИМИЧЕСКИХ РЕАКЦИЙ
Фиксируем давление в реагирующей системе и находим зависимость между температурой и константой равновесия.
Ранее было установлено, что (дG/dT——s, а это дает нам право записать:
[д(ДС?)/(<37’]р= —As.
Значение частной производной найдем из уравнения AG°=—/?ПпЯлг=АЯ— ГAs,
Подставляем значение (—As) в уравнение стандартной энергии Гиббса:
AG°=Atf-TAs=^+r{ =
=—RT]nKx,
или A G°=АЯ — ЯГ In Kn- RT2[-^7/—] = -/?7Tn/Cv.
Сокращая уравнение, получаем при p=const
|
AH |
|
(8.51) |
|
RT |
|
j~ 5(ш |
|
ІП |
|
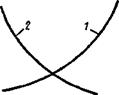
Рис. 8.6. Изменение логарифма KN в зависимости от температуры для эндо - (1) и экзотермических (2) реакций |
Это уравнение носит название «изобара химических реакций» и устанавливает связь между температурой и производной константы равновесия, знак которой будет определяться знаком разности энтальпий АН, т. е. оно будет различным для экзо - и эндотермических реакций. Так, известно, что двухатомные газы диссоциируют в условиях высоких температур:
д(1п Kn)'
|
н2 |
2Н; ДЯ° > 0; > 0;
к„=-^=т.
Следовательно, с повышением температуры константа равновесия будет увеличиваться, а так как в ее числителе находятся продукты диссоциации, то распад будет увеличиваться:
Графически это представлено на рис. 8.6 кривой /. Если рассмотреть смещение равновесия реакции образования углекислого газа, то результат будет противоположный:
2СО+02^2С02; ДН°<0; [ ] <0;
|
|
Следовательно, с повышением температуры константа равновесия уменьшается и молекулы С02 будут распадаться на СО и 02. Графически это представлено на рис. 8.6 кривой 2. Поэтому полученные с выделением энергии вещества (С02, Н20, СЕЦ и др.) при высоких температурах будут неустойчивы и разлагаются.
Таким образом, при р = const равновесие обратимых реакций с повышением температуры смещается в сторону эндотермических реакций.
Влияние давления на равновесие обратимых реакций можно иллюстрировать на примере диссоциации двухатомных газов при высокой температуре:
А2^2А.
Константу равновесия выразим через парциальные давления:
|
|
|
Подставляем в выражение КР и получаем
|
Полагая степень диссоциации равной х, определим равновесные парциальные давления следующим образом: молекул А2 после диссоциации осталось 1—х, а атомов А из каждой молекулы появляется 2, т. е. их будет 2х. Общее число частиц после диссоциации: 1—х--2х=1 4-х. Теперь определим парциальное давление компонентов равновесной смеси при общем давлении ро:
Если ро (общее давление в системе) растет, то х (степень диссоциации) уменьшается при условии постоянной температуры, т. е. равновесие смещается в сторону меньшего числа газовых молекул.
Все эти влияния на смещение равновесия обратимых реакций сформулированы принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, изменяя давление, температуру или соотношение концентраций, то в системе возникнут процессы, уменьшающие это воздействие.
Интегрирование уравнения «изобары химических реакций», казалось бы, должно было позволить вычислить константу рав
новесия обратимых химических реакций:
dnKN=~tdT,
но определение постоянной интегрирования
In K»=-jl+C
требует использования третьего начала термодинамики, кроме того, необходимо учесть, что ДЯ также представляет собой температурную функцию (см. п. 8.1). Эти вопросы не входят в программу нашего курса и желающих можно отослать к специальной литературе, например [8].
ТАБЛИЧНЫЕ РАСЧЕТЫ РАВНОВЕСИЙ
В ГОМОГЕННЫХ СИСТЕМАХ
Для расчета стандартного изменения энергии Гиббса и констант равновесия газовых систем можно пользоваться уравнениями с различной степенью точности, используя справочные данные по термодинамическим величинам. Если, например, не хватает данных для точного расчета, то можно вести приближенный расчет без учета функциональных зависимостей теплоемкости, энтальпии и энтропии, т. е. вести расчет по их значениям при стандартных условиях.
Точное уравнение с учетом изменения теплоемкостей в зависимости от температуры и с учетом энергий фазовых превращений имеет вид
г
і is 2/i С і™ 2/i * тт і As0 і
In - nfJjpdT —-Jjr ДЯ„р+ - T+
T T
. Zn f CadT і Zn A#,
ТГ $ -£TL+-4r--r£L: = + S cpdT +
* 298,15 1 * inD -«ч..-
+2nAHap-TAs°-T2n $ ML-ТЪп-^. (8.52)
298,15 1 JnP
Приближенное уравнение для расчета Kn и AG° очень простое, так как оно полагает A#M8,i5=const, что относительно справедливо для реакций, идущих с большим изменением энтальпии (300...400 кДж). В этом случае относительная ошибка будет не очень велика:
AG°=AH°—TAs0. (8.53)
Более подробно методы расчета рассмотрены в специальных руководствах по физической химии и химической термодинамике, например [8].