Электронный Парамагнитный резонанс в биологии
Исследования каталазы и пероксидазы
Оба эти фермента распространены в живой природе очень широко: каталаза обнаружена практически во всех живых организмах — как животных, так и растительных, а пероксидаза встречается почти во всех растительных клетках. По всей вероятности, эти два фермента принадлежат к числу самых важных ферментов. Они очень сходны между собой, так как роль просте - тической группы в обоих случаях играет гем. В настоящем разделе мы будем рассматривать их совместно, хотя по сути дела они относятся к двум разным группам: каталаза катализирует реак - цшо расщепления (она расщепляет перекись водорода на воду и кислород), а пероксидаза — реакцию переноса группы (в присутствии подходящего акцептора она катализирует перенос кислорода на этот акцептор, который таким образом окисляется). Функция каталазы состоит в защите живого организма от слишком высоких концентраций перекиси водорода, являющейся продуктом действия различных оксидаз. Этот фермент сравнительно легко можно выделить из таких источников, как печень быка, и получать в кристаллической форме. Каталаза обладает высокой специфичностью по отношению к перекиси водорода: она не катализирует разложения никаких других перекисей, а при реакции с перекисью водорода активность ее исключительно высока. Так,
|
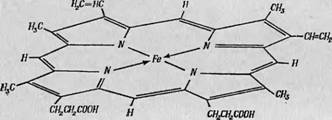
Фиг. 85. Структура гема. Расположенный в центре атом железа окружен четырьмя атомами азота. По пятой и шестой координационным связям атома железа могут присоединяться различные группы (гл. 6). |
При 0° С одна молекула каталазы может разложить за 1 мин 5 млн. молекул перекиси водорода. Это одна из самых высоких скоростей оборота, известных в настоящее время.
Активность каталазы определяется ее простетической группой, имеющей плоскую структуру (фиг. 85). Эта группа — гем — содержит центральный атом железа, окруженный четырьмя атомами азота. Следует, таким образом, ожидать, что ферментативная активность каталазы будет связана с изменениями валентности этого центрального атома железа и что в спектрах ЭПР этого фермента будут наблюдаться как свободнорадикальные сигналы, так, возможно, и сигналы от атомов железа в различных валентных состояниях. Структура пероксидазы в этом отношении очень похожа на структуру каталазы, так как ее простетической группой также является гем, и, судя по данным химических исследований, превращения фермент-субстратного комплекса, образующегося в процессе пероксидазной реакции, должны сопровождаться изменениями валентности атома железа.
Поскольку оба фермента могут быть получены в высокоочи - яценной кристаллической форме, их исследовали самыми различ - яыми методами. Но оказалось, что стандартные химические методы не дают возможности полностью выяснить механизм действия этих ферментов. В результате систематических исследований Джордж [26] предложил схему, согласно которой в процессе катализа образуются два промежуточных соединения:
Пероксидаза 4-Н202 С динстше 1 + А 12- Соединение II-J-AH2- ■»■ Соединение I
Соединение II-г П" -> Пероксидаза-4- АН"
Этот механизм предполагает существование двух одноэлект ■ ройных стадий восстановления, при которых образуются свободно радикальные промежуточные продукты АН". Обычными химическими методами трудно получить однозначные доказательства существования таких промежуточных продуктов, и это как раз тот случай, когда именно метод ЭПР может дать окончательный ответ на этот вопрос.
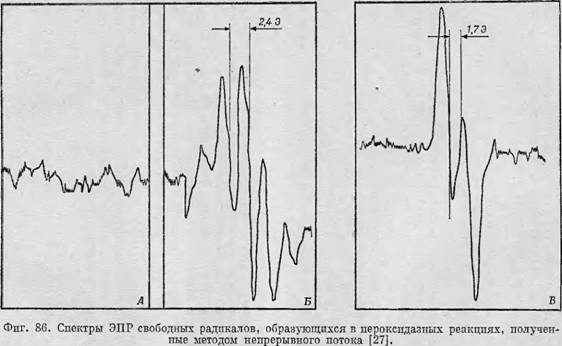
Исследование пероксидазных систем, выполненное Ямадзаки, Пьеттом и Мэзоном [27, 28], явилось одним из первых успешные систематических исследований ферментативной активности методом ЭПР. Основная цель этой работы заключалась в обнаружении промежуточного продукта АН" и в определении условий, при которых возникает сигнал ЭПР этого свободного радикала. В первых экспериментах авторы использовали метод быстрого замораживания, подвергая смесь реагирующих растворов глубокому замораживанию через определенные промежутки времени после начала реакции. Результаты этих экспериментов были в основном негативными; в то время считали, что это объясняется низкой концентрацией присутствующих в образце свободных радикалов, но на самом деле это, по-видимому, обусловливалось уширением линии поглощения на твердых образцах в результате диполь - дипольного взаимодействия. В дальнейшем исследования проводили зь уже при комнатной температуре, и именно в этих исследованиях впервые были продемонстрированы широкие возможности методов непрерывного и остановленного потока для исследования таких ферментных систем. Применив метод непрерывного потоку (разд. 3.4.2), Ямадзаки, Пьетт и Мэзон [27. 28] записали полный спектр ЭПР, наблюдаемый по прошествии различных промежутков времени после момента смешивания исходных реагентов. Некоторые спектры, полученные таким способом, приведены на фиг. 86 (концентрация фермента l0~8—10~7 71/, '^концентрация субстрата 2-Ю-2—5-Ю-3 М, что давало равновесную концентрацию свободных радикалов около 10 ~6 М). Одно из преимуществ этих исследований состояло в том, что изучаемый фермент был доступен в довольно больших количествах, вполне достаточных для проведения опытов.
|
А и Б — реакция окисления гидрохинона. В отсутствие фермента (А) сигнала нет, в присутствии фермента (Б) появляется хорошо разрешенная сверхтонкая структура из пяти линий, обусловленная радикалами бензосемихинона. В — реакция окисления аскорбиновой кислоты. В этом случае свободные радикалы дают спектр С дублетной сверхтонкой структурой. |
В экспериментах использовались самые различные субстраты; на фиг. 86 представлены результаты, полученные для гидрохинона и перекиси водорода [А и Б) и для аскорбиновой кислоты и перекиси водорода (В). Можно видеть, что в обоих случаях заметный свободнорадикальный сигнал появляется лишь в том случае, когда в пробу добавляется пероксидаза; этот сигнал очень интенсивен и обнаруживает сверхтонкую структуру,^которую легко идентифицировать. Так, состоящих^ из пяти линий спектр, приведенный на фиг. 861 Б, легко идентифицировать как спектр свободного радикала бензосемихинона (см. разд. 1.5; фиг. 13), а спектр из двух сверхтонких линий на фиг. 86, В —Каквспектр, который должен давать радикал аскорбиновой кислоты; при тех значениях рБ которые использовались в эксперименте, оба радикала находились в анионной форме.
Таким образом, эти исследования методом непрерыгного потока убедительно показали, что катализируемая пероксидазой реакция действительно сопровождается образованием промежуточных сво - боднорадикальных продуктов. В дальнейшем были проведены систематические исследования. кинетики пероксидазной реакции, для чего изменялась продолжительность временного интервала между начальным моментом смешивания растворов и измерением ЭПР поглощения в резонаторе. Таким способом удалось показать, что равновесная концентрация свободных радикалов пропорциональна Вкорню квадратному из общей концентрации фермента. Это подтверждало механизм, ранее предложенный Джорджем [26], и в особенности то, что ни соединение I, ни соединение О не восстанавливаются самими свободнорадикальными промежуточными продуктами, а исчезновение свободных радикалов происходит в результате процессов дисмутации или димеризации. Позднее Пьетт и сотр. [29], изучив реакцию окисления хлорпромазина в системе пероксидаза — водород — перекись водорода с помощью оптической и ЭПР-спектроскопии (методом непрерывного потока), получили прямые доказательства того, что свободные радикалы исчезают в результате дисмутации. При рН 4,8 образующийся в процессе реакции свободный радикал хлорпромазина обладает высокой стабильностью и может накапливаться в значительных количествах. Если затем повысить значение рН, то эти радикалы исчезают под влиянием дисмутации, причем константу скорости этой реакции можно измерить. Больше того,.'.этот метод позволил осуществить кинетические исследования реакции
АН" Соединение II------------------------- А Пероксидаза,
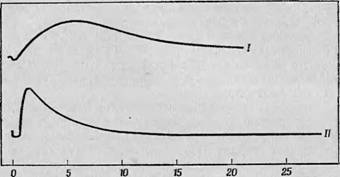
Которая протекает при низких значениях рН, когда дисмутации радикалов не происходит. Кинетика этой реакции для двух различных концентраций пероксидазы представлена на фиг. 87,которая слуяшт превосходной иллюстрацией того, ^и? аким образом кинетику таких ферментативных реакций можно разделить на две отдельные стадии и затем провести количественное исследование каждой из них.
Помимо кинетических измерений на свободных радикалах, возникающих в процессе пероксидазных реакций, были проведены также кинетические измерения ЭПР-иоглощения, обусловленного
|
Время, с Фиг. 87. Кинетика окисления хлорпромазина в присутствии пероксида- Зы [29]. I— концентрация перокеидазы 4-10-s М, II— 3,2-10-7 М. Обе кривые получены для одних и тех же концентраций хлорпромазина и перекиси водорода при рН 4,8. Можно видеть, что повышение концентрации перокеидазы приводит к значительному уменьшению времени релаксации. |
Атомами железа в различных пероксидазах. Эти результаты суммированы в конце разд. 6.6.5 после обсуждения сигналов ЭПР, которые дает геминовое железо.