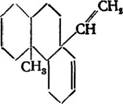
ДЕКСТРОПИМАРОВАЯ КИСЛОТА
Декстропимаровая кислота характеризуется следующими константами:
Темп. пл. 218—219,1. [а]р +75.0° (в спирте) [43], темп. пл. 219,1 [Ufp +82.5° (1%-иый раствор в абс. спирте) [6]; метиловый эфир ее имеет темп. пл. 69° С, темп. кип. 149—150° С при остаточном давлении 0,3 мм рт. ст., Dj9L,030, я)®1,5208;
Этиловый эфир этой кислоты имеет темп, пл 52° С, темп. кип. 169—170° С при остаточном давлении 0,2 мм рт. ст., D41,013, ND 1,5151 [144, 154];
Декстропимаровая кислота менее растворима в органических растворителях, чем левопимаровая.
В предыдущих разделах главы мы описывали кислоты типа абиетаиа (см. табл. 23): левопимаровую, палюстровую, неоа- биетииовую и абиетиновую, составляющие приблизительно 80% от кислотной части живицы (см. табл. 24). В этом разделе и двух последующих приводятся сведения о кислотах типа пима - рана, а именно, декстропимаровой, изодекстропимаровой и сан - дар а копи маровой кислот.
Кислоты живицы впервые были исследованы О. Уифердер- беном в Л826 г. [157], а вслед за Унфердербеном были исследованы в 1840 г. А. Лораном [59], который получил их из галипота Pinus maritime и назвал их пимаровой кислотой.
В 1874 г. А. Каллио [119] опубликовал сообщение, что он получил из галипота P. maritime пимаровую кислоту с темп. пл. 125° С и, примейяя медленную кристаллизацию из спирта, разделил ее на три фракции: 1) декстропимаровую кислоту с темп. пл. выше 200° С и {а]о+56°, кристаллизующуюся в прямоугольных пластинах; 2) левовращающую кислоту с темп. пл. 145° С и {а]о — 66°, кристаллизующуюся в треугольных пластинках (по современным представлениям смесь с преобладанием абиетиновой кислоты) и 3) фракцию, представляющую собой более сложную смесь.
В 1885 г. в более* чистом виде декстропимаровую кислоту с темп. пл. 210—211° С и (а]о+72,5° (из спирта) выделил А. Ве - стерберг [158] из живицы P. maritime. Он показел, что эта кислота имеет состав С20Н30О2.
Декстропимаровая кислота, вероятно, присутствует в большем или меньшем количестве в живице многих хвойных, но не всегда легко удается отделить ее от сопровождающих изомерных смоляных кислот.
В качестве примера выделения декстропимаровой кислоты из смеси смоляных кислот живицы, характерного для периода 40-х годов, можно привести работу В. Н. Крестинского, С. С. Ма - левской, Н Ф. Компшлова и Е. В. Казеевой {43]. Промысловую живицу освобождали от скипидара, полученные кристаллические смоляные кислоты обрабатывали при нагревании небольшим избытком 1%-ного раствора едкого натра. При стоянии выпадали кристаллические натриевые соли. Повторяя перекристаллизацию солей по методу треугольника 3—4 раза, удалось получить довольно чистые препараты солей декстропимаровой и левопимаровой кислот. Полученные фракции солей разлагались 5%-ным раствором уксусной кислоты, а выпавшие в осадок смоляные кислоты дополнительно 2—3 раза перекристалли - зовывались из спирта. Из первой фракции солеи получили декстропимаровую кислоту темп. пл. 211—212° и {а}д + 71,3° (в спирте), а из третьей—левопимаровую с темп. пл. 148— 152°С, [а]д — 278,0° (в спирте).
Г. X. Гаррис и Т. Ф. Сакдерсон [130] описали другой метод выделения декстропимаровой кислоты, основанный на том, что при вакуумной разгонке смоляных кислот она более летуча, чем другие смоляные кислоты. По этому способу канифоль подвергают медленной перегонке при 136—200° С (1 мм рт. ст.) до тех пор, пока не будет собрано дистиллята около 12% от взятой канифоли. Кислотную фракцию дистиллята отделяют от нейтральных веществ обычной обработкой разбавленной щелочью.. Полученные соли разлагают разбавленными • минеральными кислотами. Смесь кислот нейтрализуют бутаноламином и получают бутаноламиновые соли смоляных кислот. Бутаноламино - вая соль декстропимаровой кислоты легко очищается перекристаллизацией. После разложения соли разбавленной минеральной кислотой получается декстропимаровая кислота. Выход чистой кислоты достигает 4% от взятой канифоли.
С. Палкин и Т. X. Гаррис в 1934 г. [140] показали, что очистка смоляных кислот через такие производные, как соли аминов, дает хорошие результаты. При этом разложение солей происходит без больших трудностей. Позднее соли аминов стали использовать для очистки не только декстропимаровой, но и всех смоляных кислот.
Соли получают смешиванием грамм-эквивалентных количеств смоляных кислот и аминов в растворе ацетона. Реакция идет иа холоду или при нагревании на водяной бане в течение незначительного времени. Для абиетиновой кислоты описан ряд солей, свойства которых даны в табл. 32.
Б. А. Арбузов и А. Г. Хисматуллина [3] для выделения фракции, обогащенной декстропимаровой кислотой, применили следующую методику. Смоляные кислоты живицы выделялись из нее через труднорастворнмую циклогексиламиновую соль. Смесь кислог, выделенная из соли, имела fafo — 90,6° (в спирте) и составляла 58,5%-от живицы. Для отделения кислот типа пима - рана от других смоляных кислот смесь кислот растворяли в бензоле, к раствору добавляли малеиновый ангидрид. Раствор насыщался сухим хлористым водородом. Затем этот раствор нагревали на водяной бане в течение 50 ч. Бензол отгонялся с водяным паром, остаток промывали горячей водой для удаления непрореагировавшего малеинового ангидрида. Далее остаток обрабатывали раствором едкого натра, раствор разбавляли и при перемешивании прибавляли разбавленную соляную кислоту до рН 6,2 (по бромтимолсинему). При таком рН продукт присоединения малеинового ангидрида к кислотам типа абиетана остается в растворе. Выпавшие из раствора кислоты экстрагировали серным эфиром. Эфирный раствор промывали водой, сушили сульфатом натрия. После удаления эфира эти смоляные кислоты имели [а]д +14,3° (в спирте) и составляли 16% от общего веса всех смоляных кислот.
Для выделения декстропимаровой и изодекстропимаровой кислот кислоты декстропимарового типа обрабатывались в ацетоновом растворе бутаноламином. В первой фракции выделялись бутаноламиновые соли изодекстропимаровой кислоты, а в последней—.бутаноламиновые соли декстропимаровой кислоты. Соли разлагались 10%-ной соляной кислотой.
Был предложен {451, [51] еще один метод получения чистых препаратов абиетиновой и декстропимаровой кислот. В основу метода положена работа Е. В. Рогинской [80], применившей диацетонаминовую соль для отделения смоляных кислот от других кислых продуктов сухоперегонной смолы.
По предлагаемому методу кислоты живицы или канифоль растворяются в равном по весу количестве ацетона,' содержащего 0,5% соляной кислоты. После кипячения или некоторого стояния выпадают кристаллы, которые отсасываются, перекри - сталлизовываются из ацетона и вновь растворяются, теперь уже в десятикратном количестве ацетона. В этот ацетоновый раствор пропускается сухой аммиак до тех пор, пока не прекратится поглощение газа. Образуется диацетонаминовая соль.
Диацетонаминовая соль перекристаллизовывается 3—4 раза по способу треугольника из ацетона, насыщенного аммиаком. При этом в первой и второй фракциях сосредоточивается диацетонаминовая соль абиетиновой кислоты, а в последней фракции (маточном растворе) — диацетонаминовая соль декстропимаровой кислоты.
Кристаллические диацетонаминовые соли растворяются на холоду в 10%-ной растворе едкого натра. Получаемый раствор подкисляется 10%-ным раствором уксусной кислоты. Выпадают кристаллы смоляных кислот. Как абиетиновая, так и декстро - пимаровая кислоты доводятся до должной степени чистоты перекристаллизацией из спирта. При этом необходимо следить, чтобы спиртовый раствор не имел щелочной реакции.
Как показывает табл. 23, И. И. Бардышев А. Г. Соколов и О. И. Черняева {6] выделили самую чистую декстропимаровую кислоту. Полученный авторами ультрафиолетовый абсорбционный спектр кислоты не-имел максимума, что указывало на отсутствие сопряженной двойной связи и, следовательно, оказалось характерной особенностью смоляных кислот этого типа Ультрафиолетовые абсорбционные спектры, снятые другими авторами в предыдущих работах, все имели максимум, а, следовательно, указывали на содержание примеси кислот типа абиетаиа.
В отличие от других смоляных кислот декстропимаровая относительно стабильна к нагреванию и не изомеризуется при воздействии минеральных кислот. Для нее были получены и изучены калиевая, натриевая, бариевая, алюминиевая, медная и серебряная соли {158]. Как указывалось, декстропимаровая кислота при дегидрировании дает пимантрен (XIX) [144], СієНи, темп. пл. 86° С, пикрат, темп. пл. 131—132° С, стифнат, темп. пл. 159° С.
J1. Ружичка, Г. Б. Р. де Граф и. Д. Р. Госкинг [Н6] показали, что пимантрен (XIX) является 1,7-днметилфенантреном.
После того как была установлена формула строения пиман - трена, стало ясно, что молекула декстропимаровой кислоты имеет фенантреновый скелет и местоположение двух метильных групп такое же, как и у пимантрена.
Декстропимаровая кислота бодержит две двойные связи. Это доказывается каталитическим гидрированием ее с палладием, нанесенным на уголь. В растворе уксусноэтилового эфира получается дигидродекстропимаровая кислота, константы которой у разных авторов не вполне совпадают:
Темп. пл. 236—239° С н [а]в+30,9° (в спирте) [43], темп. пл. 240— 241°С и [а]в+17° (в спирте); ее метиловый эфир с темп. пл. 79—80°С и [а]в +19° (в бензоле) [144].
При гидрировании декстропимаровой кислоты в растворе уксусной кислоты и в присутствии окиси платины в качестве катализатора J1. Ружичка, В. Хайзер и Г. Ф. Зейдель {147] получили смесь тетрагидропимаровых кислот с темп. пл. от 220—223 до 236—237° С. На основании полученных результатов авторы делают вывод о неоднородности данного препарата декстропимаровой кислоты.
Декстропимаровая кислота гидрируется до дигидропроиз- водного значительно легче других смоляных кислот. Она образуется в самых различных условиях гидрирования, в том числе при гидрировании водного раствора натриевой соли в присутствии катализатора Ренея и при комнатной темрературе [138]. "
Получением дигидропроизводного декстропимаровой кислоты можно воспользоваться для количественного определения декстропимаровой кислоты.
При воздействии гидроперекиси бепзоила (по Наметкину) на метиловый эфир декстропимаровой кислоты легко получается монооксид. Одна двойная связь реагирует с гидроперекисью очень быстро, а вторая — гораздо медленнее.
При воздействии гидроперекиси бензоила при низкой температуре на метиловый эфир днгидродекстропимаровой кислоты получается два монооксида с темп. пл. 103—104° С (разлагается) и 118—119° С. Эти два монооксида при воздействии на них серной кислотой в растворе уксусной кислоты образуют один изомер декстропимаровой кислоты, темп. пл. 186—188°С {145].
Л. Ружичка и Ф. Балас {144] проверили реакционную способность декстропимаровой кислоты по отношению к другим реактивам на двойные связи и нашли, что при действии брома присоединяется только одна молекула брома без выделения бромоводорода, одна молекула азотистого ангидрида с образованием иитрозита декстропимаровой кислоты С2оН30—O5N5 темп. пл. 79—80° С.
При насыщении уксуснокислого раствора декстропимаровой кислоты хлористоводородным газом после 11-дневного стояния в темноте получено три изомерных гидрохлорида состава C20H31O2CI. Эти моногидрохлориды имеют следующие константы: темп. пл. 232° С, 184° С. 125° С; [аЬ+13.6°,+ 47,3°.—20,5°.
Декстропимаровая кислота не вступает во взаимодействие с малеиновым ангидридом или хиноном, что является основным указанием на отсутствие в ней конъюгации двойных связей. Эта реакция упоминалась в связи с разделением кислот и отделением декстропимаровой кислоты от кислот типа абиетана [130].
Положение карбоксильной группы в декстропимаровой кислоте было доказано Л. Ружичкой, Г. Б. Р. де Графом, М. В. Гольдергом и Б. Франком [43]. (
При окислении декстропимаровой кислоты перманганатом калия в щелочной среде (25 атомами активного кислорода) или азотной кислотой были получены две кристаллические трехосновные кислоты: СцНіб06 (XXII) темп. пл. 218—219° и СізНівОб темп. пл. 211° (XXI).
Эти кислоты идентичны кислотам, полученным из абиетиновой кислоты, окислявшейся в тех же самых условиях. Поэтому в декстропимаровой кислоте взаимное расположение связанных между собой колец «А» и «С» находится в таком же положении, как это доказано для абиетиновой кислоты, а карбоксильная группа находится в третичном положении у первого углеродного атома.
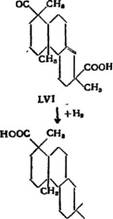
Если декстропимаровую кислоту (LIV) окислять в мягких условиях перманганатом калия в щелочной среде (I—2 атома активного кислорода), то образуется гликоль дигидроксидек - стропимаровой кислоты С20Н32О4 (LV), темп. пл. 224° С (с разложением) и [«]U-|-G,80 (в спирте) совместно с небольшим количеством изомерной дигидроксикислоты, темп. пл. 239° С [59, 144].
При дальнейшем окислении хромовым ангидридом дигидро- ксикислота (LV) дает двухосновную кислоту С^НгвО* (LVI), темп. пл. 260—261° С, которая подвергалась каталитическому гидрированию до образования насыщенной Дигидродвухоснов - ной кислоты С19Нзо04 (LVIlj), темп. пл. 210—220°С, а последняя при дегидрировании с селеном давала пимантрен XIX.
Образование двухосновной кислоты (LVI) и (LV) и дегидрирование декстропимаррвой кислоты до пимантрена (XIX) доказывает, что декстропимаровая кислота содержит винильную группу, связанную с третичным углеродным атомом.
Яоос сн,
|
Ц^н. |
|
JLV |
|
Ноос сн, Х/СООН |
Х/
КМпО.
U
: ucl
|
Ноос сн, Х/ І 'І /л |
|
Но |
|
Сг. О, |
|
•сн, I I /сн'он. снон |
|
LVII |
|
.соон сн. |
LIV j KMnO.
НООС сн,
|
U |
|
V/ |
|
Til. COOH |
|
XXII |
ЛА
Соон
'с^соон
XXI
Подтверждением присутствия винильной группы в молекуле декстропимаровой кислоты является получение с количественным выходом формальдегида при разложении водой озо - нида декстропимаровой кислоты [43, 44].
Применив изопреновое правило, J1. Ружичка с сотр. [43] при^ шли к выводу, что для декстропимаровой кислоты можно пред-? ложить два варианта строения (LIV) и (LVIII).
Несколько позднее Л. Ружичка и Л. Шгернбах [43, 150] доі казали это путем ряда химических превращений. Они получили метиловый эфир декстропимаровой кислоты, провели его частичное гидрирование до дигидропроизводного и этот дигид^ ромегиловый эфир декстропимаровой кислоты окислили гидро*' перекисью бензоила, получив окись эфира дигидродекстропима-і ровой кислоты (LIX). Далее авторы синтезировали три магний^ органических соединения: самой окиси, ее хлористоводородного (LX) и бромистоводородного производных.
Все три продукта обработки магниййодметилом образовали 8-метилпроизводные (LXI), которые при дегидрировании с селеном дали I, 7, 8-триметилфенангрен (LXH).
НООС СН8
|
-СН8 LVIII |
В 1940 г. Е. Флек и С. Палкин [43, 127] предложили формулу (L1V), объясняющую структуру лактона, полученного из декстропимаровой кислоты. Считается, что лактонизапия наиболее возможна при,13-м углеродном атоме. Если предполагать формулу (LVIII) для декстропимаровой кислоты, то для осуществления лактонизацин необходимо перемещение двойной связи в положение 13—14, что невозможно. Если обсуждать формулу (LIX), то для осуществления лактонизацин перемещение может произойти под воздействием минеральных кислот.
На основании опытов озонирования и анализов продуктов дальнейшего расщепления озоиидов декстропимаровой
М дйгидродекстропимаровой кислот В. Н. Крестинский И] Н. Ф. Комшилов [43] пришли к заключению, что строение дек-; стропимаровой кислоты соответствует формулам (LVIII) и| (LIV), причем формула (LIV) более вероятна, поскольку изо-j преновые остатки, на которые она может быть разделена, располагаются правильными рядами, как это имеет место у большинства терпенов.
В 1948 г. Г. X. Гаррис и Т. Ф. Сандерсон (43, 130] произвел^ озонирование дигидродекстропимаровой кислоты. Полученный! в результате обработки водой продукт распада озонида после? восстановления и последующего дегидрирования дал нафтали-! новое производное (LXIII) СмНгі. С этим производным полу-jj чен аддукт с тринитробензолом с темп. пл. 113—116°-С^ С таким же количеством углеродных атомов Получилось наф-і талиновое производное (LXIV) С^Ящ (тоже дающее аддукт с тринитробензолом с темп. пл. 122—123°С), которое была получено при прямом дегидрировании декстропимаровой кис - лоты.
Исходя из формулы (LVIII) надо было ожидать в первом! случае производное (LXV) с 16 углеродными атомами, а во Bto-J Ром — пимантрен (XIX).
На основании упомянутых работ можно считать, что для декстропимаровой кислоты наиболее вероятна Формула строения LIV.