УСТАНОВЛЕНИЕ ОБЩЕЙ СТРУКТУРЫ СМОЛЯНЫХ КИСЛОТ ТИПА АБИЕТАНА
Изучение строения смоляных кислот было начато с изучения структуры абиетиновой кислоты или, вернее, с «так называемой абиетиновой кислоты», физические константы которой, как теперь установлено, не соответствовали чистой абиетиновой кислоте, о чем будет сказано дальше. Из всех смоляных кислот абиетиновая кислота оказалась наиболее доступной для иссле дования, гак как количество ее в канифоли достигает 43—45% (см. табл. 28, 29, 30, 31), она легче всех выделяется из смесей, даже при простой кристаллизации спиртовых растворов.
П. Леви в 1905 г. установил эмпирическую формулу абиетиновой кислоты — C20H30O2 [43].
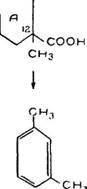
Изучение структуры абиетиновой кислоты было начато методом ее дегидрогенизации. Этот метод изучения терпеновы. х соединений был предложен А. Вестербергом [158]. Сущность метода заключается в том, что при нагревании многих алицнкли - ческих соединений с такими катализаторами, как сера, селен и палладий, получаются ароматические соединения, но строении) которых судят о структуре скелета исходного вещества. Л. Be стерберг при нагревании абиетиновой кислоты до 300 -330° С. с катализатором — серой получил ретен (XX) Chilis, 110 с небольшим выходом. Позднее О. Дильс и А. Карстенс получили лучшие выходы ретена, используя для этой реакции катализатор — селен.
Л. Ружичка и X. Вальдман [151] провели дегидрогенизацию абиетиновой кислоты в присутствии палладиевой черни как катализатора. Дегидрогенизация проводилась с параллельным изучением состава газовой смеси, образующейся при этой реакции. На I моль абиетиновой кислоты были получены следующие количества газов: 4 моля водорода, I моль метана, 0,75
72
Моля углекислоты и 0,25 моли окиси углерода. Таким образом, было доказано, что реакция идет согласно уравнению
СН3 - С18Н26 _ СООН -> СН4 + 4Нг + С1ЯН18 + СО,.
В результате при реакции дегидрогенизации молекула абиетиновой кислоты теряет 2 атома углерода. Один атом углерода отщепляется в виде метана (метильная группировка), а другой— в виде двухокиси углерода (кислотная группировка), остающаяся группировка из восемнадцати атомов углерода, приобретает ароматический характер.
Ко времени опубликования этой работы структура ретена С18Н18 (XX) была уже известна, благодаря работам ряда исследователей (125].
Получение ретена (XX) из абиетиновой кислоты показывает, что кислоте присуща структура фенантрена. Одна метильная группа кислоты находится при 1-м углеродном атоме, а изопро - пильная группа — при 7-м. Неизвестными оставались местона - лождения второй метальной группы и кислотной группы.
Удаление метильной группы при дегидрировании в виде метана показывает, что она может занимать четвертичное положение при 1, 7, 11, 12, 13 или 14-м углеродных атомах. В какой-то степени это же справедливо и для кислотной группы.
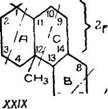
Некоторое приближение к решению данного вопроса дает «зопреновое правило, которое требует, чтобы терпен представ лял собой различное сочетание изопреновых группировок. Изопреновому правилу подчиняются почти все терпены, встречающиеся в природе. Для смоляных кислот это сочетание бу дет из четырех изопреновых группировок, как показано в формуле (XXIX).
Изопреновое правило показывает, что и метильная группа п кислотная группа могут, всего вероятнее, располагаться при 1-м и 12-м углеродных атомах.
Разрешить проблему местонахождения метильной группы >далос(. Л. Ружичкс с сотр. [43, 150], которые пропели окисление абиетиновой кислоти перманганатом калия в щелочной »]>еде 24 атомами активною кислорода.
В результате окисления были получены трехосновная кис - • юта СігНнАі (XXI), темп. пл. 212—213°, ее триметнловый *фир, темп. кип. 133—134°С при давлении 1 мм рт. ст. п трехосновная кислота С((НібОб (XXJJ), темп. пл. 219°, ее тримет. чло вый эфир, темп. пл. 75°С.
Выходы кислот (XXI) и (XXII) были очень незиачптель пы — только 22—24 г каждой кислоты из 3 кг абиетиновой кислоты, но позднее было доказано, что эти кислоты неизменно получаются как после сильного окисления различных смоляных кислот перманганатом калия, так и после окисления азотной кислотой [43, 92, 154].
При дегидрировании и декарбоксилировании кислоты (XXI) получается 1, 2, З - триметилбензол (XXIII), а при дегидрировании и декарбоксилировании кислоты (XXII) — м-ксилол (XXIV) Сопоставляя строение ретена (XX), кислоты (XXI) и 1, 2 3-триметилбензола (XXIII), можно сделать вывод, что неразру шенным при окислении остается кольцо А, а местоположение второй метальной группы находится у 12-го углеродного атома
|
Ноос сн3 |
|
С н3 |
|
XXI |
|
Сн3 Ч/^сн XXIII |
^Ч^СООН
|
|
|
XXII |
|
XXIV |
Доказательство местонахождения кислотной группы у 1-го углеродного атома химическим путем было очень длительным и крайне запутанным. Разрешен этот вопрос был благодаря работам Фоке [43, 125]. Из работ Быстрижицкого с сотр. Фоке было известно, что кислотная группа при вторичном углероде не разрушается от воздействия концентрированной серной кислоты, а при третичном углеродном атоме разрушается даже при простом паї реванпи с образованием углекислого газа. Фоке испытал тетраї идроабиетппоную кислоту п кислоту JI. Ру - жпчкії CiiHi606 (XXII). Результаты опытов подтвердили третичную природу связи для кислотних групп обеих кислот. Затем Фоке произвел дальнейшее расщепление кислоты (XXII). Энергично воздействуя бромом и красным фосфором на кислоту (XXII), он получил ангидрид СЦНМОБ и смесь трех других веществ; СиН, з05Вг (XXV), темп. пл. 215°; СмН. аО^Вгг, темп. пл. 207° и C, iHl30,Br (XXVI), темп. пл. 160°.
Удаление бромоводорода из соединения (XXV) воздействием щелочью сопровождалось потерей углекислого газа. В результате из ангидро-бромкислоты (XXV), как и из броман - гндрнда (XXVI), была получена ненасыщенная двухосновная кислота С10Н14О4 (XXVII), темп. пл. 183°, метиловый эфир ко
торой имеет темп. пл. 132°. При озонировании кислоты (XXVII) была получена кетокислота, а последняя при окислении хромовым ангидридом дала а-метилглутаровую кислоту (XXVIII).
НООС^ снз
|
N |
|
О |
Х/г
Со
/
|
НООС СООН |
Х^-СООН
|
СН3 |
|
ВГОС^-СНЗ |
|
XXVIII |
ЧСООН XXVI! Снз
СО
О
/
XXVI
Работы Л. Ружички с сотр. [43, 125, 149, 151, 154] и Фоке (43, 125] показали, что кислотная группа находится в кольце А и занимает третичное положение при первом углеродном атоме. Только после этих работ стало возможным предложить для абиетиновой кислоты формулу строения (XXIX) с невыясненным пока положением двух двойных связей.
.СНз
'^снз
|
СН, |
|
НООС СН3 |
В дальнейшем стало совершенно ясно, что формулу (XXIX) нужно приписать всем кислотам типа абиетана, отличающимся гіежду собой лишь взаимным расположением двойных связей. Последующие работы в основном и были направлены к выявлению положения двойных связей в молекулах этих КИСЛОТ, что и изложено в последующих разделах.