В МИРЕ ВЕЩЕСТВ
Ж/|олекула — кирпичик вещества. РаздавИхМ в ступке кри - 1¥1 сталик сахара. Он распадётся на множество мелких крупинок. Если мы станем растирать их, то каждая из них, в свою очередь, будет измельчаться всё больше и больше, пока не получится тончайшая сахарная пудра. Где же граница измельчения кристалика? Каковы самые мельчайшие частички сахара, которые ещё будут обладать таким же составом и свойствами, как и кристалик? Эти частички — молекулы. Но ступка — слишком грубое орудие для того, чтобы достигнуть этой границы. Более совершенным орудием оказывается вода: при растворении сахара в воде каждая его крупинка легко дробится на тысячи более мелких, на молекулы. Такое же дробление происходит и при испарении различных веществ.
Молекулы настолько малы, что их не удаётся увидеть даже в самые сильные микроскопы. Однако учёные сумели установить, что размеры этих «кирпичиков» для разных веществ сильно отличаются друг от друга. Как правило, чем сложнее вещество, тем больше размер молекул, которые его составляют. Любой образец какого угодно чистого (т. е. не содержащего примесей) вещества состоит из громадного числа совершенно одинаковых молекул. Поэтому чистое вещество всегда однородно.
Есть ли в природе явления, показывающие, что вещества состоят из молекул? Да, есть. И прежде всего это явления, связанные с движением молекул. Мы знаем, например, что вода существует в трёх состояниях: в виде льда, в виде жидкости и в виде пара. Однако состав её одинаков во всех этих трёх состояниях. Различия в свойствах воды, льда и пара зависят от того, насколько тесно примыкают друг к другу отдельные молекулы воды и насколько они подвижны[22]).
Существуют ли частицы меньшие, чем молекулы? Изучая поведение веществ в различных условиях, химики установили, что и сами молекулы сложны.
Есть вещество, которое называется окисью ртути. Это красный порошок. Если мы станем нагревать окись ртути, то она разрушается, выделяя металл ртуть и газ кислород. Так как окись ртути однородна, — она не смешана ни со ртутью, ни с кислородом, и все её молекулы совершенно одинаковы, — то образование из неё двух новых веществ можно объяснить только тем, что при нагревании происходит разрушение самих молекул. Но ведь это значит, что молекулы окиси ртути состоят из более мелких частиц, из частиц кислорода и ртути! Окись ртути не является каким-либо исключением. Молекулы всех веществ состоят из более мелких частиц. Эти составные частицы молекул называют атомами.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, молекула кислорода — из двух атомов кислорода и т. д.
Атомы в молекулах связаны между собой несравненно более прочно, чем молекулы друг с другом. Подтверждается это хотя бы тем, что, например, разделение молекулы воды на атомы водорода и кислорода требует затраты во много раз большего количества тепла (нагревание до 1000 градусов), чем разрушение кристалла льда (нагревание чуть выше 0 градусов).
Чем отличаются простые вещества от сложных? Все вещества, из которых тем или иным путём можно получить более простые, считаются сложными. Сложных веществ в настоящее время известно уже более двух МИЛЛИОНОВ; Вода, поваренная соль, стекло, спирт, сахар, яичный белок — всё это вещества сложные. Но существуют вещества, которые не разлагаются на более простые. Таких веществ нам известно около ста. Их назвали простыми веществами. Кислород, водород, сера, железо, ртуть, медь, золото — всё это простые вещества. Из простых веществ и построены все сложные вещества.
Зная, что молекулы состоят из атомов, можно вполне точно указать, чём простые вещества отличаются от сложных. Особенность простых веществ заключается в том, что молекулы каждого из них построены из одинаковых атомов. Например, молекула хлора построена из двух атомов:
Атом хлора + атом хлора=молекула хлора.
При разложении молекулы хлора ничего, кроме атомов хлора, получить нельзя. Это простое вещество.
Молекулы же сложных веществ всегда построены из разных атомов. Так, молекула поваренной соли состоит из двух разных атомов:
Атом натрия + атом хлора=молекула поваренной соли.
Это наиболее простой пример молекулы сложного вещества. В большинстве случаев состав молекул более сложен. Так, в молекуле железной окалины 7 атомов, молекула сахара построена из 45, а молекула вещества, составляющего большую часть говяжьего сала, — из 173 атомов. Есть и такие молекулы, которые построены из нескольких тысяч атомов; таковы молекулы яичного белка, каучука и т. д.
По свойствам простые вещества можно разделить на две большие группы — на металлы и неметаллы. К металлам относится большая часть простых веществ. Металлы — натрий, кальций, хром, медь, железо, никель и все другие — отличаются от неметаллов по внешнему виду, блеском. Металлы ковки, хорошо проводят электрический ток и тепло.
Неметаллы — кислород, азот, углерод, сера, фосфор, хлор и др. — разнородны по внешнему виду. Они не ковки. Большинство из них плохо проводит ток и тепло.
Металлы и неметаллы отличаются друг от друга и по своим химическим свойствам (об этом мы подробно расскажем в четвёртом разделе).
Как в химии обозначаются атомы и молекулы? Молекулы разных веществ отличаются друг от друга по «сортам» образующих их атомов. Так, молекулы поваренной соли содержат совершенно другие сорта атомов, чем молекулы воды. Сахар и жир состоят из трёх «сортов» атомов — углерода, водорода и кислорода. В яичном белке к этим трём сортам добавляются атомы азота, фосфора, серы. Все это — атомы простых веществ. Войдя в состав
|
|
|
|
|
Молекулы, они перестают быть «простыми веществами», они становятся составными частями молекулы, образующими её элементами.
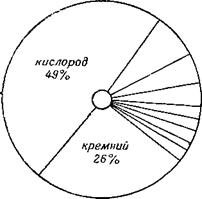
В природе элементы распространены не равномерно. Это показано на рисунке 1 (проценты указаны приближённо). Около половины вещества земной коры с её водами и атмосферой составляет кислород. Он входит в состав воды и почти всех пород земной коры. Второе место занимает кремний. Он входит в состав песка, глин и многих других пород. Остальные элементы встречаются в природе реже и в меньших количествах.
Каждый элемент, а значит, и каждый сорт атомов имеет своё латинское название (названия многим элементам давались в то время, когда научным языком был исключительно латинский) и «символ»—сокращённое обозначение.
|
Русское название элемента |
Латинское название элемента |
Символ Элемента |
Как читается символ |
|
Водород |
Г идрогениум |
Н |
Аш |
|
Кислор'од |
Оксигениум |
О |
0 |
|
Сера |
Сульфур |
В |
Эс |
|
Азот |
Нитрогениум |
N |
Эи |
|
Фосфор |
Фосфорус |
Р |
Пэ |
|
Хлор |
Хлорум |
С1 |
Хлор |
|
Натрий |
Н атриум |
N3 |
Натрий |
|
Железо |
Феррум |
Ре |
Феррум |
|
Цинк |
Цинкум |
Ъп |
Цинк |
Символами пользуются для написания формул различных веществ, показывающих, из каких сортов атомов состоит молекула вещества. Формула «изображает» молекулу. Формула молекулы поваренной соли — ЫаС1 (натрий хлор) показывает, что она состоит из атома натрия и атома хлора. ИНз (эн аш три) — формула молекулы аммиака.
Мы уже знаем, что простое вещество всегда содержит один элемент, а сложное — всегда несколько. Очень важно знать не только элементарный состав вещества, но и соотношения в нём отдельных элементов. Возьмём, например, воду и перекись водорода. И та и другая состоят из водорода и кислорода. В молекуле воды есть два атома водорода и один атом кислорода (Н20), а в молекуле перекиси водорода—два атома водорода и два атома кислорода (Н202). Количественные соотношения между атомами здесь различны, различны и свойства этих веществ. Молекулы сахара и жира также состоят из одних и тех же элементов: углерода, водорода и кислорода, и также отличаются числом атомов этих элементов в молекуле.
Химики стремятся узнать и расположение атомов в молекуле, то-есть строение молекулы. Это важно потому, что, как показал крупнейший русский химик А. М. Бутлеров, химические свойства вещества зависят и от того, в каком порядке атомы расположены в молекуле.
Смеси веществ и химические соединения. Мы уже знаем, что чистое вещество однородно: все его частички имеют одинаковый состав. Например, все молекулы железа одинаковы, также одинаковы и все молекулы серы. Если мы смешаем мелкие железные опилки с порошком серы («серным цветом»), то образуется смесь, в которой имеются отдельные частички железа и частички серы, не связанные химически между собой. Это легко доказать. Насыплем немного нашей смеси на лист бумаги и поднесём близко к ней магнит. Частички железа притянутся к магниту, а сера останется на бумаге. Можно поступить и иначе, например, внести смесь серы и железа в жидкое вещество — сероуглерод. Сероуглерод легко растворит находящуюся в смеси серу, а железо останется в осадке.
Сера, находясь в смеси с железом, не мешает его частичкам притягиваться к магниту. В свою очередь, частички железа не препятствуют частичкам серы растворяться в сероуглероде. Таким образом, каждое вещество проявляет в смеси свои собственные свойства. Смеси можно приготовлять в любых соотношениях. Можно взять 1 грамм серы и 10 граммов железа, но можно составить смесь и из 10 граммов серы и 1 грамма железа. Значит, смеси не имеют постоянного состава. Смесь серы и железа неоднородна. Но бывают и однородные смеси — растворы. О них мы подробнее расскажем дальше.
Проделаем теперь со смесью серы и железа такой опыт. Насыплем смесь в пробирку и подогреем немного её донышко. Дальше вся смесь сама нагреется до красного каления, а затем постепенно застынет в тёмргую твёрдую пористую массу. Теперь попытки разделить железо и серу из этой массы магнитом или растворением ни к чему не приведут — при нагревании произошло химическое превращение, реакция, и из серы и железа мы получили новое сложное вещество—сернистое железо-. Оно не имеет сходства ни с железом, ни с серой. Это показывает, что при химических реакциях свойства веществ изменяются.
При образовании химического соединения произвол в отношении состава уже недопустим. Химическое соединение имеет постоянный состав — его молекулы состоят из определённого числа атомов.
Схема основных типов веществ показана на рисунке 2.
Атомные веса. Атомы разных элементов не одинаковы: они отличаются друг от друга прежде всего весом. Атомы и молекулы — чрезвычайно малые частицы. Например,
В одном грамме воды содержатся миллиарды миллиардов молекул. Поэтому и веса отдельных атомов и молекул очень малы. Но для химика нет необходимости знать, сколько весит каждый атом или каждая молекула — ведь он всегда имеет дело с громадными количествами молекул. Он должен знать, во сколько раз одна молекула тяжелее или легче другой, знать сравнительные или, как говорят, относительные веса атомов и молекул. Для
|
Неоднородные Вещества Смеси |
 Однородные
Однородные
Вещества
1 г
|
|||
|
|
||
Рис. 2. Основные типы веществ.
Сравнения в химии принят атом кислорода. Сравнивая вес атома кислорода, принятый за 16, с весами атомов всех других элементов, химики рассчитали относительные веса всех атомов. Атом водорода весит почти в 16 раз меньше, чем атом кислорода — его атомный вес равен 1,008, это самый лёгкий атом. Атомный вес кремния равен 28,06, железа — 55,85 (атомные веса всех элементов указаны на рис. 3).
Зная относительные, атомные веса элементов, мы можем вычислить относительный вес любой молекулы — молекулярный вес. Рассчитаем, например, молекулярный вес воды Н20: два атома водорода весят
1, 008X2=2,016, атом кислорода — 16, молекулярный вес
воды 2,016+16=18,016; молекула воды в 18 раз тяжелее Vi6 атома кислорода.
Чем же помогают нам эти относительные веса атомов и молекул? А вот чем. Если мы возьмём при одинаковых условиях 14,008 грамма азота (атомный вес его равен 14,008 и 1,008 грамма водорода (атомный вес водорода—1,008), то можем быть уверены, что и в 14,008 грамма азота, ив 1,008 грамма водорода содержится одно и то же количество атомов! Число граммов элемента, равное его атомному весу, называют г р а м м-а т о м о м, а число граммов сложного вещества, равное его молекулярному весу — г р а м м-м олекулой. И если нам требуется, например, получить аммиак из азота и водорода, то мы можем точно рассчитать, сколько граммов обоих газов нужно взять для получения того или другого количества аммиака, так как 1 грамм-атом азота, соединяясь с 3 грамм-атомами водорода, даёт ровно 1 грамм-моле - кулу аммиака. Такие расчёты очень важны для всех химических производств.
Жизнь в мире веществ. В мире веществ идёт своя многообразная и интересная жизнь. Эта жизнь — химические реакции, во время которых молекулы перестраиваются, составляющие их атомы группируются в новые молекулы, образуются новые вещества. В природе непрерывно происходят такие превращения. Появление осенней окраски листьев, накопление сахара в свёкле или крахмала в картофеле, образование болотного газа из разлагающихся под водой растений, разрушение горных пород под действием тепла, воды и воздуха — всё это явления природы, в которых происходят химические изменения вещества, проявляется их «жизнь».
Существует множество типов химических реакций. Вот самые главные из них:
1. Реакции соединения: два или несколько веществ образуют одно новое вещество. Образование ржавчины на железных предметах в присутствии влаги, появление белого налёта на алюминиевых изделиях, горение угля — всё это реакции соединения с кислородом.
2. Реакции разложения: одно вещество даёт два или несколько веществ. Мел при сильном нагревании разлагается на известь и углекислый газ. Питьевая сода, брошенная в кипяток, разлагается на углекислый газ и стиральную соду. Ляпис (азотнокислое серебро),
применяемый в медицине для «прижигания», легко разлагается на свету. При этом из него выделяется металлическое серебро (поэтому и образуется чёрное пятно на смазанном ляписом участке кожи). Другие продукты разложения ляписа — газообразные; мы их обычно не замечаем, но химическими способами их можно обнаружить.
3. Реакции вытеснения: одно простое и одно сложное вещество образуют одно простое и одно сложное вещество, но уже другого состава. В качестве примера такой реакции опишем опыт, выполнить который очень просто. Возьмём несколько синих кристаликов медного купороса и растворим их в воде. Опустим в полученный голубой раствор обыкновенный гвоздь. Через некоторое время мы заметим, что гвоздь покрылся бурым налётом меди, а раствор стал менее голубым или даже совсем бесцветным. Это происходит потому, что железо, из которого состоит гвоздь, вытеснило медь из купороса и само встало на её место:
Железо+медный купорос=железный купорос+медь.
А вот ещё один пример: перед пайкой оловом металл смазывают «травленой» соляной кислотой. Кислоту «травят» цинком. Цинк растворяется в кислоте, вытесняя из неё водород. Хотя кислоту для этого и не подогревают, она «кипит» — из раствора выделяются пузырьки газа водорода.
4. Реакции двойного обмена, как показывает само их название, состоят в том, что молекулы двух сложных веществ обмениваются своими атомами и образуют два новых тоже сложных вещества. Та. кой обмен происходит, например, при получении горючего газа — ацетилена, необходимого при автогенной сварке. Ацетилен получается из соединения кальция с углеродом (карбида кальция) и воды:
|
![]()
|
Кальций I кислород |
![]() Карбид кальция + вода = окись кальция ацетилен
Карбид кальция + вода = окись кальция ацетилен
| кальций| | кислород |
I углерод | углерод | | водород | водород |
Материя вечна. Химические реакции заключаются в изменении состава и строения молекул; при этом атомы как химически неделимые частицы не разрушаются и не образуются вновь. Они только переходят из состава одной молекулы в состав другой. Продукты любой
химической реакции содержат ровно столько атомов, сколько их было в веществах, взятых для реакции, и вес продуктов реакции в точности равен весу веществ, из которых они получены.
На сжигание 12 граммов углерода расходуется 32 грамма кислорода. Значит, в реакции участвует 44 грамма веществ. И продукта реакции, углекислого
|
Основоположник химической науки М. В. Ломоносов (родился в 1711 году, умер в 1765 году). |
Газа, получается тоже 44 грамма. Если мы возьмём 216,6 грамма окиси ртути и разложим её нагреванием, то получим 200,6 грамма ртути и 16 граммов кислорода, то-есть всего вместе 216,6 грамма:
Значит, несмотря на то, что вещества способны к различным превращениям, материя вечна: она не творится вновь и не исчезает. Меняются лишь её форм ы. Этот важнейший закон природы был установлен в 1748 году основоположником химической науки Михаилом Васильевичем Ломоносовым. Великий русский учёный изложил его так: «Все изменения, случающиеся в природе, происходят так, что если что-либо прибавится к чему-либо, то столько же отнимется от чего-то другого. Так сколько к какому-нибудь телу присоединится материи, столько же отнимется у другого».
Ломоносов опытным путём показал, что при химических реакциях количество вещества остаётся неизменным. Этот закон сохранения вещества является одним из основных законов природы.
Химическая реакция не всегда возможна. Химические превращения идут только при определённых, благоприятных условиях. Иногда для этого достаточно простого соприкосновения молекул. Металл натрий никогда не хранят на воздухе — он очень быстро соединяется с кислородом. Если бросить кусочек натрия в воду — сразу же начинается реакция: натрий вытесняет водород из воды. Щёлочь (едкий натр) легко поглощает углекислый газ и превращается в соду.
Многие реакции в обычных условиях не идуг. Однако их легко вызвать, изменяя условия. Например, в смеси рудничного или светильного газа метана (СН4) с воздухом ежесекундно сталкиваются миллиарды молекул метана и кислорода, но реакция между ними не происходит. Но достаточно искры (т. е. сильного нагревания только в одном месте), чтобы смесь мгновенно взорвалась. Порох может сохраняться сколько угодно долго. Но от удара или огня он взрывается. Мы можем смешать сухую питьевую соду с кристаллами лимонной кислоты и они не будут реагировать. Но стоит только их бросить в воду (как это делают любители газированной воды), как между ними сейчас же начнётся реакция, которую мы заметим по выделяющимся с шипением пузырькам углекислого газа. Только при высокой температуре песок, глина и известь соединяются друг с другом и образуют стекло, выделяется из руды железо.
Есть вещества «индиферентные», безразличные друг к другу. Так, винный спирт и вода только смешиваются друг с другом, но никаких новых веществ не образуют. Подобным же образом ведут себя сахар и поваренная соль. Существуют и такие вещества, которые вообще не вступают ни в какие реакции. Это инертные газы — гелий, неон и др.
Закон Менделеева — основной закон химии. Для того чтобы предвидеть возможность или невозможность хими-
Ческой реакции между какими-либо веществами, необхо-* димо было привести в строгую систему все элементы и найти закономерности в изменении их свойств. Эту задачу разрешил великий русский химик Дмитрий Иванович Менделеев. Он открыл «периодический закон». Этот закон гласит: «Свойства элементов (а следовательно, и образованных ими простых и сложных тел) находятся в периодической зависимости от их атомных весов». Считая, что химический характер каждого элемента зависит от его атомного веса, Д. И. Менделеев расположил все элементы в порядке возрастания их атомных весов и построил свою знаменитую таблицу элементов.
На рисунке 3 изображена периодическая таблица элементов в её современном виде. Отметим самые главные черты этой таблицы.
В таблице имеется 9 вертикальных столбцов—г р у п п элементов, от нулевой до восьмой. Все элементы каждой группы, несмотря на различия в атомных весах, имеют сходные важнейшие химические свойства. Например, все элементы одной и той же группы образуют однотипные окислы, то-есть соединения с кислородом. Элементы первой группы дают окислы, в которых на один атом кислорода приходится два атома металла (NasO, К2О). Элементы второй группы образуют уже другие окислы, — в них один атом кислорода соединён с одним атомом металла (CaO, ZnO), и т. д.
Если рассматривать таблицу по горизонтальным рядам, начав, например, с лития (Li), то можно заметить, что каждый ряд включает элементы, разные по свойствам: начинается он элементом с ярко выраженными металлическими свойствами (литий), а кончается типичным неметаллом (фтор F) и инертным газом (неон Ne). Затем снова идёт типичный металл (натрий Na) и т. д. Такие ряды различных по свойствам элементов составляют периоды таблицы (отсюда название закона и таблицы) в
Когда Д. И. Менделеев строил свою таблицу (1869— 1871 года), многие элементы были ещё не известны. Великий учёный оставил для них в своей таблице пустые клетки и, пользуясь периодической зависимостью свойств элементов от их атомных весов, гениально предсказал свойства никому не известных элементов. Когда впоследствии эти элементы были открыты, оказалось, что они действительно имеют предсказанные Менделеевым свойства!
|
Г г |
> У п |
Ы |
|||||
|
1 |
II |
III |
IV |
V |
|||
|
1 |
|||||||
|
2 |
11 3 Литий 6,940 |
Ве 4 Бериллий 9,02 |
5 В Бор 10,82 |
6 с Углерод 12,010 |
7 N Азот 14,008 |
||
|
2 |
3 |
Ма « Натрий 22,99 |
Мд 12 Магний 24,32 |
13 А1 Алюминий 26,97 |
14 Si Кремний 28,06 |
15 р фосфор 30,98 |
|
|
Ч |
К 19 Калий 39,096 |
Са 20 Кальций 40,08 |
8с 21 Снандий 45,10 |
Ti 22 Титан 47,90 |
V 23 Ванадий 50,95 |
||
|
О Я |
®г |
29 Си Медь 63,57 |
30 1п Цинн 65,38 |
3» ва Галлий 69,72 |
32 Ge Гэрманий 72,60 |
33 As Мышьян 74,91 |
|
|
Q. |
К |
ВЬ 37 Рубидий 85,48. |
8г 38 Стронций 87,63 |
У 39 Иттрий 88,92 |
Zr 40 Цирноний 91,22 |
МЬ 41 Ниобий 92,91 |
|
|
Ш |
9 |
47 Ад Серебро 107,88 |
*8 С(1 Кадмий 112,41 |
49 |П Индий 114,76 |
50 Sn Олово 118,70 |
51 Sb Сурьма 121,76 |
|
|
С |
R |
СБ 55 Цезий 132,91 |
Ва 56 Барий 137,36 |
1а 57* Лантан 138,92 |
Hf 72 Гафний 178,6 |
Та 73 Тантал 180,88 |
|
|
О |
79 Ди Золото 197,2 |
Во Нд Ртуть 200,61 |
81 Т| Таллтй 204,39 |
82 РЬ Свинец 207,21 |
83 Bi Виамут 209,00 |
||
|
7 |
РГ 87 Франции 223 |
[*а 88 Радий 226,05 |
Ас 89** Антиний 227,05 |
(ТЬ) 90 Торий |
(Ра) 9» Протнтитй' |
||
|
* Л А |
Н Т А Н И Д Ы |
||||||
|
Се 58 Церий 140,13 |
Рг 59 Празеодим 140,92 |
N4 бо Неодим 144.27 |
Pm 61 Прометий |
Sm 62 Самарий 150,43 |
|||
|
ТЬ 65 Тербий 159,2 |
0у 66 Диспрозий 162,46 |
Но 67 Гольмий 164,94 |
Ег 68 Эрбий 167,2 |
Ти 69 Туллии 169»4 |
|||
|
**А КТ И Н И Д ы |
|||||||
|
Th 90 Торий 232,12 |
Ра 91 Проттитй 231 |
U 92 Уран 238,07 |
Np 93 Нептуний |
PU 94 Плутоний |
Рис. 3. Периодическая таблица
|
ЭЛЕМЕНТОВ |
||||||
|
V! |
VII |
VIII |
О |
|||
|
1 И Водород 1,008 |
НЄ 2 Гелий -1,003 |
|||||
|
З 0 Кислород 16,0000 |
9 р Фтор 19,00 |
Ме ю Неон 20,183 |
||||
|
15 3 Сера 32,06 |
17 (;! Хлор 35,457 |
Аг 18 Аргон 39,944 |
||||
|
СГ 24 Хром 52,01 |
№п 25 Марганец 54,93 |
Ре 26 Ніелезо 55,85 |
СО 27 Нобальт 58,94 |
МІ 28 Нинель 58,69 |
||
|
34 8е Селен 73,96 |
35 Вг Бром 79,916 |
Кг 36 Ир и пт он 83,7 |
||||
|
(ИО 42 Молибден 95,95 |
ТС 43 Технеций 99 |
Ви 44 Рутений 101,7 |
ИЬ 45 Родий 102,91 |
Рй 46 Палладий 106,7 |
||
|
52 Те Теллур1 127,61 |
53 Ио д 126,92 |
Хе 54 ІЇСЄНОН 131,3 |
||||
|
№ 74 Вольфрам 183,92 |
Ве 75 Рений 186,31 |
Об 75 Осмий 190,2 |
IГ 77 Иридий 193,1 |
Р1 78 Платина 195,23 |
||
|
84 Р0 Полоний 210 |
85 М Астатин 211 |
ВП 86 Радон 222 |
||||
|
(Ш 92 Уран |
||||||
|
Ей бз Евсопий 152,0 |
ЙЙ 64 Гідолиний 156,9 |
Ге Железо атомный номер 26 Атомный бес 55,85 Число электронов 26 Число протонов 26 Число нейтронов 30 |
||||
|
УЬ 70 Иттербий 173 Д54 |
ІІІ 71 Лютеций 174,99 |
|||||
|
Ат 95 Америций |
Ст 96 Июрий |
|||||
Элементов Д. И. Менделеева
2 А. М. Рубинштейн
Это показало, каким мощным орудием познания при* роды явился периодический закон. Он оказал громадное влияние на последующее развитие химии.
Как построены атомы и почему они ведут себя по - разному? В дальнейшем учёные раскрыли глубокий смысл периодического закона Менделеева.
|
Великий русский учёный Д. И. Менделеев (родился в 1834 году, умер в 1907 году). |
Мы уже говорили, что атом нельзя разрушить никакими химическими способами. Однако физическими способами удалось это сделать, и оказалось, что сами атомы — очень сложные частицы. Физики открыли несколько типов частиц, составляющих акшы: электрон — частицу, несущую отрицательный заряд (его масса в 1840 раз меньше массы атома водорода); протон — положительно заряженную частицу с массой, равной массе атома водорода, и нейтрон — частицу с массой, равной массе протона, но не имеющую электрического заряда.
По своему строению атомы напоминают солнечную систему. В центре атома находится ядро. Оно состоит из
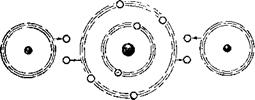
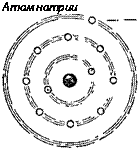
Протонов и нейтронов, как это установил советский учёный Д. Д. Иваненко. Ядро атома заряжено положительно. Вокруг ядра с громадной скоростью вращаются электроны. Они сгруппированы на различных от ядра расстояниях в слои или «оболочки» (см. рис. 4). Так как число протонов в ядре и число окружающих ядро электронов равны, атом в целом электрически нейтрален.
Атомы различных элементов отличаются по числу обраеующих их протонов, нейтронов и электронов. И вот что замечательно: оказывается, что порядковый, атомный номер каждого элемента в таблице соответствует числу электронов, обращающихся вокруг ядра. Имея перед глазами таблицу Менделеева, можно очень просто рассчитать, сколько каких частиц имеется в любом атоме.
Возьмём, например, элемент гелий. Его порядковый номер равен 2. Это значит, что вокруг ядра атома гелия обращается 2 электрона. Но столько же протонов должно быть и в ядре — ведь каждый атом электрически нейтрален. А сколько в ядре нейтронов? Узнать это нам поможет атомный вес гелия. Он равен 4, — атом гелия в 4 раза тяжелее атома водорода. Электроны имеют ничтожную массу, и ими в нашем расчёте можно пренебречь. Значит, в ядре должно находиться 4 частицы с массой, равной массе водорода, 4 протона и нейтрона. Число протонов нам уже известно, их два; следовательно, в ядре атома гелия два нейтрона.
Такими же простыми расчётами можно установить состав любого другого атома.
Теперь познакомимся поближе с электронной оболочкой атома.
Опыты с заряженными телами показывают, что сила, с которой один заряд действует на другой, быстро уменьшается при увеличении расстояния между ними. Значит, и заряд ядра действует на электроны тем сильнее, чем они к нему ближе. Чем дальше находится электрон, тем меньше он притягивается ядром. Кроме того, влияние ядра на удалённые от него электроны ослабляется более близкими электронами. Слабее всего ядро действует на наиболее удалённую от него, внешнюю электронную оболочку. Электроны этой оболочки наиболее подвижны: они могут отрываться от ядра и частично или полностью переходить «во владение» ядра атома другого элемента. Это и происходит при химическом соединении атомов.
В каждую группу периодической таблицы попадают элементы с одинаковым числом электронов на внешней оболочке атома: у водорода, лития и других элементов I группы во внешней оболочке находится только
1 электрон, у элементов II группы — 2, у элементов
|
Атом натрии |
 Атом хлора
Атом хлора
О' /,'/ о
|
Молекула поваренной соли
Рис. 4. Строение атомов и образование соединения путём передачи электрона одним атомом другому. |
III группы — 3 и т. д. А так как в химических реакциях участвуют только внешние электроны, сходство элементов одной и той же группы становится вполне понятным.
У гелия имеется только одна оболочка с двумя электронами. У неона и всех остальных элементов нулевой группы внешняя оболочка содержит 8 электронов. Все эти элементы не способны к химическим реакциям, и мы вправе заключить поэтому, что восьмиэлектронная оболочка наиболее устойчива.
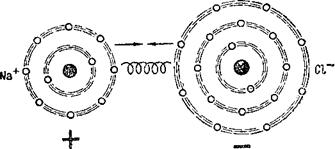
Интересно, что химические реакции протекают так, что атомы, отдавая свои электроны другим атомам или, наоборот, захватывая их электроны, стремятся приобрести именно такую восьмиэлектронную оболочку. Посмотрим, например, как атомы натрия и хлора соединяются в молекулу поваренной соли (рис. 4). Атом натрия имеет
11 электронов. Они расположены в трёх оболочках. Внутренняя оболочка содержит 2 электрона, средняя — 8 и
|
Атом кислорода Атом ЙПІЇПППГІП
|
|
Молекула воды
Рис. 5. Второй способ связи атомов в молекулах—образование электронных пар. |
Внешняя только 1 электрон. При химическом соединении натрия с хлором атом натрия отдаёт один электрон из внешней оболочки атому хлора. Тогда его средняя, восьмиэлектронная оболочка становится внешней. Атом хлора, принимая один электрон, достраивает свою внешнюю оболочку до восьмиэлектронной. Таким образом, атом натрия оказывается заряженным положительно, а атом хлора приобретает отрицательный заряд. Оба они притягиваются друг к другу и образуют прочную электрически нейтральную молекулу поваренной соли.
Вообще атомы металлов легко отдают, а атомы неметаллов — захватывают электроны. Зная это, легко предвидеть, как будет взаимодействовать металл с неметаллом.
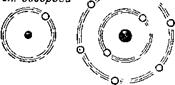
Мы разобрали случай, в котором электрон полностью перешёл из владения ядра одного атома во владение ядра другого атома. Но очень часто (особенно при соединении неметаллов друг с другом) каждый из соединяющихся атомов выделяет в «совместное владение» по одному или по несколько электронов из своей внешней оболочки. На рисунке 5 показано, как из кислорода и водорода образуется вода. Здесь каждая химическая связь между двумя атомами осуществляется парой электронов. В образующейся молекуле воды нет ясно выраженных положительно и отрицательно заряженных частей. Заметим, что описанные процессы только приближённо, упрощенно отражают то, что происходит в действительности.
Что такое валентность? Атом хлора соединяется только с одним атомом водорода. Атом кислорода соединяется уже с двумя атомами водорода, атом азота — с тремя, а атом углерода—с четырьмя атомами водорода. Эти числа, показывающие, со сколькими атомами водорода может взаимодействовать один атом элемента, называют валентностью элемента. Мы можем сказать, таким образом, что хлор — одновалентен, а углерод — четырёхвалентен. Валентность «управляет» соотношением между атомами, вступающими в соединение.
Водород одновалентен, и в реакциях он может отдавать или захватывать только 1 электрон. Значит, валентность показывает также, сколько электронов может отдать или захватить атом данного элемента в реакциях. Если атом отдаёт электрон и становится положительно заряженной частицей, то его валентность положительная (например, у атома натрия). Атом, захватывающий электрон, проявляет отрицательную валентность (например, атом хлора в соединении с натрием). В химических реакциях участвуют только те электроны, которые расположены во внешней оболочке атома. Эти электроны называют валентными. Таким образом, различия в химическом поведении элементов определяются величиной (от нуля до 8) и знаком (положительная, отрицательная) валентности. Ни у одного элемента валентность не может быть больше восьми, так как 8 — самое большее число электронов во внешней оболочке атома. Нулевая валентность свойственна не вступающим в реакции инертным газам; её мы приписываем также простым веществам до их вступления в реакцию, так как их атомы ещё не обмениваются электронами с атомами других элементов. У большинства элементов валентность может быть различной (высшая валентность всегда равна номеру группы, к которой принадлежит элемент). Такие случаи особенно часты у элементов 4—8 групп. Например, углерод образует окись СО, где его валентность 2, и двуокись СО2, где его валентность 4, а хлор может в зависимости от условий давать соединения с 8 различными валентностями (от —1 до +7).
Химическая активность. Нам уже известно, что атомы металлов отдают в реакциях свои электроны атомам неметаллов. Но одни металлы отдают электроны легче, чем другие. По способности отдавать электроны металлы располагаются в следующий ряд:
КАЛИЙ, НАТРИЙ, КАЛЬЦИЙ, МАГНИЙ, АЛЮМИНИЙ, ЦИНК,
ЖЕЛЕЗО, ОЛОВО, СВИНЕЦ, ВОДОРОД, МЕДЬ, РТУТЬ, СЕРЕБРО, ЗОЛОТО.
Наиболее активен в этом ряду калий, наименее — золото. Каждый металл вытесняет из соединений все остальные, стоящие справа от него, следовательно, он активней всех следующих за ним металлов. Так, например, железо активнее меди и вытесняет её из медных солей (см. опыт на стр. 12).
Водород, хотя и не является металлом, включён в этот ряд потому, что во многих реакциях ведёт себя подобно металлам. Некоторые металлы вытесняют водород из его соединений (кислот), но и он сам обладает такой же способностью по отношению к меди, ртути, серебру, золоту.
В свою очередь, атомы различных неметаллов неодинаково легко захватывают электроны. Например, в ряду Р, С1, Вг, ) (фтор, хлор, бром, иод) наиболее активен фтор, а наименее — иод.
Кислород —один из наиболее активных неметаллов. Это видно из того, что кислород входит в состав подавляющего числа веществ, встречающихся в природе.
Сведения об активности элементов также помогают нам решить, возможна ли та или иная химическая реакция.
Чем больше активность участвующих в реакции металлов и неметаллов, тем легче протекает реакция.
Как сокращённо записать химическую реакцию. Можем ли мы каким-либо способом изобразить, что происходит во время химической реакции? Конечно, можем. Ведь для этого и существуют символы элементов, обозначающие не только «сорта» атомов, но и количество вещества, заключённого в каждом из них (атомный вес). Периодическая таблица даёт нам сведения о валентности элементов, а валентность точно определяет, в каких соотношениях атомы различных элементов могут связываться друг С другом. КрОхМе того, мы должны помнить и о законе сохранения вещества. Он требует, чтобы вес всех взятых для реакции веществ равнялся весу всех образующихся продуктов. Всё это даёт нам возможность написать уравнение химической реакции.
Составляя уравнение реакции, нужно учесть, что все простые вещества, за исключением инертных газов, состоят из молекул, а не из отдельных, свободных атомов. Поэтому мы должны записать, например, реакцию водорода с хлором как реакцию между молекулами:
Н2 + С12 = 2НС1
1 молекула водорода 1 молекула хлора 2 молекулы хлористого
Еодорода
(2x1,СС8) (2X35,46) (2x36,468)
2,016 70,92 72,636
Так как кислород двухвалентен, а водород одновалентен, то при образовании воды одна молекула кислорода реагирует с двумя молекулами водорода. Эту реакцию можно записать так:
02 + 2Н2 = 2Н20.
Для описания реакции пишут уравнение, состоящее только из формул соединений. Но количество веществ, которые нужно взять для реакции, и ожидаемые количества продуктов реакции рассчитывают так, как мы это только что сделали на примере водорода и хлора — по составу молекул, атомным весам и валентности элементов. Такие расчёты реакции особенно важны в заводской практике: они позволяют правильно и экономно расходовать сырьё, облегчают контроль производства и управление самой реакцией.
*
С химической точки зрения мир представляет собой непрерывно действующую гигантскую лабораторию, в которой разрушаются одни вещества и возникают другие. С некоторыми веществами, окружающими нас, и химическими превращениями их мы и познакомимся в следующих разделах.
О оздух — это газообразная оболочка земли, та мате - риальная среда, в которой протекает жизнь животных и растений. Воздух необходим для всех живых организмов. Без пищи живой организм может существовать несколько недель, без воды — несколько дней, а без воздуха он не просуществует и нескольких МИНУТ.
|
До нагревания После нагревания — Рис. 6. Сжигание фосфора в воздухе. |
Из чего же состоит воздух? Почему он так необходим для живых организмов?
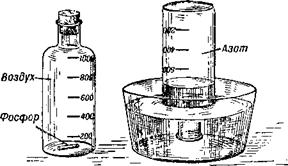
Многие тысячелетия воздух считался простым веществом. И только около 200 лет назад было доказано, что воздух — смесь газов и что только часть этой смеси поддерживает горение. Это устанавливается простым опытом (рис. 6). Поместим в стеклянный сосуд кусочек фосфора. Плотно закроем сосуд пробкой и подогреем его дно. Фосфор загорится. Когда горение закончится, опустим горлышко сосуда в воду и вытащим пробку. Вода немедленно устремится в сосуд и займёт около!/б его объёма. Очевидно, часть воздуха, находившегося в сосуде, была израсходована при горении фосфора, вступила в соединение с ним. Эта составная часть воздуха — кислород. Он поддерживает горение и дыхание.
Если внести в газ, оставшийся после сгорания фосфора, зажжённую лучинку, она погаснет. Если поместить в него муху или бабочку — они быстро погибнут от удушья. Это показывает, что в воздухе кроме кислорода есть газ, не поддерживающий горения и не пригодный для
Дыхания. Этот газ — азот. Древнегреческое слово «азот» и означает «безжизненный».
Кислород и азот — главные составные части воздуха.
Кроме того в воздухе есть очень небольшое количество — по объёму меньше одного процента — инертных газов: аргона, гелия, неона, криптона и ксенона.
Кислород, азот и инертные газы — это постоянные составные части воздуха. В каком бы месте вблизи поверхности Земли мы ни взяли воздух, по удалении из него переменных составных частей в нём всегда оказывается по объёму 20,91 процента кислорода, 78,15 процента азота и 0,94 процента инертных газов. Помимо них в воздухе всегда содержатся ещё и некоторые химические соединения. Из них наибольшее количество приходится на долю углекислоты и водяных паров. Содержание их в воздухе сильно меняется в зависимости от условий. Поэтому водяные пары и углекислоту называют перемен' ными составными частями воздуха.
При 20 градусах в одном кубическом метре воздуха содержится приблизительно 10—11 граммов воды. Воздух над морями и океанами обычно содержит больше водяных паров, чем воздух над материками. Количество углекислоты в чистом воздухе в среднем близко к 0,03 процента по объёму. Но в городах и промышленных центрах оно больше, потому что там сжигается много топлива.
В воздухе всегда содержится пыль — мельчайшие частички твёрдых веществ. Иногда к воздуху примешиваются некоторые газы, обычно не входящие в его состав. Например, вблизи металлургических или сернокислотных заводов в воздухе находится сернистый газ, в районах нефтепромыслов — нефтяные газы. Всё это — случайные составные части воздуха.
Значение составных частей воздуха для организма. По значению для живых организмов на первом месте из всех составных частей воздуха стоит кислород — он потребляется при дыхании. Кислород необходим для химических реакций, которые непрерывно протекают в организме и снабжают его жизненной энергией. В результате этих реакций образуются углекислота и вода. Это доказывает химический анализ вдыхаемого и выдыхаемого воздуха. В выдыхаемом воздухе количество кислорода уменьшается на 20 процентов, а количество углекислоты увеличивается почти в 140 раз. Ощущение духоты являет-* ся откликом организма на уменьшение в воздухе содержания кислорода и увеличение количества углекислоты.
Азот не используется при дыхании. Тем не менее его присутствие в воздухе необходимо для живых организмов. Составляя по объёму около 4/б воздуха, он р а з б а в - л я е т кислород и тем самым замедляет реакции, протекающие в чистом кислороде слишком энергично, служит «тормозом». Инертные газы, аргон и другие, играют ту же роль, что и азот. Но, конечно, их влияние очень мало, так как их в воздухе немного.
Хотя азот в обычных условиях химически инертен, некоторые бактерии способны его перерабатывать и усваивать. Такие бактерии поселяются на корнях бобовых растений (гороха, клевера и др.) и создают необходимые для их роста запасы азотистых соединений.
Воздух играет огромную роль и как переносчик и «распределитель» воды на земле. Благодаря большой подвижности воздуха испаряющаяся с поверхности морей, озёр и рек влага распределяется на громадные площади. При понижении температуры воздуха часть содержащейся в нём влаги сгущается, конденсируется в капельки. Так образуются роса, туман, облака. Вода из облаков вновь возвращается на землю в виде дождя или снега и пополняет запасы необходимой для растения влаги в почве.
Воздух — источник сырья для промышленности. Воздух — не только среда, необходимая для жизни растений и животных, но и материал, используемый промышленностью. В химической практике часто встречается необходимость «ввести» в молекулу того или иного вещества атом кислорода. Такие реакции называют окислением. Для многих из них достаточно уже действия кислорода, присутствующего в воздухе, например, при варке олифы, при получении уксуса из виноградного вина или при сжигании серы для получения серной кислоты.
Но во многих случаях действие воздуха оказывается недостаточным, необходим чистый кислород. Его и получают из воздуха. Для этого воздух сначала превращают в жидкость, пользуясь специальными машинами.
Жидкий воздух, испаряясь, меняет состав, становится всё богаче и богаче кислородом. Это происходит потому, что вначале улетучивается главным образом азот, имеющий более низкую температуру кипения (минус 196 градусов), чем кислород (минус 183 градуса). Когда температура жидкости достигнет минус 183 градусов, в ней остаются только кислород и инертные газы. Этот «технический» кислород перекачивают в стальные баллоны под давлением 150 атмосфер и в таком виде доставляют на производства, например, на химические и металлургические заводы.
Испаряющийся из жидкого воздуха азот собирают, сгущают в жидкость и вновь испаряют. Таким образом, он получается почти без примеси кислорода. Это — «технический» азот; его также перекачивают в стальные баллоны, в которых он хранится под давлением.
Жидкий воздух, а также жидкие кислород и азот применяются в технике для очень сильного охлаждения.
Кислород используется не только в химической промышленности. Большие количества его расходуются при автогенной сварке и резке металлов. Пламя, которое даёт при горении в воздухе водород или другой горючий газ — ацетилен, недостаточно горячо для того, чтобы быстро расплавлять металлы. Заменяя воздух чистым кислородом, получают настолько горячее пламя, что даже толстые слои металла разрезаются и «свариваются» очень быстро.
Азот воздуха—также очень важное сырьё. Его долго не умели использовать, так как при обычных условиях он не вступает в реакции ни с кислородом, ни с водородом. Промышленная переработка азота воздуха развилась только 25—30 лет назад, когда нашли способ заставить азот соединяться с водородом. Такая реакция происходит, если сжатую под давлением в несколько сот атмосфер смесь азота с водородом пропускать над некоторыми металлами, нагретыми до 400—550 градусов. Азот с водородом образуют газ аммиак, 1ЧНз. Аммиак очень легко реагирует с другими веществами. Окисляя аммиак, получают азотную кислоту. И аммиак, и азотная кислота используются для производства красителей, взрывчатых веществ, лекарственных препаратов. Теперь аммиак и азотная кислота получаются почти исключительно из азота воздуха.