Характеристики пор по изотермам адсорбции
|
А В С D Е |
|
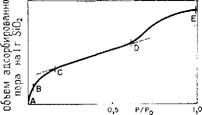
Рис. 5.7. Зависимость объема адсорбированного пара и заполнения пор жидкостью от парциального давления. (По данным Айлера [2], с разрешения Cornell University Press.) |
Синг [8] представил исключительно четкое и сжатое описание изотерм адсорбции и способов их интерпретации на основе распределения пор по размерам. Как показано на рис. 5.7,
Пары таких веществ, как азот или вода, адсорбируются в пористом силикагеле или в порошке во всевозрастающих количествах по мере увеличения относительного давления пара р/рр, где ро — давление насыщенного пара выбранной в качестве ад - сорбата жидкости.
Начинаясь с давления, равного нулю (точка А), типичная изотерма адсорбции содержит несколько ступеней. Прежде всего наблюдается, что с ростом давления возрастает доля поверхности, покрываемая адсорбируемыми молекулами (точка В). В определенной точке на кривой (вблизи С) поверхность пол
ностью покрывается одним слоем молекул. На этой стадии будут также заполняться адсорбатом поры, которые имеют диаметр только в два—три раза больше, чем диаметр молекулы адсорбируемого вещества. При более высоком значении относительного давления (точка D) начнут заполняться поры большего размера. Когда давление близко к давлению насыщения Ро (точка Е), то жидкость заполнит все поры, что дает возможность измерить объем пор. В начале предполагали, что диаметр пор мог быть подсчитан из уравнения Кельвина [138], полученного на основании теории, согласно которой жидкость остается в порах даже в том случае, когда давление пара оказывается ниже, чем давление жидкой фазы, так как давление пара жидкости в таких порах понижается из-за эффектов поверхностного натяжения в тонких капиллярах. Уравнение Кельвина [138] связывает давление пара р, при котором пар будет конденсироваться в цилиндрическом капилляре радиусом гк-
________ -2aV cos 0
Гк~~ RT -2,303 Igp/po
О — поверхностное натяжение жидкого азота при его температуре кипения (—195,8°С), равное 8,85 эрг/см2; 0 —угол смачивания, принимаемый равным нулю, так что cos 8=1; V — мольный объем жидкого азота, равный 34,7 см3; R — газовая постоянная, равная 8,314-107 эрг/(град-моль); Т — абсолютная температура, равная 77 К.
В случае азота уравнение Кельвина упрощается:
-- 4'146
Гк — lg/W/>
Где гк—-радиус капилляра, который заполняется при парциальном давлении pipe,. Однако это оказывается справедливым в основном только для капилляров сравнительно большого размера. Когда же диаметр капилляра приближается к молекулярным размерам, то необходимо принимать во внимание следующее: когда р/ро превышает 0,2—0,3, то даже плоская поверхность становится покрытой мономолекулярным слоем адсорбата. Например, при р/ро=0,93 образуется слой, равный по толщине четырем молекулам (14 А). Уравнение Кельвина указывает, таким образом, на дополнительное количество адсорбата, добавляемое к количеству, которое сконденсировалось на плоской поверхности при данном значении р/р0- Следовательно, если толщина адсорбированного слоя на плоской поверхности составляет t, то тогда радиус поры гР, которая заполняется при р/р0, будет равен rp^t + ru.
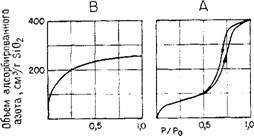
Как показано на рис. 5.8, А, если после полного заполнения снова понижать давление, то часто ход изотермы не совпадает с начальным вследствие того, что в этом случае требуется несколько более низкое давление, чтобы испарить жидкость. Подобная «гистерезисная петля» появляется потому, что в большинстве структур силикагелей в порах имеются полости, диаметр которых превышает размер прохода, ведущего к ним. Когда из такой поры удаляется жидкость, то давление будет определяться меньшим диаметром канала, ведущего к полости. Этот канал удерживает мениск жидкости, по мере того как опорожняется внутренняя полость большего размера.
|
Рис. 6.8. Типичный вид изотерм адсорбции азота. А — мезопористый силикагель с радиусом пор 36 А;; В — микропористый силикагель О С радиусом пор 10 А. (По данным Айлера [2], с разрешения Cornell University Press.) |
Совсем другая ситуация имеет место, если все поры оказываются очень небольшими по размеру, так что их диаметр превышает диаметр молекулы адсорбата всего лишь в несколько раз. Например, могут существовать поры диаметром 20 А, когда адсорбатом является азот, диаметр молекулы которого составляет 3,54 А. Как показано на рис. 5.8, В, в этом случае поры способны заполниться даже при низком давлении, и поэтому трудно определить точку на кривой, соответствующей заполнению монослоя.
Макбайн [139] ввел термин «персорбция», имея в виду адсорбцию в порах, диаметр которых равен лишь одному или двум диаметрам молекулы адсорбата. Не так давно поры, имеющие, как правило,, диаметр менее 20 А, стали называться «микропорами». В таких порах теплота адсорбции заметно выше, чем на плоских поверхностях, и эти поры могут оказаться заполненными при более низком давлении, чем то, которое соответствует образованию мономолекулярного слоя на плоской поверхности. Некоторые силикагели, несмотря на то что в них имеются поры большого размера, обладают еще и некоторым объемом, определяемым присутствием в образце очень малых пор [140]. Как постулировал Кармен [141], такие поры могут возникать в виде трещин между коллоидными частицами, составляющими гель. Шерешевский и Рассел [142] исследовали адсорбцию паров спирта на произвольно упакованных стеклянных шариках и наблюдали эффект капиллярной конденсации в щелевых зазорах около точек контакта шариков. Такая система по существу представляет собой крупномасштабную модель вероятной структуры некоторых разновидностей силикагелей, в частности тех, которые приготовляются высушиванием золей, содержащих однородные коллоидные частицы кремнезема. С другой стороны, подобные малые поры могут также иметь место в большом числе случаев, когда гели приготовляются из очень небольших, плотно упакованных частиц. Таким образом, плотно упакованные частицы диаметром 1-—2 нм неизбежно должны формировать гели, пронизанные порами почти молекулярных размеров.
Согласно данным Коулинха [143] и Брунауэра [144], можно подразделять силикагели на четыре группы в зависимости от радиуса пор:
1. Силикагели с порами молекулярных размеров (менее чем 2 нм в диаметре), проявляющие явление персорбции, но без капиллярной конденсации.
2. Силикагели с порами около 2 нм в диаметре, показывающие гистерезис для воды, но не для больших по размеру молекул и сильно выраженную капиллярную адсорбцию в интервале plpo 0,5—0,8.
3. Силикагели, обладающие порами диаметром 3—10 нм (микропоры) и проявляющие гистерезис для относительно больших по размеру молекул, а также капиллярную адсорбцию для них, но только при более высоких значениях р1р0.
4. Силикагели с порами, большими чем 10 нм в диаметре, которые показывают капиллярную адсорбцию только тогда, когда значение р/ро приближается к единице (аэрогели и пи - рогенные кремнеземы).
Беринг, Дубинин и Серпинский [145] классифицировали поры диаметром менее чем 3 нм как «микропоры», а поры диаметрами 3—200 нм как «переходные поры».
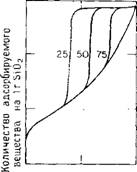
Если бы было возможным просверлить параллельные цилиндрические каналы в твердом кремнеземе, то тогда можно было бы приготовить серию образцов с каналами, отличающимися по размеру, но с постоянным значением объема пор в расчете на 1 г кремнезема. В таком случае изотермы адсорбции должны были бы проявляться в форме кривых, представленных на рис. 5.9. Поскольку для отдельного образца все поры имеют один и тот же размер, то все они должны заполниться одновременно, когда достигается некоторое характерное для данного образца давление пара. Кроме того, поскольку все поры однородны по размеру, то никакого гистерезиса не
|
О 0,5 1,0 Р/Ро |
Рис. 5.9. Гипотетический вид изотерм адсорбции азота.
Три пористых адсорбента имеют одинаковый удельный объем пор, причем однородные поры цилиндрической формы различаются по диаметрам, указанным в ангстремах.
|
|
|
О.0,4 0,8 0,4 0,8 |
|
0,4 0,8 0,4 0,8 Р/Ро |
|
0,4 0,8 0,4 0,8 |
|
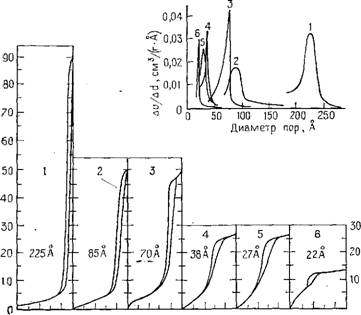
Рис. 5.10. Изотермы адсорбции воды на различных силикагелях и соответствующие кривые распределения пор по размерам (по данным Киселева [146]). |
17 Заказ М> 250
Должно наблюдаться. При наличии очень больших пор, фактически бесконечно большого размера по сравнению с размером молекулы воды, поры заполняются только при значении РІРо= 1.0.
Подобная идеализированная ситуация, конечно, фактически не имеет места в реальных силикагелях, поры в которых представляют собой неправильной формы пространства между беспорядочно расположенными первичными сферическими частицами кремнезема. В качестве примеров, связанных с применением на практике таких систем, на рис. 5.10 показаны изотермы адсорбции пара воды и соответствующие кривые распределения пор по размерам, рассматриваемые Киселевым [146] для серии силикагелей, каждый из которых имеет относительно однородные по размерам поры. Объемы пор оказались по существу одинаковыми для силикагелей 2 и 3 и для силикагелей 4 я 5, что подтверждается примерно одинаковым количеством воды, требуемой для заполнения пор. Таким образом, для силикагелей 2 и 3 это количество составляет 50 ммоль Н20 в расчете на 1 г кремнезема, что равно 0,9 см3 Н20/г ЭЮг. Площади под кривыми распределения пор по размерам для тех же двух образ- цов 2 и 3 примерно равны и также выражают значение, равное 0,9 см3/г. Эти изотермы характерны для типов силикагелей, приготовляемых стандартными способами.