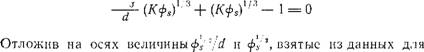Стабилизация путем образования ионных зарядов
Основным механизмом стабилизации коммерческих золей служит возникновение ионных зарядов на поверхности частиц в присутствии щелочи. Однако полностью удовлетворительной теории стабилизации золей до сих пор не создано. Основные принципы стабилизации посредством возникающего вокруг частиц двойного ионного слоя были развиты Дерягиным и Ландау [44] и Фервей и Овербеком [45]. Соответствующая теория получила название теории «ДЛФО», и она применима, в частности, к частицам сферической формы [46а]. Оттевил [466] представил превосходное обобщение всех сил, оказывающих воздействие на стабильность дисперсных систем.
Неппер [47] суммировал условия стабильности коллоидных систем, включая принципы и электростатической, и «стериче - ской» стабилизации. Фундаментальное изучение вандерваальсо - вых сил, возникающих между поверхностями аморфного кремнезема, было проведено Роулером [48]. Он измерил в условиях высокого вакуума силы притяжения между двумя поверхностями плавленого кремнезема, причем поверхности были покрыты тонкими пленками металлического хрома. Однако трудно перенести полученные им результаты на водные системы кремнезема. В обзоре Виссера [49] представлены константы Гамакера для многих коллоидных систем, включая систему Si02 — Н20.
Как указывал Китченер [50], по крайней мере при некоторых условиях, стабильность системы кремнеземных золей находится в полном противоречии с теорией «ДЛФО». Так, при рН 2, когда заряд на поверхности частиц кремнезема равен нулю, частицы агрегируют наименее быстро и такой золь имеет самую высокую стабильность во времени. Однако только в щелочном растворе, когда заряд частиц наиболее высок, золи оказываются постоянно устойчивыми. В последнем случае теория двойного слоя применима.
Матиевич [51] обсудил возможность применения теории «ДЛФО» к различным неорганическим золям. Для кремнеземных золей наиболее важным фактором является природа электролита. Процесс адсорбции и образования стабильных комплексов, на поверхности кремнезема настолько сильно влияет на катионы, что упомянутая теория в данном случае имеет небольшое практическое значение. К тем же самым выводам пришли авторы работы [52] в отношении коллоидной системы, содержащей частицы ТЮ2.
Максимальная концентрация золей. Наибольшую трудность представляет получение устойчивых высококонцентрированных золей кремнезема, в которых возникает необходимость с точки
зрения экономической выгоды при продаже и транспортировке. При этом никаких заметных изменений в свойствах золей не должно происходить, по крайней мере, в течение года при обычных условиях хранения.
Коммерческие золи, по-видимому, стабилизируют при оптимальных значениях рН и концентрируют до максимального содержания, насколько это допустимо при выбранных размерах
|
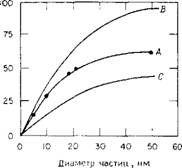
Рис. 4.1. Зависимость максимальной концентрации стабилизированных водных золей кремнезема от размера частиц при рН~9,5. |
|
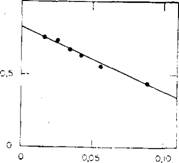
Рис. 4.2. Зависимость объемной доли 0s кремнезема от диаметра частиц Л, выраженного как <p]J3/d, при максимальной концентрации стабилизированных золей кремнезема. |
|
1,0 |
|
Л |
А — концентрация в массовых процентах; В — концентрация в граммах S1O2 на 100 мл; С — объемная доля Si02, (Х100).
Частиц. Похоже, что во всех случаях частицы концентрируются до тех пор, пока находящиеся вокруг них оболочки, образованные из обеспечивающих стабильность противоионов, не начнут частично перекрываться, так что при немного более высокой концентрации наблюдались бы как заметное повышение вязкости, так и длительная нестабильность системы, т. е. шел бы процесс гелеобразования.
Концентрации и размеры частиц типичных коммерческих золей выражены в виде кривой А на рис. 4.1. На основании плотности аморфного кремнезема, равной 2,2 г/мл, можно расчи - тать кривые Б и С, которые выражают соответственно концентрацию Si02 в граммах на 100 мл золя и объемную концентрацию твердого кремнезема в миллилитрах на 100 мл золя. Последняя, выражаемая в объемных процентах и поделенная на ЮО, дает так называемую «объемную долю» твердого кремнезема в суспензии fs.
Поскольку все коммерческие золи имеют приблизительно практически возможную максимальную концентрацию, плот
ность упаковки частиц золя с их оболочками из окружающих ионов, вероятно, во всех случаях примерно одинакова. Такая максимальная плотность упаковки пропорциональна объемной доле дисперсной фазы ф8, когда дисперсной фазой считается частица с ее ионной оболочкой и диаметр частицы равен d:
|
|
Где К — константа и d„ — толщина ионной оболочки или толщина двойного слоя Гуи, образуемого вокруг частицы. Приведение этого соотношения дает
|
2 d.
|
Кривой С (рис. 4.1.), получаем линейную зависимость, показанную на рис. 4.2. Из этого линейного графика получаем dg = = 2,43 нм и К= 1,68.
Для частиц больших размеров, когда толщина ионного слоя много меньше диаметра частицы d, получаем <f>s= 1/К = 0,6. Это показывает, что частицы в таких золях упакованы несколько более плотно, чем это имеет место при произвольной упаковке.
|
,0,5 |
Толщина da (в ангстремах) двойного слоя Гуи для данной системы зависит только от ионной силы і [53]:
Da = 3,05i
Поскольку в коммерческих золях величина da в среднем составляет около 24 А, то ионная сила, рассчитанная из данного уравнения имеет среднее значение примерно 0,016 н. для любых золей. Фактически в случае типичного стабилизированного золя с размером частиц 15 нм и содержанием ~500 г БіОг/л обычное значение силикатного отношения Si02: Na20 составляет около 100:1, а содержание Na20 равно 5 г/л или примерно 0,16 н. В подобных концентрированных золях большая часть ионов натрия должна находиться очень близко к поверхности (в так называемом слое Штерна), образуя концентрацию во внешнем двойном слое порядка 0,016 н.
В общем случае количество щелочи, необходимое для стабилизации системы, пропорционально площади поверхности кремнеземных частиц в золе. Это количество составляет приблизительно 1,0—1,5 молекул NaOH на 1 нм2 для большинства золей, в которых допускается содержание примесей солей около 10~2 н. Однако если подобный золь почти очищен от соли (содержание соли менее Ю-3 н.), то концентрация NaOH, необхо
димая для стабилизирования системы, может приближаться к теоретическому значению 0,016 н., а поверхностная концентрация при этом равняется 0,3 молекулы NaOH/нм2.