Получение из растворимых силикатов и минералов
Силикат натрия был и, вероятно, останется в будущем наиболее дешевым источником получения относительно чистой кремневой кислоты, из которой приготовляется силикагель. Однако некоторые природные коллоидные алюмосиликаты, включая определенные разновидности глин, могут под действием кислоты образовывать в виде конечного продукта пористый, гидратированный кремнезем, способный в некоторых случаях формироваться в гель [205]. Подобный исходный материал может стать наиболее важным, если такие глины будут одновременно служить и источником получения алюминия. Кроме того, определенные разновидности ортосиликатных минералов, легко поддающиеся обработке кислотой, могут оказаться выгодными при получении силикагелей. Например, Фле - ниген и Гроус [206] нашли, что высокопористые силикагели с удельной поверхностью 600—900 м2/г и очень тонкими порами могут быть приготовлены из волокнистого силиката кальция— волластонита путем растворения минерала в кислоте с последующим гелеобразованием в кислом растворе.
Мюрата и Шлехт [207] обобщили действие кислот на различные силикатные минералы в виде следующих положений. Те силикаты, которые содержат силикатные радикалы с низкой молекулярной массой или же имеют непрерывные кремнекисло - родные каркасы, в которые включено достаточное число атомов железа или алюминия (удаляемых кислотами), образуют студенистые кремнеземы. С другой стороны, минералы, имеющие силоксановые структуры большой протяженности, такие, например, как цепочки Si03, двойные цепочки Si4Ou и листочки Si205, оказываются не способными застудневать, но дают нерастворимые кремнеземные псевдоморфозы. Согласно данным Брунауэра [208] для глаукосила, т. е. кремнезема, выде-' ленного из глауконита и имевшего структуру, подобную листочкам слюды, значение удельной поверхности было равно 82 м2/г. Если в структурах алюмосиликатов содержится более чем дЙа атома алюминия на каждые три атома кремния, то, по данным Мюрата и Шлехта [207], при действии кислоты каркасная
Сетка разрушается во многих местах с образованием «островков», состоящих из силоксановых фрагментов, из которых получаются студенистые кремнеземы.
Патрик и Мак-Гавак [209] исследовали силикагели с точки зрения их важного практического применения в качестве адсорбентов. Прочно связанные силикагели, которые можно было нагревать до красного каления без разрушения или потери адсорбционной способности, производились посредством смешивания довольно крепких растворов, содержащих силикат натрия с отношением Si02: Na20 3,3: 1 и избыточное количество соляной кислоты, что позволяло формировать гель, который затем промывали и медленно высушивали. За период с 1920 по 1950 г., как указывал в своей монографии Вайл [199], было разработано большое число способов подкисления и гелеобразования растворов, получаемых из растворимых силикатов, повышения механической прочности силикагелей, снижения усадки и увеличения их пористости. Процесс медленного высушивания является существенным для предотвращения раздробления кусочков геля, возникающего из-за более сильной усадки наружных слоев в таком материале. Высокая концентрация кремнезема (вплоть до 15 г на 100 мл) в застудневающих растворах дает возможность получать плотные и механически прочные силикагели. Волф и Бейер [210] в своем обзоре рассмотрели взаимосвязь между условиями приготовления силикагеля из кислоты и силиката и свойствами конечного продукта. Основное положение заключается в том, что при промывании горячей водой увеличивается размер первичных частиц и понижается удельная поверхность. Выдерживание при рН >7 приводит к аналогичному эффекту. Если вода в гидрогеле замещается органической жидкостью, имеющей более низкое поверхностное натяжение, то формируемый сили - кагель будет давать меньшую усадку при высушивании, сохраняя большие по размеру поры.
Обычно при промышленном производстве наиболее часто используются кислоты H2SO4, НС1 и С02 в указанной последовательности с точки зрения масштабов их применения. Для того чтобы получить наиболее твердые и прочные силикагели, гель, как правило, формируют при низких значениях рН и при комнатной или даже более низкой температуре. Это позволяет сохранить очень малый размер первичных частиц, что способствует увеличению пористости и распределения частиц по размерам. В результате последующих обработок силикагель приобретает прочность.
* Чтобы изготовить силикагель максимальной прочности, силикат на начальной стадии разбавляют до возможно меньшей степени при смешивании с кислотой; в этом случае гелеобра - зование протекает очень быстро. Например, золь кремнезема, содержащий 13—17 % Si02, приготовлялся путем смешивания потоков раствора силиката натрия и кислоты при таких соотношениях, когда достигалось рН 6—10,5. При смешивании продукт разбрызгивался, и капельки застудневали менее чем за секунду, находясь в виде суспензии в воздушной среде, а затем падали в воду для дальнейшего процесса старения [211].
Непрерывно разрабатываются новые рецепты для частных разновидностей силикагелей. Например, Виньял и Аккер [215] получили широкопористый силикагель с удельной поверхностью менее чем 320 м2/г и объемом пор 1 см3/г путем приготовления гидрогеля из кислоты и силиката, смешанных в такой пропорции, чтобы получить значение рН 9,8—10,4. Такой гель подвергали старению в течение 50 мин, затем подкисляли до рН 2—3, выдерживали до 5 ч, после чего опять подвергали старению продолжительностью до 4 ч при рН 8, промывали и высушивали. Высокое значение рН позволяло первичным частицам расти и коалесцировать, формируя желаемую структуру, после чего была необходима кислотная обработка с целью удаления, окклюдированных ионов натрия. Вероятно, при удалении таких ионов в образце остаются микропоры, которые закрываются в процессе старения при рН 8. Множество аналогичных способов приготовления силикагелей, кажущихся довольно произвольными и сложными, можно объяснить на основе теперь уже известной химии такой системы.
При другом подходе следует использовать соединение, которое медленно выделяет кислоту. Долго применяли такое соединение, как Na2SiF6, по определенным рецептам. Однако способные диспергировать в воде альдегиды, амиды и сложные эфиры также нашли применение для специальных целей. Концентрированный 30 %-ный раствор глиоксаля (6,5 ч.) смешивали с концентрированным (36°В.) раствором силиката натрия (100 ч.), при этом протекала реакция, и после выдерживания в течение суток вещество образовывало чрезвычайно твердый гель, который промывали 4 н. раствором H2S04 и водой и высушивали. Реактив, который оказывал замедляющее нейтрализующее действие, равномерно смешивался с силикатом с тем, чтобы кремнезем полимеризовался при очень высокой концентрации и окончательно получался очень прочный гель [212]. Аналогично когда необходимо было сформировать очень прочный силикагель, например, в порах бетона для придания ему водонепроницаемых свойств, то сложные эфиры, такие, как глицерин или гликолевые ацетаты, смешивали с концентрированным силикатным раствором непосредственно перед использованием, с тем чтобы такой раствор в течение двух часов превратился в гель непосредственно в том месте, куда он был помещен [213]. Смесь Н202 и парафор - мальдегида, добавляемая к раствору силиката натрия, превращает его в пену, после отвердения образующую легкую, обладающую изоляционными свойствами структуру силика - геля [214].
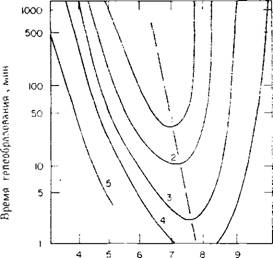
Скорость гелеобразования. Вот уже в течение многих лет изучается продолжительность времени, требующегося для превращения в гель определенного типа золя кремневой кислоты, который приготовлялся из кислоты и силиката. Принимается, что время гелеобразования обратно пропорционально скорости полимеризации или скорости формирования геля. В серии статей Хард и соавторы [216а] сообщили фактически обо всех факторах, оказывающих влияние на время гелеобразования золей кремневой кислоты, приготовляемых из кислоты и силиката натрия с отношением Si02: Na20 3.3:1. Необходимо также сослаться на исследование Сена и Гоша [2166], которые, применяя разные кислоты, вывели уравнения, связывающие время гелеобразования с рН, концентрацией и температурой. Как сообщалось в гл. 3, время гелеобразования достигает максимума при значении рН ~2. В области рН 3—5 время гелеобразования изменяется в прямой зависимости от концентрации ионов Н+ (или в обратной зависимости от концентрации ионов ОН~). В интервале рН 4—9, как показано на рис. 5.16, минимум продолжительности времени гелеобразования наблюдается вблизи области нейтральности. Эти данные основаны главным образом на результатах Меррилла и Спенсера [217]. Ниже будет отмечено, что концентрация ионов натрия, пропорциональная концентрации кремнезема, обеспечивает наиболее быструю скорость процесса гелеобразования при рН 7—8, тогда как в отсутствие солей коллоидный кремнезем превращается в гель наиболее быстро при рН 5—6 (см. гл. 4). Различные кислоты вызывают наибольшую скорость гелеобразования при немного различающихся значениях рН.
Хилд, Коатес и Эдварде [218] нашли, что дальнейшее добавление солей ускоряет гелеобразование при рН 7—8, причем очень эффективными являются ионы кальция.
При определенной концентрации кремнезема золи кремневой кислоты, приготовленные из силикатов натрия с более высокими отношениями Si02:Na20, испытывают более медленное гелеобразование, вероятно, вследствие более низкой концентрации ионов натрия.
Авторы работы [219] представили обзор, в котором рассмотрели возможные воздействия одновалентных электролитов на время гелеобразования. Они сообщили результаты иссле
дования золей кремневой кислоты при рН 2,7, когда действие соли менее заметно, тогда как большая часть предыдущих работ была проведена при более высоких значениях рН. Способность катионов ускорять гелеобразование повышается в ряду Li+, Na+ и К+, а анионов — в ряду NOT, С1~, Вг~ и I-. По необъяснимой причине ионы I - действуют в пять раз эффективнее, чем ионы NO;T. Подобные воздействия ионов прямо пропорциональны концентрации соли, и не имелось доказательств о возможной «критической концентрации коагуляции».
|
Рис. 5.16. Зависимость времени гелеобразования для золей, приготовленных из силиката натрия с отношением 3,25 Si02 : Na20 и H2S04 при 25 °С, от рН. Концентрации кремнезема: 1 — 1 %; 2—1,5%; 3 — 2,5%; 4 — 3,5%; 5 — 6,0%. (Данные для кривых 1—4 взяты из работы Меррила и Спенсера £217]; кривая 5— неопубликованные Результаты Айлера.) |
|
Рн |
Айлер исследовал ранние стадии полимеризации - и формирования геля при рН 1,7 и отношении Si02:Na20 3,3:1. Он показал, что скорость полимеризации и время гелеобразования были обратно пропорциональны квадрату концентрации кремнезема. Высоцкий и Стражеско [221] провели аналогичные тщательные измерения для такого типа золей кремневой кислоты при концентрациях Si02 1—2 % в пределах значений рН 0—4 и точно так же нашли острый максимум времени гелеобразования при рН 1,7, что также точно соответствовало обратной зависимости от квадрата концентрации кремнезема. Иногда оказывается удобным приготовлять золь, время геле-
образования которого было бы воспроизводимым. Время гелеобразования оказывается менее всего чувствительным к кислотности среды при данном значении рН, когда время гелеобразования минимально (см. ниже). Значения рН, отвечающие минимуму времени гелеобразования, изменяются в зависимости от концентрации кремнезема. Ниже приведенные данные относятся к золям, приготовленным при 25°С посредством добавления одного объема силиката натрия с отношением 3,25 к одному объему интенсивно перемешиваемой разбавленной кислоты H2S04 такой крепости, чтобы рН изменилось до 2. Таким образом, для получения 2 °/о-ного золя Si02 силикатный раствор должен содержать 4 % Si02. Затем рН повышалось до конечного значения путем очень осторожного добавления 1 и. раствора NaOH при интенсивном перемешивании. Были получены следующие результаты:
|
, Si02 |
РН |
Минимальное время гелеобразования, мин |
|
0,5 |
6,9 |
260 |
|
1,0 |
7,3 |
53 |
|
1,5 |
7,7 |
10,5 |
|
2,0 |
8,05 |
3,3 |
|
3,0 |
8,35 |
0,5 |
|
4 0 |
8,7 |
0,15 |
Такая точка гелеобразования не указывает на завершенность формирования структуры геля. Относительно данной точки можно сказать лишь то, что это точка, где происходит образование растущих областей твердых микрогелей, которые суспендированы в золе, достигая 50 % от всего объема, вследствие чего вязкость резко повышается (см. обсуждение механизма гелеобразования в гл. 3). Оставшиеся области золя еще продолжают затвердевать, и это имеет место по крайней мере в течение такого времени, которое соответствует периоду гелеобразования. В этот период гель начинает сжиматься по мере того, как сетка дает усадку и выделяет воду. Продолжительность синерезиса в несколько раз превышает время гелеобразования. Высоцкий и Стражеско [221] показали, что такой же процесс агрегации частиц продолжается во время синерезиса, как и в процессе гелеобразования. Это доказывает, что рН влияет на скорость синерезиса точно так же, как и на скорость гелеобразования, и такое воздействие минимально при рН 1,7.