Однозарядные катионы как агенты, формирующие мостиковую связь
Айлер предложил несколько отличающуюся гипотезу, в которой утверждается, что во всех случаях флокуляция обусловливается связыванием частиц между собой посредством катионов, но при значениях рН выше 11 большие по своему размеру ионы калия, рубидия и цезия при высоких концентрациях образуют вокруг каждой частицы полный двойной слой достаточной толщины, способный вызывать диспергирование частиц и предотвращать их агрегацию. Золи, стабилизированные избыточным количеством ионов тетраметиламмония, имеющих еще больший размер, могут даже высушиваться до порошкообразного состояния без флокуляции [63].
Теория двойного электрического слоя не была использована для объяснения рассматриваемого ниже явления, когда адсорбированные катионы способной вызывать коагуляцию простой соли могут оказаться «фактором образования мостиковой связи» при коагуляции кремнезема аналогично частично большим по своим размерам изополикатионам, таким, например, как катионы основных солей железа или алюминия. Если происходит формирование мостиковой связи, то количество (в расчете на единицу поверхности кремнезема) адсорбированных или «способных вступать в ионный обмен» катионов, вызывающих флокуляцию, должно уменьшаться с возрастанием размеров частиц. Не существует очевидного* способа подтверждения того, что в процессе флокуляции подобные адсорбированные катионы будут концентрироваться вблизи мест контакта частиц между собой, как это следовало бы ожидать, если бы катионы образовывали мостиковые связи.
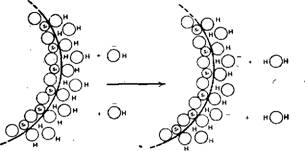
Если катионы натрия действуют как ионы, формирующие мостиковую связь, то следует принимать во внимание их способность к гидратации. В водном растворе ион натрия в результате гидратации окружается шестью атомами кислорода, принадлежащих молекулам воды. Это подтверждается тем, что при адсорбции иона натрия на поверхности кремнеземной частицы один или несколько атомов кислорода молекул гидрат - ной воды могут замещаться атомами кислорода, принадлежащими поверхностным силанольным группам SiOH, так что последние оказываются непосредственно связанными с атомом натрия. Следовательно, положительный заряд иона натрия способен нейтрализовать отрицательный заряд адсорбированного вблизи него гидроксил-иона, который как раз определяет поверхностный заряд частицы. В результате на поверхности образуется нейтральный адсорбционный комплекс. Если это так, то при высоких концентрациях ионов натрия (выше точки «критической концентрации коагулянта») ничто не препятствует замещению одной или более молекул воды, которые до тех пор были связаны с ионом натрия с внешней стороны, а не у поверхности кремнеземной частицы, на поверхностные силаноль - ные группы, принадлежащие второй вступающей в столкновение частицы (рис. 4.17а, а, б, в). Таким образом, ион натрия может
|
|
|
Рис. 4.17а. Схема образования связи между частицами кремнезема посредством координации вызывающими флокуляцию катионами металла. |
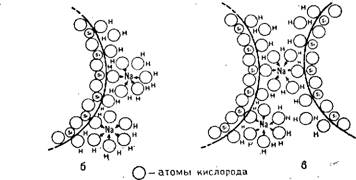
А ~ гидроксил-ионы передают отрицательные заряды слою молекул воды, связанных водородной связью с силанольными группами, находящимися иа поверхности частицы кремнезема; такой процесс эквивалентен адсорбции гидроксил-ионов на поверхности; б — гидратированные ионы натрия адсорбируются иа отрицательно заряженных участках поверхности, образуя нейтральные комплексы; в — при столкновении с незаряженными участками поверхности второй частицы ион натрия координирует кислородные атомы силанольных групп и кислородные атомы молекул воды, связанных с поверхностью, образуя координационную связь между частицами. Размер коллоидных частиц кремнезема; по отношению к размерам атомов на самом деле гораздо больше, чем это показано иа рисунке, поэтому между двумя частицами может сформироваться целый ряд мостиковых связей, образующихся посредством иона натрия.
Действовать как мостиковая связь между двумя частицами кремнезема.
Если такая теория корректна, то коагулят может формироваться, как только на поверхности каждой частицы кремнезема будет находиться достаточное число ионов натрия или других катионов, координационно связанных с атомами кислорода, способными к ионному обмену, вследствие чего каждая частица кремнезема обеспечивается возможностью контактировать с другими частицами более чем в двух точках. Контакт в двух точках допускал бы формирование из частиц только лишь
7 Заказ № 250 цепочек, но не агрегатов. С возрастанием числа ионов натрия на поверхности каждая частица могла бы соприкасаться с окружающими ее другими частицами в трех и более (вплоть до шести) точках, что приводило бы к образованию агрегатов со все возрастающей плотностью.
Необходимо также иметь в виду, что выше рН 8,5—9,0 в растворе образуются силикат-ионы, сопровождаемые своими катионами, которые также должны учитываться, как если бы они были добавляемой к системе солью или другим электролитом. Этот вопрос обсуждался Алленом и Матиевичем [249].
Как отметили Депассе и Уотиллон [242], при рН >11 только Na+ и Li+ будут продолжать образовывать мостиковые связи; большие по размеру ионы К+, Rb+ и Cs+- не ведут себя подобным образом. По-видимому, в последнем случае частицы кремнезема полностью покрываются слоем таких адсорбированных катионов, снимающих в свою очередь соответствующие отрицательные заряды на кремнеземной поверхности.
Депассе и Уорлус [253] сообщили, что при рН 7,5 ионы тетраметиламмония оказываются сильными коагулирующими агентами по сравнению с ионами гуанидина, аммония и натрия. Соответствующие значения точек к. к. к. оказались равными для этих ионов примерно 0,01, 0,32, 1,0 и 2,2 М. Ион (CH3)4N+ адсорбируется сильно и поэтому вызывает процесс коагуляции уже при малых концентрациях, но свободное основание может при рН 9—10 воздействовать как стабилизирующий агент, поскольку монослой адсорбированных катионов обеспечивает появление «стерической» стабилизации [205]. Тот факт, что ион натрия может быть координированным с должным образом расположенными в пространстве атомами кислорода в дикето - нах, тогда как большие по размеру ионы не могут координировать подобным образом, отмечал в своей работе Гарнер [254]. Он высказал предположение, что наблюдаемое между ионами натрия и калия различие в способности адсорбироваться на поверхности кремнезема могло быть обусловлено присутствием поверхностных углублений, в которые способны проникать ионы натрия, но не калия.
Айлер измерил коагуляцию коммерческих стабилизированных щелочью золей кремнезема, имевших различные по размеру частицы, при действии на них ионов Na+. Частицы кремнезема были непористыми. За развитием процесса агрегации наблюдали следующим образом. Исследуемые образцы центрифугировали при скоростях вращения, достаточных только, чтобы вызвать отделение дискретных частиц размером примерно 1 мм. Затем измеряли количество кремнезема в агрегированной форме, седиментированного из слоя золя толщиной 7,5 см. Полученные данные находились в соответствии с величиной, выраженной процентом еветопропуекания при длине волны 400 нм и определенных условиях опыта. Частицы размером 8, 15 и 25 нм в 0,24 и 0,30 н. растворах Na2S04 при концентрации 12 % Si02 агрегировали соответственно при 25, 40 и 55°С. Значение рН составляло ~9. Температурный коэффициент флокуляции оказался гораздо более низким в интервале 25—40°С по сравнению с интервалом 40—55°С. Соответствующие подсчитанные значения энергий активации составляли 4,7 и 10,6 ккал/моль. Во всех изученных случаях частицы меньшего размера проявляли повышенную чувствительность к изменениям в концентрации электролита и к температурным изменениям, чем большие. При равных концентрациях кремнезема и температуре 55°С скорость агрегации была прямо пропорциональна величине площади поверхности в единице объема золя и, следовательно, обратно пропорциональна диаметру частиц.
В общем случае золи с обычными размерами частиц (5— 25 нм) не могут подвергаться какой-либо обработке без того, чтобы не вызвать ту или иную степень агрегации, если только концентрация соли натрия не превосходит некоторого определенного уровня. По этой причине концентрация кремнезема, необходимая для получения дискретных частиц путем нейтрализации раствора силиката натрия с отношением Si02: Na20 3,25 в горячем состоянии до значения рН 9, не может быть более чем 1—2%. Айлер [101] дает эмпирическую формулу, связывающую максимальное значение нормальности ионов натрия N с концентрацией кремнезема С, выраженной числом граммов Si02 в 100 мл,, и с температурой Т (в градусах Цельсия), по которой можно вычислять необходимую для практических процессов нормальность, когда агрегация частиц не происходит по крайней мере в течение нескольких часов: N = 0,26 - 0,005С - 0,0012 (Т - 40)