Ионный заряд на поверхности частиц
Ионизация силанольных групп на поверхности раздела кремнезем—вода рассматривалась, в гл. З в связи с процессом полимеризации кремнезема. Изоэлектрическая точка и точка нулевого заряда кремнезема располагаются при рН ~2. Скорость конденсации силанольных групп SiOH, приводящей к образованию силоксановых связей Si—О—Si, как и скорость обратной реакции гидролиза, будет наименьшей при этом значении рН, так как в обеих реакциях участвует ион =Si~: ==SiO~ + HOSi= = ==SiOSi= + он-
' Таким образом, несмотря на то что при рН 2 частицы крем - гнезема несут на поверхности лишь очень небольшой заряд или же он вообще отсутствует, вследствие чего частицы могут сталкиваться, образование связей Si—О—Si между частицами „и формирование геля происходят медленно.
Однако только при значениях рН выше ~7, т. е. когда на поверхности частиц образуется достаточно высокая концентрация отрицательных зарядов, способных вызывать взаимное отталкивание частиц, система стабилизируется настолько, что гелеобразование не будет происходить. При промежуточных значениях рН гелеобразование протекает наиболее быстро.
Природа ионного заряда
Как будет обсуждено ниже в гл. 6, отрицательный заряд на поверхности аморфного кремнезема может быть интерпретирован несколькими способами. Одна из точек зрения заключается в том, что структура кремнезема представляется достаточно открытой, и гидроксил-ион способен занимать некоторый участок на поверхности. Поэтому координационное число каждого соседнего с гидроксил-ионом атома кремния повышается на некоторую дробную величину (см. рис. 1.11). Другая трактовка предусматривает возможность ионизации поверхностных силанольных групп:
=SiOH = =SiO" + H+
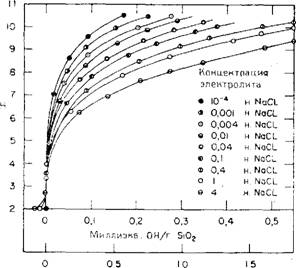
Помимо исследований, упоминаемых в гл. З в связи с ионизацией моно - и поликремневых кислот, имеется гораздо больше данных, относящихся к золям и гелям. Брайент [183] изучал влияние размера частиц и концентрации электролита на кривую кислотно-основного титрования золей кремнезема и интерпретировал полученные данные в понятиях теории полимерных электролитов, принимая во внимание преимущественную адсорбцию катионов, а также тот факт, что при высоких значениях рН кремнеземные частицы растворяются с образованием силикатов. В области рН 3,5—10,5 гидроксил-ионы адсорбируются на поверхности кремнезема, как показано Болтом [184], в количествах, возрастающих с увеличением рН (рис. 4.10). Концентрация анионных зарядов может выражаться^ как число миллиэквивалентов основания, приходящихся,, на 1 м2 площади поверхности, или как число гидроксил-ионов, или зарядов, в расчете на 1 нм2. Болт использовал в своих измерениях коммерческий золь кремнезема с диаметром частиц 15 нм, имеющий удельную поверхность 180 м2/г. Автор нашел, что одинаковые значения заряда на поверхности наблюдаются при концентрациях золя 3—30 % Si02. Хестон, Айлер и Сире [185] показали, что при данном значении рН число зарядов, приходящихся на единицу поверхности кремнезема, не зависит от размера частиц. Фундаментальные исследования ионных зарядов на поверхности раздела вода—оксиды металлов и вода— кремнезем были выполнены Грэмом [186], ГІеррамом [187], Парксом [188], Алленом, Матиевичем и Местесом [189], Тед - росом и Ликлема [190], Йетсом и Хили [191] и другими. Высоцкий и Стражеско [192] обратили особое внимание на природу катионообмена или заряженных мест на поверхности. Иетс, Левин и. Хили [193] представили модель связанных между собой участков на поверхности раздела вода—оксид 5* металла, на основании которой следует, что адсорбированные противоионы образуют на поверхности ионные пары с раздельно расположенными заряженными поверхностными группами. Они также обсудили вопрос об аномальных значениях констант диссоциации групп SiOH.
|
Число ионов ОН"на 1 нмг Рис. 4.10. Зависимость плотности заряда, выражаемой числом ионов ОН-, находящихся на поверхности частиц коллоидного кремнезема с удельной поверхностью 180 м2/г, от рН и различных концентраций хлорида иатрия (по Данным Болта [184]). |
Согласно данным Йетса и Хили [191], кремнезем представляет исключение среди других коллоидов в отношении зависимости поверхностного заряда от рН и общей величины емкости двойного электрического слоя. Указанные факторы оказываются гораздо более высокими для кремнезема по сравнению с другими коллоидными системами, для которых была развита приемлемая теория, основанная на уравнении Нернста. Перрам [187] предположил, что при высушивании поверхность такого кремнезема покрывается слоем геля, обладающего микропорами, доступными для ионов, но не для азота или каких-либо других молекул. Йетс и Хили на основании. своих исследований по осаждению кремнезема (типа BDH) пришли к аналогичным выводам. Они также внесли коррективы в кривые потенциометрического титрования при рН >9 с учетом ионизации растворимого кремнезема. Подобные исследования были также выполнены Тедросом и Ликлема [190], которые пришли к заключению, что отрицательно заряженные группы и катионы должны проникать внутрь таких пор «слоя геля», но степень их проникновения зависит от размера катиона.
Как уже выше обсуждалось, частицы коллоидного кремнезема, приготовленные разными способами, имеют различную степень микропористости. Вследствие этого не удивительно, что кремнезем, обладающий микропористостью, ведет себя совершенно иначе, чем непористые частицы других неорганических коллоидных систем, в особенности частицы с кристаллическими поверхностями. Различные свойства следует измерять на гладких непористых поверхностях, чтобы обеспечить получение воспроизводимых данных, о которых можно говорить как о характерных для «поверхности аморфного кремнезема».
Как было показано также Иетсом и Хили, в том случае, когда предпринимались попытки получить непористые частицы кремнезема нагреванием образца до 800°С, значительная часть поверхности дегидроксилировалась до образования силоксановых групп. При регидроксилировании такой поверхности не было получено никаких данных, свидетельствовавших о повторном формировании слоя геля. Однако на поверхности термообра - ботанного кремнезема, а также на частицах пирогенного кремнезема после гидратации образцов плотность поверхностных зарядов по отношению к величине рН оказывается все еще гораздо выше, чем это наблюдается, скажем, в таком классическом примере, как поверхность раздела Agl — раствор. Отсюда можно заключить, что заряженные ионы в состоянии проникать до некоторой степени даже в «непористую» поверхность аморфного кремнезема.
Высказывалось предположение (см. [8]), что поверхность кремнезема заряжается за счет гидроксил-ионов, образовавшихся в результате потери протонов теми молекулами воды, которые располагаются на участке между атомами кислорода в структуре Si02 (см. рис. 1.11). Таким образом, отрицательный заряд должен лежать внутри у самой поверхности. Если эта поверхность напоминает поверхность тридимита, что кажется вподае возможным, поскольку ее структура в таком случае находится в соответствии с величиной поверхностной концентрации, равной 4,6 SiOH групп на 1 нм2, то тогда наблюдается ослабление заряда на поверхности в результате возможного близкого расположения катионов к противоположно заряженным ионам.
Как отмечают Тедрос и Ликлема, малые по размеру однозарядные ионы, подобные Na+, могут наиболее легко следовать за отрицательными зарядами в глубь поверхности. По их мнению, большие по размеру катионы (СН3)4М+ при заданном значении рН способствуют образованию гораздо меньшего поверхностного заряда. К такому же заключению пришел Айлер • [169], который показал, что специфическое коагулирующее действие ионов кальция отличается от поведения ионов натрия из-за большего расстояния, на которое удалены ионы кальция от внешнего силанольного слоя по сравнению с ионами натрия. Подобный геометрический фактор приводит к предпочтительной коагуляции больших по размеру коллоидных частиц кремнезема в присутствии меньших частиц. Этого не происходит в случае ионов натрия.
Характерная особенность аморфного кремнезема, возможно, состоит в, том, что отрицательный заряд на поверхности раздела твердое тело—вода может образовываться скорее отчасти внутри у поверхности, чем на такой поверхности, и поэтому относительно большие количества кремнезема и меньшие воды учитываются в экспериментально определяемом среднем значении диэлектрической проницаемости.
Так как настоящая глава относится главным образом к цас - смотрению частиц коллоидного кремнезема, которые приготовляются по способам, предназначенным для формирования плотных непористых частиц, то интересно сравнить плотность поверхностного заряда, получаемую при заданных условиях, с плотностью заряда на изученных кремнеземных порошках. В табл. 4.1 представлены условия опытов, одним из которых является 0,1 н. концентрация электролитов NaCl, КС1 или KNO3, дающих однозарядные ионы при рН 9,0.
|
Таблица 4.1 Сравнение величины плотности заряда на поверхности кремнезема прн фиксированных условиях н рН 9
|
|
А Присутствуют только противоионы, нет никаких других небольших по размеру анионов, кроме HSiO ~ . Данные в незначительной степени экстраполированы, в 1 мкКл/см8—0,0628 заряд/нм2. |
Результаты, полученные Болтом [184] (см. рис. 4.10), а также Хестоиом, Айлером и Сирсом [185], на непористых частицах кремнезема сравниваются с результатами Йетса и Хили, полученными на осажденном кремнеземе (BDH), пористом до тех пор, пока его термически не обработают при высокой температуре. Вполне очевидно, что порядок величины плотности поверхностного заряда на частицах золя будет тем же самым, что и на осажденном порошке после его термообработки. Частицы золя никогда не нагревались выше 100°С и тем не менее оказывались плотными, поскольку были приготовлены путем медленного осаждения молекулярного кремнезема. Если же частицы формируются иным путем, то они получаются пористыми, что проявляется в более высоком значении плотности заряда. Однако кажется, что даже рассматриваемые частицы золя еще не в такой степени плотные, как частицы, прошедшие термообработку до 800°С. Это доказывается несколько более высокой плотностью заряда, равной в первом случае 0,63—0,68, по сравнению с величиной 0,55 для термо - обработанных частиц кремнезема (см. табл. 4.1).