Полное и неполное горение
При полном горении топлива в конечном результате соединения горючих элементов топлива с кислородом создаются только продукты полного горения и выделяется вся химическая энергия
топлива. Дымовые газы при этом состоят из углекислоты СОг, сернистого ангидрида БОг, водяного пара Н20, азота N2, поступившего в топку как составной элемент воздуха, а также избы - точного кислорода О2, не вступившего в химическую реакцию с топливом.
По содержанию избыточного кислорода Ог в дымовых газах можно судить о величине коэффициента избытка воздуха.
Таким образом, при полном горении объем дымовых газов состоит из суммы:
С02 302 Н20 N3 -)~ Оа =100%
Или
И02 “1“ Н20 “1~ N3 —02 = 100%, где К02 выражает сумму:
И02=С02 302%.
При неполном горении в дымовых газах, наряду с перечисленными газами, могут присутствовать: окись углерода СО, водород Н2, метан СН4 и другие недогоревшие газы.
Таким образом, при неполном горении состав продуктов сгорания будет:
С02 + Э02 + СО + П2 -Ь СН4 + 2СтН„ +
— Н20 —1~ N 2 —}— 02 100 %,
Где: С02, 502,С0, Н20, N2, 02 и т. д.— попрежнему содержание в дымовых газах отдельных газов в проценте по объему.
При химической неполноте горения создаются потери тепла, а следовательно, и топлива, обусловленные неполным выделением химической энергии топлива.
Объем дымовых газов (Уг) слагается из объема водяных паров (Ув. п) и объема сухих газов (Ус. <*), к которым относятся к02, СО, N2, 02 и другие.
По содержанию КО2 и 02 в сухих газах можно судить о степени совершенства процесса горения, а также подсчитать коэф
Фициент избытка воздуха и объем сухих газов.
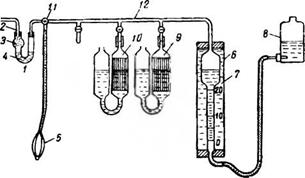
Анализ дымовых газов может быть осуществлен при помощи ручного химического газоанализатора (рис. 4) в описанном ниже порядке.
Заборную трубку для отбора пробы газа герметически соединяют резиновым шлангом с газоходом котла. При помощи резиновой груши 5, снабженной клапаном для выпуска газа, продувают заборную трубку и фильтр. Затем нужно опустить склянку 8 при открытом трехходовом кране 11 и заполнить дымовыми газами измерительную бюретку 6. Кран 11 закрывают, склянку 8 поднимают, а газ выпускают в атмосферу через кран, имеющийся на гребенке 12. Так делают несколько раз для того, чтобы хорошо продуть стеклянную гребенку 12. Опуская вторично склянку 8 при открытом положении крана И, набирают в измерительную бюретку 100 см3 газа, для чего уравнивают уровень воды в склянке 8 с уровнем воды в бюретке 6 на метке 0. Закрыв кран //, открывают кран поглотительного сосуда 9, заполненного раствором едкого кали. Затем поднимают склянку 8, прокачивают за - бранную порцию газа в сосуд 9. Потом, опуская склянку 8, прокачивают эту порцию газа обратно в измерительную бюретку 6.
|
Рис. 4. Ручной химический газоанализатор: / — фильтр; 2 — заборная трубка; 3 — фильтрующая вата; 4 — водяной затвор; 5 — резиновая груша; 5 — измерительная бюретка; 7 — охладительный сосуд; 8 — склянка; 9 — поглотительный сосуд с раствором едкого кали; Ю — поглотительный сосуд г раствором пирогалловой кислоты; // — трехходовой кран; 12 — стеклянная гребенка |
Такую прокачку пробы газа через поглотительный сосуд 9 производят 3—4 раза. После этого нужно довести уровень поглотительной жидкости в сосуде 9 до первоначальной метки, закрыть кран сосуда 9 и заметить уровень воды в измерительной бюретке, предварительно уравняв его с уровнем воды в склянке 8. В измерительной бюретке уровень воды окажется выше 0 ввиду того, что объем первоначально набранной пробы газа (100 смъ) уменьшился вследствие поглощения С02 + 502 = 1Ю2 раствором едкого кали, залитым в поглотительный сосуд 9. Если, например, уровень воды - в измерительной бюретке окажется на метке 12,5 смг, то это будет означать, что в набранной порции дымовых газов содержание Н02 = С02“Ь502 равняется 12,5%.
Поглотительный сосуд 10, заполненный раствором пирогалловой кислоты в смеси с едким кали, предназначен для поглощения кислорода 02. Оставшуюся порцию газа (в случае, приведенном в данном примере,— 87,5 см3) прокачивают для этого 5—8 раз через сосуд 10 так же, как это делалось при прокачке газа через сосуд 9. Если уровень воды в измерительной
Бюретке после этого поднимется, то это укажет на уменьшение объема набранной пробы газа в результате поглощения 02 жидкостью сосуда 10. Если, например, после прокачки газа через сосуд 10 вода в измерительной бюретке поднимется до отметки 20,2 см3, то содержание 1Ю2 + 02 в пробе газа будет И02 + 02 = = 20,2% и, следовательно, содержание кислорода 02 = 20,2 — -12,5 = 7,7%.
В современных котельных установках применяются преимущественно автоматические электрические газоанализаторы, действие которых основано на изменении электрического сопротивления проводника в зависимости от состава среды, в которой он находится. Эти приборы снабжаются дистанционной передачей показаний на тепловой щит, причем показания содержания 1?02 и СО + Н2 в дымовых газах записываются непрерывно на движущейся бумажной ленте. Такие газоанализаторы должны получить распространение и в небольших котельных установках.
При помощи более совершенных и сложных газоанализаторов (ВТИ и др.), в которых производится дожигание несгоревших газов, кроме содержания в дымовых газах И02 и 02, может быть определено также содержание СО, Н2, СН4 и тяжелых углеводородов.
По результатам анализа дымовых газов определяется, как указывалось выше, полнота сгорания. Если содержание углекислоты и сернистого ангидрида в дымовых газах составляет И02%, а кислорода — 02 (в процентах по объему), то при полном горении будет иметь место равенство:
21-рщ> = 1Ю2+02. (19)
'Коэффициент 3, представляющий собой характеристику топлива, подсчитывается по формуле:
8 = 2,3(20) Кр
Если состав топлива неизвестен, то характеристика топлива Р может быть принята приближенно в следующих значениях:
Дрова, донецкий антрацит, челябинский бурый уголь 0,05
TOC o "1-5" h z Торф. . . 0,08
Подмосковный бурый уголь 0,1
Каменный уголь 0,12
Мазут 0,35
При химической неполноте сгорания имеет место неравенство:
21-^02> ИОз + Оо.
Обозначая
(21-01Юг)—(1Ю2-К02)=г, где г > 0,
Можно определить содержание окиси углерода СО в дымовых газах, пользуясь формулой:
TOC o "1-5" h z со = ^ ^ (21 - р ио,) - ою2 + о-,) Г21
0.6 + 3 0,6 + р ' ]
Коэффициент избытка воздуха находится по следующим фор
Мулам:
А) при полном сгорании:
1 (22)
ЮО - {R02 + 02)
Б) при неполном сгорании:
А =----------------- -1------------ - . (23)
1-3,76. O.-0-SCO
100 — (ROs + О,)
Пример. Подсчитать степень полноты сгорания торфа, имеющего следующий состав: С—33,9%; Нр - 3,5%; =
=0,2%; Л^ = 1,5%; Ор=19,6%; Л? = 6,3%, 1Р=35,0%, атак же найти коэффициент избытка воздуха, если согласно газовому анализу дымовые газы содержат: Р02=12,1%; 02=7,3%.
Решение. Определяем характеристику топлива (3 по формуле (20):
Нр 0,1260/4-о,04Л^
3 = 2,35-
Кр
2,35■ 3.5-0.126.Щ6 + 0.04.1.5 _0 0?6 33,9 - f - 0,375*0,2
По формуле (21) находим:
СО = г
Где: г = (21 - р1?02)-(1*0а + 02) - (21 - 0,076-12,1)-
-(12,14- 7,3) = 0,68.
Так как г ф 0, то устанавливаем, что сгорание происходит с некоторой неполнотой. Подсчитываем содержание в дымовых газах продуктов неполного сгорания:
Со =—^— 1,о%.
* 0,6 + 0,076
Коэффициент избытка воздуха по формуле (23) равен:
TOC o "1-5" h z а =--------------- !-------------- =----------------- 1--------------- =1,47
1 3 76 °?~ О^СО 1 3 76 7,3 - 0,5-1
’ ’ 100 - (ИО, + 05) 100 — (12,1 + 7,3)
Объем и теплосодержание дымовых газов
Объем дымовых газов (Уг) составляется, как сказано выше, из объема сухих газов (усг) и водяных паров [Ув п),т. е.
Уг = I/ г+ Уйп нм51кг топлива. (24)
При полном сгорании 1 кг твердого или жидкого топлива объем сухих газов может быть найден по формуле:
Кр
ЪМШ.
К. г = —(25)
Где попрежнему
Кр = Ср-(-0,3755^ и 1Ю2=С02+802.
В свою очередь, объем сухих газов состоит из объема трехатомных газов (Кво), к которым относятся СОг и ЭОг, и объема
Двухатомных газов (Ур2).
Таким образом, можно подсчитать объем сухих газов также по следующей формуле:
(26)
Где, сохраняя принятые ранее обозначения,
|
1/ко = 1,85 нм*/кг |
Ж 100
4 = 0,79 1/0 + (*-1)1/0 + 0,8|^ нм*/кг.
Объем водяных паров определяется по формуле:
9ЦР + Іооі^б
80,4
Где Рв — вес водяного пара, вносимого с воздухом в топку на 1 кг топлива в кг/кг (0,804 — удельный вес водяного пара).
При сжигании 1 кг твердого или жидкого топлива (с химической неполнотой сгорания) объем дымовых газов равен:
TOC o "1-5" h z V = V - I - V —С к"________________ и
Г с'г ' в-п Ю,54 (ИО. + СО),
£
9Нр 4- Рр 4- юоггГ
НмЪ}кг. (28)
80.4 7
Вес газов на 1 кг топлива составляет:
Ар .
Ог=1-^+1,306 * 1/0 кг! кг. (28')
В том случае, когда часть топлива, загруженного в топку, не участвует в горении (например, проваливается через зазоры ко - лосников, выгребается со шлаками, уносится в газоходы и дымовую трубу), в формулу для определения объема дымовых
Газов вносится поправка на механический недожог, и тогда фор
Мула приобретает вид:
_Г КР___________ и—1__ 100 ~~Я4 1
|
100 Нмъ/кг, (29) |
![]() Ч 0,54 (И02 4- СО) 80,4 ]
Ч 0,54 (И02 4- СО) 80,4 ]
Й7Р + QQWg
80,4
Где <7,— потеря тепла от механического недожога (в процентах от теплотворной способности топлива).
Для упрощенных расчетов можно пользоваться следующими приближенными формулами:
А) при сжигании твердых топлив с теплотворной способностью
С1Рн = 2500 4500 ккал/кг:
V = (1,15» —0,18) • • 100-Г-^1 нмЧкг; (30)
Г 4 1 ' 1000 100 ' ’ 4 '
Б) при сжигании мазута и твердых топлив с теплотворной способностью больше 4500 ккал/кг:
Уг = (1,11а + 0,05)--^- 100 — нмЧкг. (31)
Г 4 1 ' 1000 100 '
Теплосодержанием дымовых газов (Iгккал/кг) принято считать количество тепла, которое необходимо затратить для того, чтобы поднять температуру дымовых газов, получаемых при сгорании 1 кг топлива, от 0 до tг0C.
Теплосодержание дымовых газов подсчитывается по формуле: 1г=УгсгЬг ккал/кг топлива (32)
Или 4
= (Ко2ско2 + уе:псе. п) ккал/кг топлива, (33)
Где: сК02; с„. п ккал/нм3 град — средние объемные теплоем
Кости при постоянном давлении трехатомных и двухатомных газов, а также водяных паров, зависящие от температуры и принимаемые по табл. 7 в ккал/нм3 град.
|
Таблица
|
С некоторым приближением средняя объемная теплоемкость продуктов сгорания может быть определена по формуле:
= 0,323 + 0,018^^- ккал/нм3 град. (34)