ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ТЕХНОЛОГИИ МАГНИЙ-ИЗВЕСТКОВЫХ ОГНЕУПОРОВ
Доломит при нагревании разлагается по реакции п [MgCa (СО,)2] (я — 1) MgO + MgC03-nCaC03 + + 1)С02; (XI. 1)
MgC03 • лСаСОз MgO + «СаО + (я + 1) С02. (XI.2)
Первая реакция необратима и происходит при 750° С, вторая обратима и происходит при —950° С.
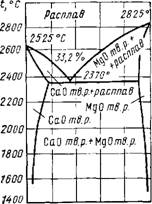
В системе СаО—MgO (рис. XI.1.) нет бинарных химических соединений. Оксиды кальция и магния дают твердые растворы с ограниченной растворимостью. Оксид кальция в чистом виде в природе не встречается и получается при разложении природных кальцийсодер - жащих соединений. Он имеет температуру плавления 2625° С.
Оксид кальция энергично соединяется с водой: СаО + Н20 ->- Са (ОН)2.
Реакция сопровождается увеличением объема почти в два раза.
Гидратация оксида кальция вызывает большие трудности в технологии известковых огнеупоров.
Применяются три способа предотвращения гидратации:
1) покрытие зерен извести смолой или пеком и таким путем изолировать их - от паров воды (смолосодер-
Жащие огнеупоры);
2) связывание свободного оксида кальция в высокоогнеупорные силикаты, не разрушающиеся от гидратации на воздухе (стабилизированный доломит);
3) получение плотных изделий с низкой пористостью.
На свойства изделий из доломита большое влияние оказывают реакции взаимодействия продуктов разложения доломита с примесями.
Оксид магния как менее активный по сравнению с оксидом кальция в реакции - с примесями не вступает и остается свободным.
Оксид кальция реагирует с примесями Fе203, А1203 и Si02. Получающиеся продукты реакции зависят от соотношения Al203/Fe203 (табл. XI.2).
При Al203/Fe203 = 0,64 образуется только браунмиллерит 4СаО-Al203-Fe203, а ЗСа0-А1203 и 2Ca0-Fe203 в этом случае не образуются.
На практике фазовое равновесие может не достигаться. В этом случае образуется стекловидное вещество и двухкальциевый силикат a = 2Ca0-2Si02 (/пл = = 2130° С). Двухкальциевый силикат при ~ 1440° С переходит в |} = 2Ca0-Si02 и при ~840°С в y-2Ca0-Si02. Переход в у-форму сопровождается увеличением объ-- ема на 10%, что при большем количестве силиката приводит всю массу к рассыпанию.
|
О 20 40 60 80 100 СаО, мдо /о (по массе) |
|
Рис. XI.1. Диаграмма состояния системы MgO—СаО |
Для стабилизации доломита путем перевода всего Оксида кальция в трехкальциевый силикат его обжигают с добавкой активного кремнезема по шламовому способу. Для образования 3Ca0-Si02 отношение Ca0/Si02 должно быть 2,8.
|
Фазовый состав обожженного доломита
* Разлагается. Примечание. Данные получены расчетом при равновесии многокомпонентной системы. В графах «Количество фазы» масса окиалов соответствует содержанию их в доломите. |
Согласно предыдущему при А120з/Ре20з>0,64 оксид кальция частично связывается с глиноземом и оксидами железа и частично остается свободным:
СаОсвоб = СаО - (0,35Fe203 + 1,65А1203)-
Для связывания всего оставшегося оксида кальция в трехкальциевый силикат должны, как указано выше, соблюдаться равенства:
Ca0CBo6/Si02 = 2,8
Или
[СаО — (0,35Fe, Oa + 1,65AlaOs)]/SiOa = 2,8, (ХІ. З)
КН = [СаО — (0,35Fe203 + l,65Ala03)]/2,8Si02. (XI. 4)
Величину КН называют коэффициентом насыщения. Когда КН = 1, весь кремнезем может быть связан в трехкальциевый силикат.
Для случая, когда Al203/Fe203<0,64:
КН = [СаО — (0,7Fea03 + 1,1 Ala03)]/2,8Si03. (ХІ. б)
По мере уменьшения КН в обожженном доломите появляется двухкальциевый силикат, у которого Ca0/Si02= 1,87, трехкальциевый силикат исчезает при /Щ = 1,87:2,8=0,67. Таким образом, при КН>1 имеются свободный оксид кальция и трехкальциевый силикат, при КН— (1ч-0,67) имеется смесь трех - и двух - кальциевых силикатов и при КН<0,67 трехкальциевый силикат исчезает, количество двухкальциевого силиката уменьшается и образуются легкоплавкие силикаты кальция и магния: монтичеллит Ca0-Mg0-Si02 (1498°С), мервинит 3Ca0-Mg0-2Si02 (1575°С), окер - манит 2Ca0-Mg0-2Si02 (1458°С) и диопсид СаО - •MgO-2Si02 (1390°С) (см. рис. IX.7). Сначала образуются более легкоплавкие соединения.
Поскольку при переводе СаО в 3Ca0-Si02 частично получается и двухкальциевый силикат, то для стабилизации 2Ca0-Si02 в р-форме вводят Р205. Введение Р2Об тормозит превращение двухкальциевого силиката в у-форму благодаря образованию с ним твердого раствора.
Одно из существенных преимуществ известьсодер - жащих огнеупоров в черной металлургии заключается в том, что оксид кальция огнеупора участвует в десуль - фурации и дефосфоризации чугуна и стали.