ТЕХНОЛОГИЯ КОНДИТЕРСКОГО ПРОИЗВОДСТВА
ПРОИЗВОДСТВО ЖЕЛЕЙНЫХ МАРМЕЛАДНЫХ ИЗДЕЛИЙ
Желейные мармелады, как и яблочные, имеют студнеобразную структуру. В качестве студнеобразователей при их производстве используются такие вещества, как агар, агароид, фурцелларан, сухой пектин и модифицированные крахмалы. Имитация вкуса, аромата и цвета натуральных фруктов и ягод в этих изделиях достигается добавлением кислоты, эфирных масел, эссенций, ванилина, красителей и фруктово-ягодных припасов.
В зависимости от способа приготовления, в частности, от способа формования, различают три основных вида желейного мармелада массового производства:
- формовой в виде изделий различных фигурных очертаний, формуемый отливкой в жесткие формы;
- трехслойный в виде резных изделий прямоугольной или ромбической формы с двумя наружными желейными слоями и средним слоем из сбитой массы;
- апельсиновые и лимонные дольки в виде изделий, по форме, вкусу и цвету подобных ломтикам апельсина или лимона.
В зависимости от рода применяемых студнеобразователей различают желейные мармелады и желейно-фруктовые. При изготовлении последних кроме агароподобных студнеобразователей используется желирующее фруктово-ягодное пюре.
Желейно-фруктовый мармелад вырабатывается в виде небольших фигур различных очертаний, поверхность которых обсыпана сахаром песком или покрыта тонкокристаллической корочкой.
Химический состав и свойства студнеобразователей
Агар. Основной студнеобразователь в производстве мармеладов, пастилы и зефира. Его получают из морских водорослей анфельции (Ahnfeltia plicata) или из водорослей фурцеллярии (Furcellaria fastigiata) путем длительного вываривания (после их очистки) в горячей воде с добавлением щелочи. Полученный отвар фильтруют, охлаждают до полного застудневания, режут на бруски и сушат до влажности не более 18 %. Извлечение агара и агароподобных веществ из водорослей зависит от свойств водорослей, химических веществ, добавляемых при вываривании, продолжительности и условий вываривания. Наибольшая прочность агаровых студней из водорослей фурцеллярии достигается при добавлении во время вываривания 10 %-ного КС1 (по массе сухих водорослей), менее прочные - при добавлении NH4C1.
Агар представляет собой высокомолекулярное соединение типа полисахаридов, подобно пектину имеет цепеобразную молекулу. Молекулярная масса растворимых фракций агара колеблется в пределах 11 000-25 ООО. При гидролизе агара получается до 35 % галактозы по массе исходного агара. Это указывает на присутствие в последнем галактана. Кроме галактозы, в препаратах агара обнаружены Са, Mg, К, Na, Р, S. Сера не отделяется диализом, так как находится в эфирной связи с углеводным комплексом агаровой молекулы.
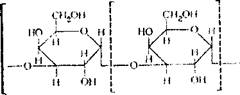
После деминерализации агара (удаления Са, Mg, К, Na) получается сложный органический комплекс, представляющий собой серный эфир линейного полисахарида, имеющего следующую формулу:
|
|
Агаровая цепь состоит из 9 остатков D-галактозы, связанных между собой глюкозидной связью в положении а (1—>3), и заканчивается остатком L-галактозы, у которой шестой атом этерифицирован серной кислотой.
Агар нерастворим в холодной воде, но набухает в ней как коллоид. При кипячении почти полностью переходит в раствор. При охлаждении водного раствора агара концентрацией более 0,2 % возникает желеобразная масса. Раствор, содержащий до 1 % агара, образует прочный студень со стекловидным изломом. Прочность студня увеличивается при добавлении в раствор агара сахара. Температура застудневания такого раствора около 40°С.
Как и пектин, из водных растворов агар можно осадить спиртом и электролитами. Кислоты, в отличие от пектина, разрушающе действуют на агар. В присутствии кислот при температуре 60-70°С начинается гидролиз агара, в результате которого он теряет свои студнеобразующие свойства. Подщелачивание, наоборот, увеличивает прочность студней агара.
По действующему стандарту агар высшего сорта должен быть белого цвета, содержать золы не более 4,5 %, азотистых веществ — не более 1 %, влаги — не более 18-20 %. Первый сорт агара может иметь цвет от желтого до светло-коричневого, содержать золы не более 7 % и азотистых веществ - не более 2,0 %.
Агароид. Студнеобразующее вещество, полученное из морских водорослей филофора нервоза (Phyllophora nervosa). Химический состав и строение его молекулы еще недостаточно изучены. Структурная формула агароида, по данным исследований, близка к формуле агара. Агароид следует считать производным полигалактана, относящимся к полисульфокислотам. В составе агароида установлены следующие вещества: галактоза, глюкоза, фруктоза, сера, натрий, кальций, магний, небольшое количество ацетильных групп. Молекулярная масса агароида 2500-5000.
По своим свойствам агароид несколько отличается от агара. Он плохо растворим в холодной воде, ио переходит в раствор при нагревании. Гидрофильные свойства агароида выражены слабее, чем у агара и пектина. При охлаждении водных растворов агароида концентрацией 0,8-1,0 % образуется студень. Прочность студней агара значительно выше, чем студней агароида. Добавление к агароидным растворам электролитов 0,01н концентрации повышает прочность студня. По силе действия электролиты располагаются в следующий ряд: KCl>Al2(S04)3>K2S04>BaCl2>NH4Cl. С увеличением электролитической диссоциации катиона, замещенных образцов агароида, увеличивается их вязкость в разбавленных растворах и степень набухания в воде. В присутствии сахара прочность студней и вязкость растворов агароида выше, чем у агара. В условиях кондитерского производства способность к студнеобразованию у агароида в 3,0-3,5 раза меньше, чем у агара, и в 2,0-2,5 раза меньше, чем у пектина.
Температура застудневания растворов агароида в присутствии сахара и кислоты около 70°С.
По установленным стандартам агароид выпускается в виде пленок или плиток светло-серого или светло-желтого цвета влажностью не более 18 %. Содержание золы не более 15 % для высшего сорта и 17,5 % для 1 сорта, йода - не более 0,25 %. Зольность агароида в 3-4 раза больше, чем у агара. Состав минеральных элементов в агароиде может значительно изменяться в зависимости от технологических условий приготовления, что влияет на его физико-химические свойства и студнеобразующую способность.
Фурцелларан. Студнеобразующее вещество, полученное из морских водорослей фурцеллярии (Furcellaria fastigiata). В гидролизатах фурцел - ларана содержится D-галактоза, L-галактоза, глюкоза, фруктоза и ксилоза. По химическому составу и свойствам он близок к агароиду, хотя прочность студней фурцелларана выше, чем у агароида.
Сухой пектин. Сырьем для получения сухого пектина являются яблочные выжимки - отходы переработки яблок, корочки цитрусовых плодов, корзинки подсолнечника и свекловичный жом. Указапкое сырье подвергается кислотному гидролизу - экстрагированию с применением НС1 в течение 1-2 ч при температуре 70-90°С. Для осаждения пектина из солянокислой вытяжки применяются органические осадители (спирт, ацетон) или соли поливалентных металлов (А1, Са, Си). В качестве подщелачивающих агентов для нейтрализации вытяжки перед осаждением применяются NH4OH, NaOH, Na2C03. Полученную вытяжку пектиновых веществ сушат в распылительных сушилках до влажности не более 14 %.
Сухой пектин представляет собой линейный полисахарид, состоящий из остатков галактуроновой кислоты, соединенных глюкозидной связью в положении а (1—>4). Значительная часть карбоксильных групп этерифици - рована метиловым спиртом. Количество метоксильных групп (СН30) достигает 5-8 % от массы пектина. Это составляет 40-60 % по отношению ко всему количеству карбоксильных групп в молекуле пектина.
Основные физико-химические показатели пектина, полученного из разных источников сырья, приведены в табл. II-1.
Таблица II-1. Физико-химические показатели пектина
|
Показатели |
Свекловичный |
Подсолнечный |
Яблочный |
Арбузный |
|
Влажность, % |
10-12 |
10-11 |
11,9 |
|
|
Содержание пектина по пек- |
||||
|
тату Са, % |
72-77 |
77-80 |
60,4 |
69,6 |
|
Степень этерификации |
28-40 |
40-60 |
73,9 |
43,2 |
|
Содержание, % |
||||
|
метоксильных групп |
3,7-5,5 |
5,3-6,5 |
7,4 |
5,1 |
|
ацетильных групп |
0,4-0,8 |
0,4-0,9 |
- |
- |
|
2400- |
34000- |
|||
|
Средняя молекулярная масса |
28000 |
38000 |
35500 |
14130 |
|
Содержание общей золы, % |
1,2-1,7 |
2,5 |
3,4 |
- |
|
Растворимость, % |
90,0 |
90,0 |
- |
- |
|
Прочность 15 %-ного пекти |
||||
|
нового студня, кПа |
60-80 |
50,0-80,0 |
60,0 |
70,0 |
Товарный сухой пектин представляет собой порошок серого цвета влажностью не более 14 %. Водный 1 % раствор пектина имеет pH от 3,0 до 3,8.
Модифицированный крахмал получают кислотной обработкой картофельного или кукурузного крахмала. Продолжительная обработка 40 % водной суспензии крахмала приводит к гидролитической деструкции полисахаридов. Происходит окисление крахмала с образованием альдегидных и карбоксильных групп. Для ускорения гидролиза крахмала в кислую среду суспензии вносят раствор перманганата калия. Для получения модифицированного крахмала в его суспензию, нагретую до 40-50°С, вводят заданное количество соляной кислоты и перманганата калия. Суспензию выдерживают, обеспечивая необходимую степень расщепления крахмала. После завершения реакции суспензию нейтрализуют раствором углекислого натрия, крахмал отделяют, промывают водой и высушивают.
Крахмалы, окисленные перманганатом калия, относятся к “жидкоки - пящим”. При высокой концентрации они образуют клейстеры, отличающиеся пониженной вязкостью. При охлаждении такие клейстеры загустевают и образуют прочные студни, что делает их пригодными для получения желейных кондитерских изделий.
Однако модифицированный крахмал, как студнеобразователь, находит ограниченное применение. Это объясняется двумя причинами:
- для разваривания крахмала, образования клейстера, требуется 10- 12-кратное количество воды, которую затем необходимо выпарить при сушке отформованных изделий;
- формирование структуры студня протекает очень медленно - в течение 3 - 4 ч, поэтому желейные изделия на модифицированном крахмале не могут формоваться на механизированных линиях.
Модифицированный крахмал находит большое применение на маломеханизированных предприятиях.
Растворение студнеобразователей
При производстве желейных масс студнеобразующие вещества предварительно замачивают в течение 1-3 ч в ванне с проточной водой температурой 15-25°С. При замачивании агара, агароида, фурцелларана происходит набухание, при этом поглощается 400-600 % воды к массе высокомолекулярного вещества.
Сухой пектин, как правило, используется в производстве пастельных изделий. В яблочное пюре содержанием 10 % сухих веществ добавляют около 3 % яблочного пектина, тщательно перемешивают и оставляют на 2- 4 ч для набухания. Разработан ускоренный способ приготовления яблочно-пектиновой пасты[1], по которому в целях сокращения времени набухания пектина смесь яблочного пюре, сухого пектина и возвратных отходов зефира перемешивается (гомогенизируется) мешалкой с частотой вращения 900-1200 об/мин при температуре 70-60°С в течение 4-6 мин.
Прежде чем обосновать технологические режимы производства желейных и пастильных масс, необходимо кратко остановиться на процессах набухания и растворения высокомолекулярных веществ.
Раньше исходили из мицеллярной теории строения высокополимеров и рассматривали процесс растворения как диспергирование высокомолекулярного вещества в растворителе с образованием гетерогенных, термодинамически неравномерных и неустойчивых коллоидных растворов.
На смену мицеллярной пришла молекулярная теория, согласно которой растворение высокомолекулярного соединения идет самопроизвольно, часто с выделением теплоты. При растворении не требуется присутствия стабилизатора. Коллоидные растворы, как известно, не могут быть получены без специального стабилизатора.
Молекулы высокомолекулярных соединений в растворе находятся в виде свернутых в клубок нитей. В результате теплового движения конфигурация свернутой нити все время меняется. В целом, однако, форма клубка всегда остается близкой к форме вытянутого эллипсоида.
Растворение высокомолекулярных веществ принято рассматривать как процесс смешения двух жидкостей, который обусловлен как энергетическим взаимодействием между молекулами растворяемого вещества и растворителя, так и действием энтропийного фактора, характеризующего равномерное распределение молекул растворенного вещества в растворе.
Самопроизвольное растворение высокомолекулярного соединения при постоянном давлении и температуре должно сопровождаться уменьшением свободной энергии по уравнению:
АЕ = АФ - TAS, (И-3)
где Ф- внутренняя энергия, S - энтропия.
Очевидно, для того, чтобы произошло самопроизвольное растворение, величина термодинамического потенциала Е должна иметь отрицательное значение. Это достигается при условии, что АФ<0, a AS>0. Первое условие соблюдается за счет выделения теплоты гидратации и растворения. Второе условие всегда осуществляется на практике при растворении, так как энтропия смешения всегда положительна для высокомолекулярных веществ и значительно превышает идеальную энтропию смешения. Это объясняется тем, что в растворе возрастает возможность движения отдельных участков гибких цепных молекул.
Макромолекулы в растворе могут быть расположены различно, причем каждая макромолекула может осуществлять большое число модификаций.
Из сказанного вытекает важный вывод, что высокомолекулярные вещества с гибкими макромолекулами должны всегда лучше растворяться, чем с жесткими.
При повышении температуры значение энтропийного фактора становится больше. Таким образом, для всякого высокомолекулярного вещества и растворителя должна существовать критическая температура, выше которой наблюдается их смешивание во всех отношениях.
Растворение высокомолекулярных веществ с линейными молекулами сопровождается набуханием, которое является первой стадией растворения.
При набухании в воде растворение протекает в две стадии. Макромолекулы в аморфных высокомолекулярных веществах упакованы сравнительно неплотно, и при тепловом движении между гибкими цепями образуются щели, в которые диффундируют маленькие молекулы воды. Происходит гидратация макромолекул, сопровождающаяся выделением теплоты, разрушением связей между отдельными макромолекулами, упорядоченным расположением молекул воды около макромолекул высокополи - меров. Поэтому на первой стадии растворения энтропия системы даже понижается.
На второй стадии, когда связи между отдельными макромолекулами сильно ослаблены, они отрываются от основной массы вещества и диффундируют в среду, образуя однородный истинный раствор. На этой стадии процесс растворения обусловлен чисто энтропийными причинами.
Чем больше молекулярная масса вещества, тем медленнее происходят процессы набухания и растворения.
При данных условиях набухание не всегда заканчивается растворением. Одна из причин такого явления может заключаться в том, что высокомолекулярное вещество и растворитель способны смешиваться ограниченно. Другая причина состоит в том, что между молекулами высокомолекулярного вещества могут существовать поперечные химические или межмолекулярные связи. Такое вещество, по существу, представляет пространственную сетку, которая препятствует отрыву макромолекул друг от друга и переходу их в раствор.
Ограниченное набухание с повышением температуры сильно уменьшается, а скорость набухания возрастает, так как повышение температуры способствует ускорению установления равновесного состояния системы.
Степень набухания Нн высокомолекулярного вещества можно вычислить по уравнению:
— (ё — So) t §0’ тлч
где g0 и g - навеска вещества соответственно до и после набухания.
Определяя степень набухания через определенные промежутки времени, можно изучить кинетику набухания и построить кривую, аналитически описываемую дифференциальным уравнением:
|
|
где ННтах - степень предельного набухания; ННт - степень набухания к моменту времени х; К - константа скорости набухания, зависящая от природы полимера, растворителя и температуры.
Интегрируя уравнение (II-5), получим:
|
|
|
Ншах |
|
Н шах |
(II-6)
Исходя из вышерассмотренной теории растворения высокомолекулярных веществ, можно охарактеризовать зависимость растворимости студнеобразователей в воде от различных факторов.
Как у любого высокомолекулярного соединения, растворимость студнеобразователей зависит от значения молекулярной массы вещества и строения его молекулы. Наилучшей растворимостью в воде обладают агароид, фурцелларан, молекулярные массы которых в 5 - 10 раз меньше, чем у агара. Растворимость пектиновых веществ зависит не только от молекулярной массы, но и степени этерификации молекул. С увеличением молекулярной массы и снижением степени этерификации растворимость уменьшается. Например, в водорастворимом пектине более 80 % карбоксильных групп насыщены радикалами метилового спирта. А пектовая кислота, степень этерификации молекул которой равна нулю, практически нерастворима в воде.
Нерастворимость в воде протопектина объясняется наличием в молекуле многовалентных ионных поперечных связей посредством кальция и магния между свободными карбоксильными группами пектиновых молекул. Между карбоксильными группами пектиновых молекул и гидроксильными группами других полисахаридов (целлюлозы, гемицеллюлозы) могут образовываться групповые связи.
С повышением температуры процессы набухания и растворения студнеобразователей ускоряются. При кипячении они полностью растворяются, образуя истинный молекулярный раствор. Пектиновые вещества, перешедшие в раствор при нагревании до разных температур фруктово-ягод - ного сырья, могут отличаться степенью полимеризации, этерификации и другими свойствами.
Особенности процесса студнеобразования агароподобных веществ
Описанный выше механизм образования пектинового студня применим и для агароподобных веществ. Однако природа этих студнеобразова - телей, строение их молекул и физико-химические свойства требуют отметить некоторые особенности процесса желирования.
Молекулярная масса пектина в 5 раз выше, чем у агара, и в 20 раз больше, чем у агароида. Сравнивая строение молекул этих веществ, нетрудно видеть, что в молекулах агара и агароида отсутствуют карбоксильные группы СООН, метальные группы ОСН3, столь характерные для пектиновой молекулы. В молекуле агара (а возможно и агароида) присутствует сульфатная группа HS04. Значит, величина потенциала на поверхности молекул агара и агароида в растворе будет значительно ниже, чем на поверхности молекул пектина. Соответственно, будет небольшой и толщина диффузного слоя. Эти характеристики высокомолекулярных ионов, как было отмечено выше, определяют величину электростатических сил отталкивания при ассоциации молекул.
По функциональным группам молекул можно также заключить, что молекулы агароподобных веществ менее полярны, чем молекулы пектина, поэтому их агрегатирование может протекать и при небольших количествах сахара в жидкой фазе. Даже при небольшой концентрации ионов водорода или потенциалопределяющих ионов обеспечиваются условия безбарьерной коагуляции. Видимо, для молекул агароподобных веществ в растворе преобладает нейтрализационная коагуляция, когда энергетический барьер подавляется адсорбцией потенциалопределяющих ионов ОН', Са++, Mg++ и др.
Наиболее важной характеристикой агаровых и агароидных студней, определяющей их физико-химические и структурно-механические свойства, является величина заряда высокомолекулярного аниона, который обусловлен числом сульфатных групп в единице массы студнеобразователя и природой катиона.
Вводя в молекулу агара или агароида тот или иной катион, можно в заранее известном направлении изменить величину заряда высокомолекулярного аниона, а следовательно, и физико-химические свойства студнеобразователя.
С. Н. Ставровым и Ф. П. Боунегру установлено, что с увеличением электролитической диссоциации катиона, замещенных образцов агароида, увеличивается их вязкость в разбавленных растворах и степень набухания в воде, но при этом уменьшается способность к студнеобразованию.
Наилучшей студнеобразующей способностью обладают катионзаме - щенные образцы Ва++ и Са++-агароида, т. е. как раз те, на поверхности молекул которых в растворе будет минимальный потенциал.
При подкислении агаровых желейных масс уменьшается концентрация потенциалопределяющих ионов ОН- в жидкой фазе, что является причиной снижения студнеобразующей способности. Прежнее трактование о гидролизующем действии кислоты на молекулу агароподобных веществ необходимо признать ошибочным.
Различие в действии кислот и их натриевых солей на прочность студней объясняется различным изменением растворимости агара и агароида. При добавлении в желейные массы органических кислот, образующих с кальцием нерастворимые или малорастворимые соли, диссоциация молекул частично освободившейся агаровой или агароидной кислоты в значительной степени подавлена кислой средой, и поэтому заметных изменений в прочности студней не наблюдается. При введении натриевых солей этих кислот, что часто практикуют при выработке желейных мармеладов, агар (агароид) обогащается натрием, растворимость его молекул увеличивается, что повышает общую концентрацию при данной температуре и способствует образованию более прочных студней.
Технологии производства желейных мармеладов
Желейные мармелады могут изготавливаться на агаре, агароиде или пектине. В каждом конкретном случае технология их производства имеет свои особенности.