Проточные (динамические) методы
Наиболее распространенными являются проточные методы измерения каталитической активности [20, 37, 51]. В проточных установках поток реагентов пропускают с определенной скоростью через реакционный объем, содержащий катализатор, и производят замеры параметров процесса, анализы состава на входе в реактор, на выходе из него и по возможности в различных точках этого объема [51, 211 ]. Проточные методы позволяют проводить кинетические исследования в установившихся условиях, т. е. при постоянстве исходных концентраций, температур, давления, степени перемешивания и других параметров в каждом отдельном опыте. При переходе от одного опыта к другому изменяют определенные параметры процесса на заданное значение.
Проточный метод [51, 212] является интегральным и непрерывным и позволяет осуществлять процесс как угодно долго при заданных концентрациях, температурах, давлениях, линейных и объемных скоростях газового потока на входе в реактор. Естественно, что концентрации реагирующих веществ и другие параметры изменяются по длине (высоте) реактора в результате химического превращения. Аппаратурное оформление таких установок проще, а чувствительность ниже, чем статических.
При использовании проточного метода с неподвижным слоем катализатора в реакторе обычно допускают, что движение газа в слое катализатора отвечает режиму идеального вытеснения, т. е. пренебрегают радиальными градиентами давления, темпера-- туры, концентрации. Соответственно среднюю скорость процесса по высоте слоя Н или по времени контакта т (поскольку т пропорционально Н) определяют интегрированием кинетических уравнений (5.1) и (5.3). Аналитическое решение кинетических уравнений, как правило, возможно лишь с применением вычислительных машин. При их отсутствии прибегают к графическому дифференцированию зависимости х = f (т), что вносит погрешности.
Основное достоинство проточного метода — возможность определения каталитической активности при стационарном состоянии катализатора. Существенный недостаток — невозможность прямого измерения скорости реакции и трудность осуще твления в реальных условиях режима идеального вытеснения [20].
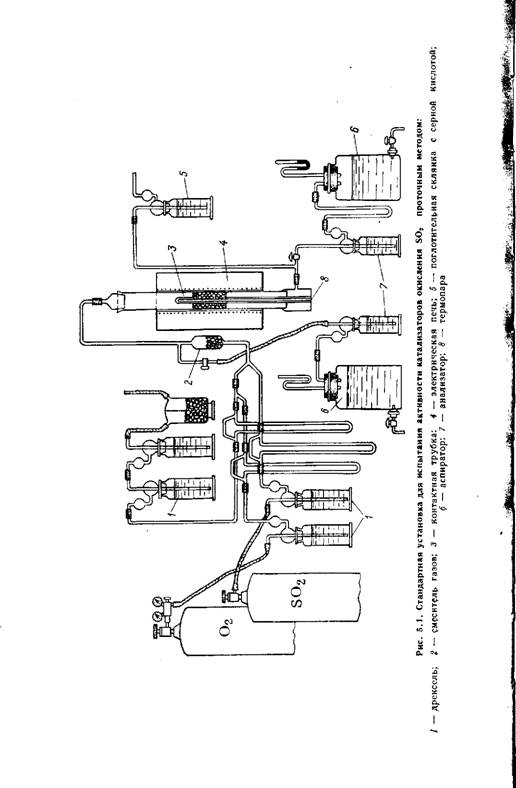
Однако ряд преимуществ проточного метода (простота конструктивного оформления, непрерывность работы, возможность проверки катализатора в условиях, близких к производственным) обеспечили ему широкое применение при изучении каталитических реакций окисления оксида углерода [213], оксида серы (IV) 144, 28], аммиака [22], спиртов и др. На рис. 5.1 приведена общая схема проточной установки для определения активности катализатора окисления S02 [51].
Газовую смесь через смеситель 2 направляют в реактор с контактной массой. Контактная трубка 3 помещена в электрическую печь 4, снабженную тремя самостоятельно регулируемыми нихро - мовыми спиралями. Это дает возможность регулировать температуру отдельно в разных частях слоя контактной массы с достаточным приближением к изотермичности. Колебания температуры по слою не должны превышать 5 °С. Концентрацию S02 определяют до контактной трубки и после нее.
Применение проточного метода основано на принятии упрощающих предположений о режиме идеального вытеснения и о квазистационарном состоянии системы. Отклонения от таких режимов обусловлены наличием определенных градиентов, возникающих в применяемых системах [20].
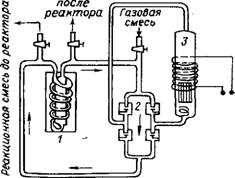
Безградиентный проточно-циркуляционный метод [51, 212] осуществляют в условиях практического отсутствия в реакционной зоне перепадов концентраций и температур. Принцип его применительно к изучению кинетики гетерогенных каталитических реакций впервые предложен Темкиным, Киперманом и Лукьяновой [214]. Перемешивание в проточно-циркуляционной системе достигается интенсивной циркуляцией реакционной смеси через катализатор в замкнутом объеме при непрерывном поступлении и выведении газового потока, причем количество циркулирующего газа должно значительно превышать количество вновь вводимого исходного газа. Циркуляция с большой скоростью происходит с помощью насосов: механических, поршневых или электромагнитных, мембранных и других [20, 51, 214]. Циркуляционный контур, состоящий из электромагнитного насоса 3 (подача 600—1000 л/ч), клапанной коробки 12 двойного действия и реактора 1, помещенного в печь, представлен на рис. 5.2.
Высокая линейная скорость реакционной смеси в цикле и малая степень превращения обусловливают минимальные градиенты концентраций и температур, при этом слой можно рассматривать как бесконечно малый, а реактор — как аппарат идеального смешения. Следовательно, скорость процесса можно в данном случае определить отношениями [51 ]:
Gn. JL - ^з,- Си •
VX ' vx ' т ' т ' т '
Основными достоинствами проточно-циркуляционного метода являются:
1. Прямое измерение скорости реакции в каждом опыте.
|
|
Рис. 5.2. Проточно-циркуляционная система с электромагнитным поршневым насосом:
1 — реактор; 2 — клапанная коробка; 3 — насос
2. Легкость достижения постоянства температуры в реакторе, даже для реакций со значительным тепловым эффектом, благодаря интенсивной циркуляции и соответственно малому изменению степени превращения в слое катализатора [20, 214].
3. Осуществление процесса в режиме, аналогичном полному смешению, т. е. без внешнедиффузионных торможений, при практическом отсутствии перепадов концентраций и температур.
4. Возможность работы с любым количеством катализатора, вплоть до одной гранулы, при любых размерах гранул и соотношениях размеров гранул и реактора.
Искажение, связанное с переносом внутри зерен (т. е. внутри - диффузионное торможение), сохраняется. Снятие его требует уменьшения размера зерен катализатора при испытании. Сохраняя неизменным химический состав и изменяя размеры зерен катализатора, можно выявить влияние пористой структуры на активность контактной массы, т. е. определить внутридиффузионное торможение при различных размерах зерен, а также их максимальный размер, соответствующие переходу от внутридиффузионной области к кинетической.
К недостаткам проточно-циркуляционного метода можно отнести:
1. Сложность аппаратурного оформления.
2. Необходимость достаточных количеств исходных веществ и времени для достижения стационарного состояния, в некоторых случаях — возможное усиление побочных процессов [2141.
Существенные преимущества проточно-циркуляционного метода подтверждают целесообразность ею применения при изучении кинетики реакций.
|
Реакционная смесь
|
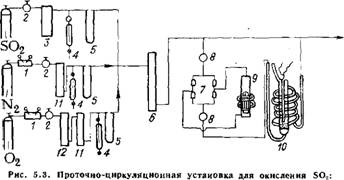
Схема проточно-циркуляционной установки для окисления оксида серы (IV) приведена на рис. 5.3 [51 ]. Оксид серы, азот и кислород из баллона дозируют вентилем тонкой регулировки 2 в осушительную систему. Точный расход газов регулируют моно - статом 4 и замеряют реометром 5. Затем смесь газов поступает в циркуляционный контур; газовую смесь на входе и выходе из - цикла анализируют по методу Рейха [22]. Для предотвращения «залипання» клапанов вследствие конденсации S03 производят постоянный электрообогрев клапанной коробки 7. Реактор 10
|
1 — редуктор; 2 — вентиль тонкой регулировки; 3 — барботер c'H2SOt; 4 — моностат с дибутилфталатом; 5 — реометр; 6 — колонка с Ps05; 7 — клапанная коробка; 8 — ловушка; 9 — циркуляционный насос; 10 — реактор; 11 — колонка с ангидридом; 12 — Колонка с СиО |
Представляет собой трубу с сеткой и впаянным карманом для термопары. Во время эксперимента реактор помещают в цилиндрическую печь с автоматической регулировкой температуры. Установка позволяет работать при температурах от 0 до 620 °С.
Степень превращения х рассчитывают по формуле:
Х=(Сн~ Ск)-10000/(100 — 1,5СК). (5.6)
Здесь Ся, Ск — начальное и конечное содержание SO» соответственно, % (об.).
Активность катализатора характеризуется константой скорости, рассчитанной по уравнению Борескова [215]: , C„xplV10» 1 1 —0,2л;
(5.7)
(1 - х2) Р0,К2р
Здесь С„ — исходное содержание SOa, % (об.); х — степень превращения, доли ед.; р — насыпная плотность катализатора, г/мл; V0—-скорость подачи газа, приведенная к нормальным условиям, л/ч; акат — навеска катализатора, г; Pq2 — парциальное давление кислорода в исходном газе, Па; Кр — константа равновесия.
Существует дифференциальный способ исследования каталитической активности, представляющий собой обычный проточный метод при малом количестве катализатора и больших объемах протекающей реакционной смеси, т. е. при больших объемных скоростях [20]. Благодаря этому изменение степени превращения в слое катализатора невелико, и количество превращенного вещества может служить мерой скорости реакции. Однако этот метод не обеспечивает достаточной точности измерения скорости реакции.
В проточно-циркуляционных методах для расчета скорости реакции используют не малую разность концентрационной смеси на входе и выходе из слоя катализатора, а значительную разность
концентрации смеси, поступающей в циркуляционный контур и выходящей из него. Поэтому каталитическая активность проточно-циркуляционным методом может быть измерена с гораздо большей точностью [20].
Определение активности катализаторов во взвешенном (кипящем) слое [17, 214] приобретает большое значение, в частности при моделировании производственных условий некоторых процессов. Ведение реакций во взвешенном слое требует тщательного выбора гидродинамических условий, приближающихся к моделируемому процессу. Прежде всего, важно аналогичное моделируемому процессу отношение действительной скорости w и скорости начала взвешивания at>B катализатора.
Скорость начала взвешивания можно определить по уравнению [17, 51]:
ReB = Av/(l400 + 5,22 / Аг). (5.8)
Здесь Re„ = ———- — критерий Рейнольдса; Аг = Ртв ~Рг —
В v v Рг.
Критерий Архимеда.
Уравнение (5.8) применимо для моно - и полидисперсных слоев с частицами сферической и неправильной формы в широком интервале чисел Re и позволяет определять шъ с точностью до ±30 %.
Средний размер частиц ds. ср может быть определен различными способами. При достаточно узком гранулометрическом составе частиц, близких по форме к сферическим, при изменении их размера от ds, Ср1 до (dB, ср2:
Dз. ср /4. cpi<4. cps* (5-9)
^ При широком гранулометрическом составе путем рассева Еыде - ляют узкие фракции и рассчитывают средний диаметр частиц по формуле (5.9) и долю частиц А; с этим размером. Средний диаметр частиц всех фракций катализатора может быть определен по формуле:
4. ср=1 (5Л0)
/ "з. ср і
Для частиц, форма которых существенно отличается от сферической, dB. cpj определяют по формуле:
4. ср t = /6t>s. ер/я» (5.11)
Здесь у3. Ср — средний объем частицы, определяемый по числу частиц в пробе и массе пробы.
Установка для окисления S02 во взвешенном слое катализатора аналогична установке, изображенной на рис. 5.1, но здесь газовую смесь заданного состава подают в контактный аппарат снизу вверх со скоростью, превышающей истинную скорость начала взвешивания.