Истинное отравление
Этот вид отравления наступает при химическом взаимодействии яда с катализатором с образованием каталитически неактивного соединения или в результате активированной адсорбции яда на неактивных центрах катализатора.
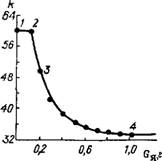
Рис. 2.23. Зависимость константы скорости окислення S02 на ванадиевом катализаторе от количества поданного мышьяка Gff
При химическом отравлении возрастает энергия активации Е. В случае адсорбционного отравления неоднородной поверхности энергия активации может возрастать монотонно либо ступенчато в результате покрытия сначала более, затем менее активных центров. При этом возможно изменение порядка реакции [20,51]. Адсорбционное отравление однородного катализатора (предельный случай) не сопровождается изменением истинной энергии активации, а наблюдаемая активность линейно зависит от концентрации яда на поверхности катализатора [51].
Адсорбционная связь, посредством которой яд удерживается на контакте, весьма специфична, а химическая природа образования таких связей зависит от типа электронной конфигурации и в катализаторе, и в яде. Примером специфической адсорбции ядов может служить почти каждый каталитический процесс. Так, при окислении S02 соединения мышьяка и другие яды энергично адсорбируются или чисто химически связываются катализатором. При использовании в качестве фэрконтакта относительно дешевых катализаторов, например оксида железа, ядовитые примеси задерживаются в нем, и на основной контактный аппарат с высокоактивной массой подается очищенный газ.
Анализируя гиперболическую кривую отравления (см. рис. 2.23), можно заключить, что характер отравления изменяется по мере увеличения количества поданного на катализатор яда G„ [20, 51].
Простейшим выражением степени отравления К0 является соотношение констант скоростей на отравленном k0 и неотравленном k катализаторах [19]:
= k0/k. (2.72)
На участке 1—2 (см. рис. 2.23), почти параллельном оси абс - ци сс:
K0jk = 1 (т. е. k0 = k) и А0/А = 1 (т. е. А = Л0). (2.73)
Здесь А0 н А — активности отравленного и неотравленного катализаторов соответственно.
|
|
Постоянная активность катализатора на начальном участке объясняется, видимо, либо сорбцией яда каталитически неактивными центрами поверхности (защитное действие носителя), либо избытком катализатора.
Участок гиперболы 2—3 может быть для удобства расчетов аппроксимирован в прямолинейный и охарактеризован соотношением [51 ]:
A0/A = l—aGa. (2.74)
Здесь а — коэффициент отравляемости, который показывает долю занятой частицами яда активной поверхности катализатора, отнесенную к единице массы- яда.
Такая линейная зависимость может быть объяснена тем, что молекула яда адсорбируется на активном центре, не воздействуя на соседние [51 ]. Скорость и любой реакции, в том числе и скорость «реакции» отравления катализатора, имеющей порядок п, равна:
И = kCl - (2.75>
Здесь Ся — концентрация яда.
Следовательно, линейный участок на кривой отравления может появиться только при каталитическом акте первого порядка (если яд не действует на соседние участки).
На отрезке кривой 3—4 снижение значения k происходит ш» гиперболическому закону:
А0/А = р/G*. (2.76>
Постоянные величины (3 и у находят экспериментально [51].. Так, для двух каких-либо точек гиперболы можно записать:
^04^4 = Р. (2-Г7>
(А03/А01) (GH3/Ga4)v = 1.
Откуда
У = (lg Aoi - lg H„,)/(lg Ga3 - lg Gu). (2.78)
Зная у, по формулам (2.77) можно определить р. Постепенно кривая приближается к горизонтальному участку, параллельному оси абсцисс. Тогда при у 0 уравнение (2.76) примет вид:
Л0/Л=Р(Р<1). (2.79)
Высокую токсичность первых порций яда (отрезки кривой 2— 3, 3—4 на рис. 2.23) можно объяснить либо тем, что доля активной поверхности составляет лишь незначительную часть от всей поверхности, способной адсорбировать реагенты, либо изменением работы выхода электрона из катализатора. Согласно электронной теории катализа, это изменение может повысить энергию активации каталитической реакции и таким образом понизить ее скорость [51].
Систематическое количественное изучение процесса отравления провел Мэкстед [19, 51]. В этих работах, в частности, дано уравнение ингибирования реакции гидрирования разнообразных жидких субстратов, например ингибирование метилсульфидом
|
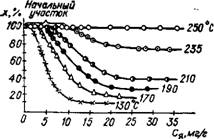
Рис. 2.24. Изменение степени превращения X сероводорода в зависимости от концентрации Ся яда в палладиевом катализаторе и температуры |
3—
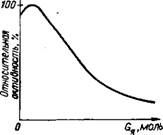
Рис. 2.25. Влияние количества аниона AsOj иа активность платинового катализа
Тора в процессе гидрирования коричной кислоты
Реакции гидрирования циклогексана на платине. Ход зависимости выражается уравнением типа (2.74) [51].
При равномерной подаче яда и полном его поглощении катализатором кривые k = f (т) и А = f (г) подобны кривым k = f (G„) и А = f (GH). На отравление влияет также температура, давление и метод изготовления контактов. Повышение температуры, как правило, снижает действие ядов, что отчетливо видно на рис. 2.24. Иногда контактный яд в очень малых количествах активирует катализатор. Так, анион AsO|~ в небольших дозах увеличивает активность платины в каталитической реакции гидрирования коричной кислоты, а в больших количествах — отравляет ее (рис. 2.25).
Для расчета отравляемости катализаторов кроме уравнения (2.75) используют и другие выражения [19, 51 ]. Боресков, оценивая отравляемость катализаторов, применил формулу:
А = (2,3/Ga) lg (k/k0). (2.80)
Количество яда, достаточное для отравления катализаторов, как правило, чрезвычайно мало [90]. Так, потеря активности никелевым катализатором в реакциях гидрирования наступает в присутствии циановодорода в соотношении 1 : 20 ООО ООО, сероводорода — 1 : 3 ООО ООО, сулемы — 1 : 2 ООО ООО [90]. Отравляемость катализатора увеличивается с уменьшением его удельной площади поверхности [51 ].
|
|
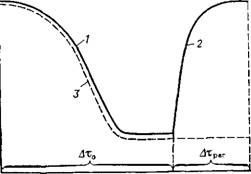
При использовании катализаторов нанесенного типа носитель может быть конкурентноспособным в отношении адсорбции яда. Некоторые носители связывают ядовитую примесь, защищая катализатор, как и определенные типы активаторов [40, 51]. Кроме того, с ростом поверхности контакта за счет его тонкого распределения по поверхности носителя чувствительность к отравлению уменьшается, а время, соответствующее начальному участку типичной кривой отравления, увеличивается (рис. 2.26) [20, 51].
Отравление в основном специфично. Каждый яд действует замедляюще, как правило, только в отношении одного катализатора и определенной реакции.
Действие яда может быть селективным, что дает возможность повысить избирательность катализатора. Так, проводят селективное отравление серебряных катализаторов галогенами, в результате чего реакция полного окисления этилена подавляется сильнее, чем реакция образования оксида этилена, и избирательность катализатора, таким образом, повышается [40, 51]. Благодаря этому многостадийную реакцию можно остановить на какой-либо из промежуточных стадий. Такое отравление названо благоприятствующим [51, 91].
При изучении отравления катализаторов установлена связь между токсичностью и молекулярным строением яда. Это явление Мэкстед назвал якорным эффектом [51]. При сравнении ядов, содержащих, например, ядовитый атом серы, оказалось, что токсичность яда, приходящаяся на 1 моль серы, тем больше, чем больше молекулярная масса соответствующего соединения серы [51 ].
Отравление может быть обратимым, необратимым, кумулятивным.
При обратимом отравлении (см. рис. 2.26, кривая 1) активность катализатора снижается до определенного уровня, соответствующего концентрации ядовитой примеси, а затем, при дальнейшем увеличении времени отравления т0, остается неизменной. После исключения яда из газовой смеси активность катализатора восстанавливается по кривой 2.
Кривая 3 соответствует необратимому отравлению. Вещества, необратимо отравляющие катализатор, нельзя
|
Рис. 2.26. Изменение константы скорости реакции во времени: 1 ■— при обратимом отравлении; 2 — при восстановлении активности (поступает без яда); 3 — при необратимом отравлении; Atq — период отравления, ^трег — период Регенерации активности |
|
Тг |
Кп
Применять при его изготовлении. Поэтому к чистоте сырьевых материалов предъявляют жесткие требования. Особенно приходится опасаться таких типичных ядов (для ряда процессов), как соединения серы, фосфора, мышьяка и др.
В некоторых случаях отравление катализатора обусловлено сорбционными и химическими процессами одновременно. Так, установлено, что при окислении S02 на ванадиевом катализаторе присутствие соединений мышьяка вызывает как необратимое (химическое), так и обратимое (сорбционное) отравление. Отравление в целом для этого случая относится к не полностью обратимому, т. е. после исключения яда (соединения мышьяка) из реакционной смеси активность катализатора восстанавливается лишь частично [19, 51].
Кумулятивное (накапливающееся) отравление выражается в прогрессирующей дезактивации катализаторов под действием малых количеств ядов, содержащихся в реагентах. Если яд хорошо поглощается катализатором, то для очистки реакционной смеси от кумулятивно действующего яда перед контактным аппаратом можно устанавливать дополнительные форконтакты, действующие как сорбенты ядов.
Прогрессирующие яды проявляют свое специфическое действие в виде ступенчатого замедления аналогичных превращений различных исходных веществ на одном и том же катализаторе по мере увеличения концентрации яда.
Механизм отравления связан с химическим составом катализаторов и соответственно типом катализа; он будет различен для электронного (гомолитического) катализа на полупроводниках и металлах и ионного (гетеролитического) катализа [40]. Наиболее сложен механизм отравления на металлических и полупроводниковых контактах [51]. Катализаторы полупроводникового типа более устойчивы к действию ядов, чем металлические. Это, видимо, связано с большим содержанием в полупроводниках различных примесей, вследствие чего дополнительное введение тех или иных добавок не приводит к сильному модифицированию свойств. Процесс отравления полупроводниковых контактов изучен значительно меньше, чем металлических [40].