ИССЛЕДОВАНИЕ СТРУКТУРЫ
Как уже отмечалось, к числу важнейших характеристик контактных масс относится их пористая структура — размер поверхности, суммарный обьем пор и их распределение по радиусам [20, 51, 216, 217].
Ниже приведены некоторые методы определения макроструктуры катализаторов. Все они достаточно надежны, не очень сложны, а потому с успехом могут быть применены на предприятиях, выпускающих конгакгныз массы, носители и сорбенты.
Адсорбция как способ определения поверхности
Тейлор отметил, что пятилетие с 1935 по 1940 г. дало науке о катализе метод, в котором она долго и сильно нуждалась. Этим методом является измерение поверхности катализаторов при исследовании физической адсорбции газов при температурах, близких к их точкам кипения.
Первое теоретическое уравнение, описывающее связь между количеством адсорбированного газа и его равновесным давлением при постоянной температуре, предложено Ленгмюром. При этом предполагалось, что адсорбция ограничена образованием мономолекулярного слоя и радиус действия поверхностных сил очень мал, а потому адсорбироваться могут только те молекулы, которые ударяются о чистую поверхность. Молекулы, ударяющиеся об уже адсорбированные молекулы, упруго отражаются и возвращаются
|
Рис. 5.4. Типы кзстсруы физической аде среди и паров |
В газовую фазу. Уравнение мономолекулярной адсорбции Ленг - мюра имеет вид:
5а. м = (а0т/п)/( 1 + а0тп). (5.12)
Здесь 5а. м — доля поверхности, покрытой адсорбированными молекулами; а0 — «коэффициент конденсации» на чистой поверхности (отношение числа неупругих столкновений, приводящих к адсорбции, к полному числу столкновений молекул газа с поверхностью); п — число адсорбированных молекул, покидающих единицу поверхности, т. е. десорбирующихся за единицу времени; т — число молекул, ударяющихся за единицу времени о площадь поверхности, равную единице.
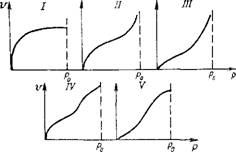
Уравнению Ленгмюра подчиняется только незначительное число изотерм адсорбции паров. Существует пять типов изотерм физической адсорбции паров (рис. 5.4) [20, 51].
Изотерма I соответствует мономолекулярной ленгмюровской, а изотермы II и III — моно - и полимолекулярной адсорбции. Изотермы II и III сходны с изотермами IV и V, но две первые указывают на бесконечное возрастание адсобции при приближении пара к насыщенному состоянию Р0, в то время как для последних двух типов изотерм максимум адсорбции почти достигается при давлениях меньше Р0. Изотермы IV и V отвечают случаям, когда мономолекулярная и полимолекулярная адсорбция сопровождаются капиллярной конденсацией.
Большинство паров имеет форму изотермы адсорбции типа II, по которой, используя теорию Брунауэра, Эммета и Теллера (БЭТ), можно определять удельную плещадь поверхности адсорбирующего твердого тела [20, 51]. Изотермы II характеризуют полимолекулярную адсорбцию. По теории полимолекулярной адсорбции предполагают, что молекулы паров адсорбируются поверх уже адсорбированных молекул. При этом сохраняется ленгмюров - ская концепция, которую Брунауэр, Эммет и Теллер распространили на второй и последующие адсорбированные слои молекул.
Уравнение БЭТ можно представить в виде [51, 216]:
Р _ 1__________ с— 1 р
|
(5.13) 243 |
|
16» |
V{P0 — P)~ vMc + vmC Po '
Рис. 5.5. Изотерма типа II
Здесь Р — равновесное давление; Р0 — давле - ние насыщенного пара адсорбата; v—объем адсорбированного вещества; ум и с — константы ^^^ уравнения БЭТ.
^ ' Хотя с и названа константой, нет ни
Одной изотермы адсорбции паров, для
__________________ которой значение с действительно по-
Р/ро стоянно во всем интервале давлений паров адсорбата от Р = 0 до Р = Р0, т. е. до насыщенного пара. Однако, для большинства изотерм адсорбции паров имеется участок, где с постоянно. Так, большая часть изотерм типа II подчиняется уравнению (5.13) при Р/Р0 = 0,05-=- - г0,35, т . е. когда 5а. м изменяется приблизительно от 0,5 до 1,5 [51, 2181. Статические и термодинамические выводы уравнения БЭТ показывают, что значение с зависит от изменения энергии Гиббса при переходе пара, находящегося в равновесии с жидкостью, на поверхность адсорбента; значение с определяет вид изотермы адсорбции. Если с > 2, то получаются S-образные изотермы типа II; если [с < 2, — изотермы типа III [51, 218]. Параметр с в первом приближении определяется выражением:
С = ехР[(<7,-<72)/(ЯГ)]. (5.14)
^ ^десь <7! — теплота адсорбции первого слоя; q2 —скрытая теплота конденсации адсорбата.
Для многих систем значения с известны [51, 218]. Параметр им характеризует количество молекул пара, которое необходимо, чтобы покрыть поверхность адсорбента плотным монослоем.
Получаемые экспериментально изотермы II часто имеют довольно большой прямолинейный участок (участок ВС, рис. 5.5)— особенность, которую нельзя непосредственно связать со свойствами уравнения БЭТ, дающего лишь точку перегиба. Точка, в которой начинается этот прямолинейный участок, названа Эмметом и Брунауэром «точкой В». Ими принято, что эта точка указывает на окончание заполнения монослоя, поэтому вместимость в точке В (vB) равна вместимости монослоя (ум). Точность определения положения точки В зависит от крутизны изгиба изотермы [219]. При резком изгибе кривой (что соответствует большим значениям параметра с) положение точки В легко определяется даже при коротком линейном участке. Если подъем изотермы пологий, определить положение точки В трудно или вообще невозможно.
|
(5.15) |
Удельная площадь поверхности 5уд (ма/г) адсорбента связана с вместимостью монослоя vM (г адсорбента на 1 г твердого тела) следующим уравнением:
S7X = (vmIM) NSm. Ю-2».
Здесь М — молекулярная масса адсорбата; N — число Авогадро; SM — площадь поперечного сечения молекул адсорбата (площадь, занимаемая адсорбированной ^молекул ой на поверхности твердого тела в заполненном монослое), нм2.
Значения SM рассчитаны из предположения, что молекулы представляют собой сферы, образующие гексагональную упаковку [51]. Принято также, что плотность адсорбата на поверхности равна плотности соответствующего жидкого или твердого вещества, взятого при температуре измерения адсорбции [51, 218]. Чаще всего при определении удельной площади поверхности в качестве адсорбата используют азот, и значение SM для него принимают равным 1,62 нм2. В ряде работ [51, 220] имеются указания на то, что SM для азота при —195 °С может изменяться от 1,45 до 1,9 нм2 на молекулу на разных поверхностях вследствие различий в ориентации, упаковке и силе взаимодействия с поверхностью. При адсорбции азота, как правило, получаются изотермы типа II с крутым изгибом, при этом значение vu, рассчитанное с помощью уравнения БЭТ, и значение ив очень близки. Поэтому азот представляется особенно удобным адсорбатом, позволяющим проводить экспериментальную проверку правильности определения удельной площади поверхности путем расчета по изотерме адсорбции [219].