Синтез карбамида на основе оксида углерода
Для промышленного производства карбамида применяется только синтез из NH3 и С02 по реакции Базарова. Однако, существует множество принципиально иных методов получения карбамида. Основная часть их не имеет какого-либо практического значения, и лишь способы синтеза карбамида на основе реакций оксида углерода (и его производных) с аммиаком занимают особое место. Физико-химические основы этих процессов и возможные пути их инженерного оформления были объектом изучения в течение всего периода развития химии и технологии получения карбамида. Хотя ни один из этих способов до сих пор не нашел промышленного воплощения, данное направление продолжает сохранять определенную перспективу. К этому имеются следующие предпосылки.
Как известно, в современных производствах аммиака для получения водорода используют процессы термоокислительного разложения углеводородного сырья. Образующиеся в результате конверсии углеводородов газы кроме Н2 содержат СО и (в меньшем количестве) С02. Оксид углерода, содержащийся в газовой смеси, подвергают конверсии с водяным паром с получением Н2 и С02. После отмывки С02 водород используют для синтеза NH3, а С02, выделенный при регенерации поглотительного раствора, — для синтеза карбамида.
Цепь превращений СО характеризуется, таким образом, последовательностью уравнений:
TOC \o "1-3" \h \z СО + Н20-> С02 + Н2 (Х.1)
ЗН2 + N22NH3 (Х.2)
СОа + 2NH3 -»• СО (NH2)2 + Н20 (Х. З)
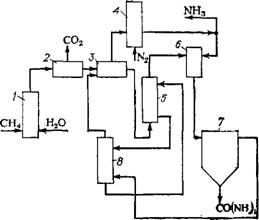
Можно, однако, иначе организовать производственный комплекс аммиак-карбамид, исключив из предыдущей системы уравнений (Х.1)—(Х. З) стадию конверсии СО и получая карбамид из СО и NH3. Этот принцип положен в основу процесса [24], упрощенная технологическая схема которого изображена на рис. Х.9. Согласно этой схеме природный газ конвертируют с водяным паром в узле 1 и после освобождения конвертированного газа от С02 в узле 2 разделяют его в узле 3 (например, с помощью медно - аммиачных растворов) на поток Н2 и поток СО. Водород используют в узле 4 для синтеза аммиака. СО из узла 3 через десорбер 5 подают в узел синтеза карбамида 6, куда вводят также NH3 из узла 4. Полученный карбамид отделяют от газов в узле 7, поглощают NH3 водным сорбентом в абсорбере 8, а смесь СО и Н2 из абсорбера возвращают в узел разделения 3. Из раствора, полученного в абсорбере, отгоняют NH3 в десорбере 5, куда подают СО. Газы из десорбера, как уже говорилось, подают в узел синтеза карбамида 6. 308
Изложенная система организации комплекса аммиак-карбамид имеет определенные преимущества по сравнению с традиционной системой. В этом случае в приведенной выше последовательности уравнений (Х.1)—(Х. З) реакции (X. 1), (Х. З) заменяются процессом: СО - f 2NH3->CO (NH2I2 + Н2 (Х.4)
В отношении сырьевого баланса производственного комплекса эта замена эквивалентна: на каждый моль имеющегося СО продуцируются моль карбамида и моль водорода. Однако замена эта позволяет в принципе отказаться от стадии конверсии СО при производстве аммиака, регулируя условия конверсии углеводородного сырья так, чтобы соотношение СО : С02 в полученном газе было максимальным.
Рассмотрим вопрос о целесообразности такой замены. Очевидно, определенные выгоды можно получить лишь при условии, если затраты на производство карбамида из СО и NH3 не будут заметно превышать затраты на получение его из С02 и NH3. Возможности выполнения этого условия до сих пор не найдены, о чем свидетельствует то, что до сих пор промышленные процессы получения карбамида на базе СО отсутствуют.
Вместе с тем, синтез карбамида по реакции (Х.4) принципиально отличается от реакции Базарова еще и тем, что позволяет организовать полностью безотходное производство, единственным конечным продуктом которого является карбамид. В самом деле, для получения СО можно использовать процесс [25 ] высокотемпературной конверсии метана при неполном его горении в воздухе, обогащенном 02. Этот процесс протекает по основному уравнению:
CH4 + - g-Oa-CO + 2Ha ' ' (Х.5)
Суммируя (Х.2), (Х.4), и (Х.5), получим:
|
Рис. Х.9. Схема кооперирования производства карбамида из СО с производством NH3 [1]: 1 — узел конвертирования природного газа; 2 — узел очистки конвертированного газа от С02; 3 — узел отделения СО от Н2; 4 — узел синтеза NH3; 5 — десорбер NH3; 6 — узел синтеза карбамида из СО и NH3; /—узел выделения карбамида из газов его син* теза; 8 — абсорбер NH3. |
CH4+-i-02 + N2^C0(NH2)2 (Х.6)
Уравнение (Х.6) отражает тот факт, что в комплексе, включающем указанный процесс конверсии метана, синтез аммиака и синтез карбамида из СО и NH3, все материальные потоки замкнуты.
Если уравнение (Х.5) суммировать с уравнениями (Х.1)— (Х. З), то мы также приходим к уравнению (Х.6). Однако использование в реакции (Х.1) воды, выделенной по реакции (Х. З), затруднено в связи с ее загрязнением карбамидом и аммиаком. Поэтому синтез карбамида по реакции Базарова нельзя в полной мере считать безвыбросным в отличие от процесса по уравнениям (Х.2), (Х.4), (Х.5). Перспективность последнего обусловлена также усложнением проблем водоснабжения и защиты от загрязнений водоемов во всем мире.
Взаимодействие СО и NH3 с получением карбамида изучено далеко не так подробно, как реакция Базарова.
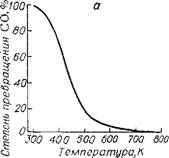
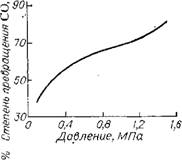
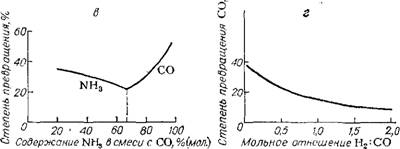
Термодинамический анализ системы, образующейся при синтезе карбамида из СО и NH3 [26], позволил рассчитать зависимость степени превращения исходных реагентов в карбамид от различных факторов (рис. Х. Ю): температуры, давления, соотношения исходных реагентов, содержания в реакционной смеси водорода и инертных примесей (влияние последних на рисунке не показано).
Из рис. Х. Ю видно, что для осуществления процесса с термодинамической точки зрения благоприятны температуры до 500 К, давление 0,1 —1,5 МПа, мольное соотношение NH3 : СО = 4—6. Присутствие водорода в исходной смеси сильно понижает выход карбамида; действие инертных примесей (азота) значительно слабее.
Рассчитанное [27] изменение энтальпии для реакции (Х. З) при 400 К составляет — 123,1 кДж/моль, что примерно в 1,5 раза выше, чем для реакции Базарова. Отсюда следует, что потенциальные энергетические возможности процесса синтеза карбамида из СО не ниже, чем в обычном процессе.
Известные способы получения карбамида непосредственным взаимодействием NH3 и СО предусматривают использование катализаторов или иных активирующих процесс средств. Предложено, например, получать карбамид при 355—525 К и давлении выше 10 МПа в присутствии никеля, кобальта, железа или их карбонилов, а также ванадия, вольфрама, молибдена, марганца [28]. Катализаторы для этих способов могут быть нанесены на активную окись алюминия. Указано, что небольшие добавки С02 и паров воды интенсифицируют протекание реакции, однако какие-либо количественные данные о выходе карбамида отсутствуют.
Имеются сведения об образовании карбамида из СО и NH3 в присутствии соединений одновалентной и двухвалентной меди [29].
Ряд патентных публикаций содержит описание способов получения карбамида на катализаторах, содержащих благородные металлы: Pd или его соединения — при Т = 275—475 К и Р > 10 МПа, соединения 1г или Rh, металлическую Pt на носителях при Р < 2 МПа и Т = 475—625 К [30]. В последнем случае степень превращения СО в карбамид в присутствии 100% избытка NH3 сверх стехиометрического количества составляет 15—45%.
Описаны также способы получения карбамида под воздействием облучения. Так, под действием УФ-радиации с длиной волны 253,7 нм в присутствии следов ртути из СО и NH3 образуется карбамид [31]. При облучении смеси СО и NH3 водородной лампой (длина волны 190—280 нм) в продуктах реакции кроме карбамида найдены цианистый водород и гексаметилендиамин [32]. Протекание реакций объясняют образованием свободных ЫН2-радикалов под воздействием облучения.
Фотохимическое образование карбамида имеет место и при взаимодействии карбонила железа с аммиаком [33], сопровождающемся образованием светочувствительного комплекса Fe(CO)6- NH3, разлагающегося по реакции:
2 [Fe (CO),-NH„I -> СО (NH2)2 + Н2 [Fe (СО)4) + Fe (СО)6 (Х.7)
Карбонилы железа, впрочем, взаимодействуют с жидким аммиаком и в отсутствие облучения [34], однако с весьма малыми выходом и скоростью.
Равновесие реакции (Х.4) может быть смещено, если проводить ее в присутствии акцепторов водорода — ароматических нитросоединеиий, которые восстанавливаются с образованием аминов [35]. Процесс одновременного получения карбамида и аминов проводят в инертном растворителе и в присутствии катализатора дегидрирования при 365—420 К и 2—7 МПа.
Карбамид может быть получен при взаимодействии СО не только с NH3, но и с гидразином, предпочтительно в присутствии катализатора [36].
Из числа других способов синтеза карбамида на основе СО следует отметить получение его через тиокарбамат аммония по реакции:
|
|
|
|
|
А —- температуры при мольном соотношении NH3 : СО = 4 и ОЛ МПа; б — давления при мольном соотношении NH3 : CO = 4 и 460 К; в — состава смеси при 0,1 МПа и 460 К (левая ветвь — степень превращения NH3); г — отношения Н2 : СО в исходной смеси при мольном соотношении NH3 : СО —4, 460 К и 0,1 МПа. |
|
Рис. Х. Ю. Зависимость степени превращения СО в карбамид от: |
СО + S + 2NH3 ^$H2N — СО — SNH4 СО (NH2)2 + H2S (Х.8)
Хотя-исследованию этого процесса было посвящено значительное количество работ [37] и предложены рациональные технические решения [38], процесс пока не пашел промышленного воплощения.
[1] В отечественных изданиях все чаще используют другой термин — карбамид, который отражает природу и строение этого вещества.
[2] Первая попытка описания равновесия реакции Базарова была предпринята крупным американским физико-химиком Льюисом еще в 1912 г.
[3] Предложено И. Р. Крнчевским и Г. Д. Ефремовой.
[4] Величины xf находим по уравнениям (1.1). Поскольку вода в данной системе не является компонентом, Nf в газовой фазе вычисляем следующим образом:
^N Н'
Нз "NH3+"CO2 СОг NH*
[5] Различие Ркр и существующего Р составляет 17% и не представляется значительным, так как РКр сильно чувствительно к изменению L [10, 11]: на - ' пример для AL = 1 в области 4< L< 5 ДРкр « 10 МПа.
[6] В литературе описано применение предельного варианта теории Дебая— Хюккеля без всякого доказательства правомерности таких попыток для данной системы [3 ]. '
[7] v — число обменов поверхности контакта фаз в единицу времени — экспериментально определяемая мера интенсивности перемешивания смеси [21, 24].
[8] При 438 и 446 К величина kc слабо зависит от v, поэтому Ас вычисляют со значительной погрешностью. В этом случае kc =а kx с при V = 180 ч-1 с подстановкой значений [26].
[9] О
Рсм — Рс*
[10] Испытания проведены Ю. К. Мельниковым, В. А. Бордуковым и др.
[11] Испытания проведены Н, А. Орловой, Н. В. Симагиным и др.
(111.15)
(111.16)
(111.17)
(111.18)
(111.19)
[13] 1-І 2 О
Для 70—99 °С
[14] В отличие от воды, образующейся при дегидратации H2NCOONH4 и содержащейся в плаве синтеза (до и после дистилляции, а также перед выпаркой), вода в составе всех прочих потоков (включая и конденсат сокового пара) является внешней.
[15] На некоторых установках предусматривают разбавление азотом до дросселирования.
[16] Условно принято, что вся н20 из плава синтеза отгоняется на стадии выпарки.
[16] Указанные на рис. IV.7 значения давления в тексте данного раздела округлены.
6* 163
[17] Содержание свободного NH3, не более, % . . .
[18] Europ. Chem. News, 1969, v. 15, № 363, Urea Suppl. Process Surv.; Hydrocarb. Proc., 1975, № 11, p. 211. 2. Kaasenbrood P. J. C., Logemann J. D. — Hydrocarb. Proc., 1969, v. 48, № 4, p. 117. 3. Salces A.— Rev. techno]., 1975, v. 13, № 1, p. 21. 4. Логеманн Дж. Д. — В кн.: Второй Межрегиональный симпозиум по удобрениям. Киев. Укр. НИИНТИ, 1971; Chem. Age, India, 1971, v. 22, № 12, p. 992. 5. Рабинович Г. Л. Технология мочевины и удобрений на ее основе, М„ ВИНИТИ, 1971. 6. Fidler Я. К., BressD. F. — AIChE, Symp. Ser., 1973, v. 69, № 135, p. 99. 7. Guadalupi M., Zardi U. — Hydrocarb. Proc,, 1965, v. 44, № 7, p. 131. 8. Payne A. J., Canner J. A. — Chem. and Proc. Eng., 1969, v. 50, № 5, p. 81. 9. Zardi U„ Ortu F. — Hydroc. Proc., 1970, v. 49, № 4, p. 115. 10. Zardi U. — В кн.: Второй Межрегиональный симпозиум по удобрениям. Киев. Укр. НИИНТИ, 1971.
[19] Адиабатической называют температуру, которая установилась бы в грануле в результате ее адиабатического термостатирования в конце полета [49].
[20] Испытания проведены H. Л. Орловой и др.
[21] Испытания проведены А. И. Гусевым и др.
[22] Здесь и далее знаки тепловых эффектов даны в термодинамической системе.
[23] Дефектными считаются гранулы, внутри которых содержится газовый пузырек и поверхность которых испещрена трещинами.
[24] Индексы ді, дії означают соответственно I и II ступени дистилляции.
267
[25] Выработка — среднеарифметическое двух различных замеров.