ВРЕДНЫЕ ПРИМЕСИ
/^лово «вредный» обычно у нас отождествляется с вред - ^ ным влиянием на здоровье человека. Однако машины, агрегаты и всякие технические устройства тоже могут подвергаться вредным влияниям окружающей их среды. Кислород, содержащийся в воздухе, ежегодно разрушает миллионы тонн железа, добываемого человеком. Кислоты и щелочи, применяемые во многих химических процессах, разъедают аппаратуру и приводят в негодность реакторы, трубопроводы и другие важные детали промышленных установок.
Существуют такие природные вещества, которые ничего не разрушают, ничего не разъедают и все же со временем могут сделать невозможным вести тот или иной технологический процесс.
Возьмите металлический чайник. Загляните в него — сколько накипи на его стенках! Стенки не испорчены накипью, но она, обладая плохой теплопроводностью, заставляет вас вставать немного раньше. Для приготовления чая требуется уже больше времени: в старом чайнике вода вскипает не так скоро, как в новом.
Но в промышленности накипь опасна.
Взрыв котла, разрушение здания, гибель людей — вот к чему может привести накипь в современных паросиловых установках высокого давления.
В паровых котлах тепло передается воде через стенки стальных труб. Сталь хорошо проводит тепло, и трубы не перегреваются во время работы. Но соли кальция, магния и кремневой кислоты (накипь) постепенно отлагаются на стенках труб. Теплопередача ухудшается, стенки труб не успевают отдавать воде все тепло и начинают понемногу раскаляться: ведь в современных котлах температура воды под давлением может достигать нескольких сот градусов. Раскаленная сталь теряет свою прочность, и огромное давление пара распирает трубу, сначала немного, потом все больше и больше — и вдруг труба ломается. Авария. И все это сделали соли, присутствующие в воде.
Как бороться с этим злом? Ответ ясен: нужно удалять из природной воды соли, могущие образовать накипь в котлах.
Одним из способов обессоливания воды является ее перегонка. До сих пор на многих паросиловых станциях работают перегонные установки, в которых получают дистиллированную воду, идущую для питания котлов. «Но разве это решение вопроса? — скажете вы.— Ведь в перегонных аппаратах тоже будет получаться накипь, она будет причинять тот же вред, что и в котлах».
Это не совсем так. Накинь, конечно, образуется и в перегонных установках. Но эти установки работают не под таким высоким давлением, как паровой котел, и очистка их от накипи предусмотрена более простым способом. Далее, в дистилляторах воду никогда не выпаривают до конца и не осаждают все содержащиеся в ней соли. И все-таки не кажется ли вам этот способ обессоливания воды каким - то архаичным, устаревшим? Ведь современный паровой прямоточный котел системы Рамзина может испарять 300—400 кубометров воды в час. Какие же перегонные установки могут питать такой котел?
Вы ожидаете, что я сейчас предложу вам адсорбционный способ обессоливания воды. Ну, конечно, ведь эта книжка посвящена вопросам адсорбции. Какой адсорбент мы с вами выберем для поглощения солей, содержащихся в природной воде? Уголь или силикагель? Может быть, какие-нибудь активные глины и земли?
Увы, все это не так просто. Дело в том, что активированный уголь, так хорошо сорбировавший парообразные вещества, очень плохо поглощает соли кальция и магния из водных растворов и совсем практически не поглощает кремневую кислоту. А силикагель совершенно не поглощает этих солей из растворов их в воде.
Нужно искать что-то другое. И это «другое» было замечено сравнительно давно в некоторых природных адсорбентах. Зеленоватый песок, так называемый глауконитовый песок, состоит из мельчайших кристалликов, в структуре которых имеется ион натрия.
Ионами называются атомы, несущие электрический заряд. Атом (или группа атомов) с положительным зарядом называется катионом, а с отрицательным зарядом — анионом. Молекула поваренной соли (хлористого натрия) электрически нейтральна. Однако, если растворить соль в воде, молекула распадется на положительно заряженные ионы натрия (катионы) и отрицательно заряженные ионы хлора (анионы). Если в стакан с раствором соли опустить две металлические пластинки, соединенные с источником тока (батареей), то, как показывает опыт, катионы начнут передвигаться к отрицательному полюсу (катоду), а анионы — к положительному (аноду). Кстати, отсюда, от этого передвижения произошло слово «ион», что по-греческц значит «идущий».
Так как в кристаллической решетке атомы связаны между собою электрическими силами, то они тоже не нейтральны: в решетке не атомы, а ионы. В кристаллической решетке глауконитового песка ион натрия (катион) оказывается настолько «подвижным», что при известных условиях может быть замещен на ион кальция или магния (тоже катионы). Если через слой такого песка пропускать воду, содержащую соли кальция и магния — так называемые «соли жесткости», то наступает процесс замещения, обмена, проходящий по схеме:
(глауконит-натрий) + ион кальция—►
—^(глауконит-кальций) + ион натрия.
«Ну и что же,— скажете вы,— разве мы обессолили воду? Вместо солей кальция мы получили такое же количество солей натрия!» Вы правы, воду мы не обессолили. Однако вспомните, что накипь образуется потому, что углекислый кальций нерастворим в воде и осаждается на стенках сосуда. А соли натрия хорошо растворимы в воде и ни при каких условиях не'образуют осадка, разве уж если мы вздумаем выпаривать воду в котле досуха. Кроме того, чтобы не слишком повышать концентрацию солей, котел подвергается периодической «продувке», то есть в нем сменяют слишком засоленную воду на свежую.
Что же делать с отработанным слоем глауконитового песка? Выбрасывать его и заменять новым? Конечно, нет; в том-то и вся ценность адсорбционных процессов, что они допускают регенерацию (восстановление) отработанных сорбентов.
В предыдущем разделе мы говорили о регенерации (восстановлении) слоя угля, поглотившего пары бензина, продувкой его горячим водяным паром. Здесь же, в случае адсорбции из растворов, можно поступить проще. Через отработанный слой глауконита пропускают раствор поваренной соли, причем идет реакция обратного замещения: (глауконит-кальций) + ион натрия—>
—► (глауконит-натрий) -}“ ион кальция.
Регенерирующий раствор, содержащий ионы кальция, сбрасывается в канализацию, а слой глауконита снова готов к работе.
Кроме глауконитового песка, в природе имеются и другие адсорбенты, могущие служить для той же цели, но все они имеют общий недостаток: их поглотительная, или, как принято говорить, обменная емкость, сравнительно мала. Кроме того, как мы увидим дальше, присутствие в воде даже солей натрия не всегда допустимо.
Современная техника пошла по пути приготовления искусственных, синтетических ионообменных адсорбентов (катионитов и анионитов).
Некоторые сорта каменных углей, обработанные при повышенной температуре крепкой серной кислотой, превращаются в отличные ионообменные адсорбенты, так называемые сульфоугли. После такой обработки органическое вещество каменного угля содержит подвижный ион водорода (катион), могущий обмениваться на ионы (катионы) различных металлов. Реакции обмена с таким суль - фоуглем будут проходить по следующей схеме: (сульфоуголь-ион водорода) -|- ион кальция—
—* (сульфоуголь-ион кальция) -|- ион водорода.
Эта реакция обратима, то есть, ион кальция может быть снова заменен на ион водорода, что достигается промывкой слоя сульфоугля довольно слабым (5°/о-ным) раствором кислоты. Таким образом, один и тот же слой может быть использован много тысяч раз в течение многих лет.
Каменный уголь — материал, образовавшийся в течение миллионов лет в природных условиях, без участия человека. А нельзя ли без каменного угля изготовить ионообменный материал? Можно. Знаете ли вы, что такое синтетические смолы? Не говорите, что не знаете. В наше время мы постоянно соприкасаемся с изделиями из них - г - с «пластмассами». Так вот, некоторые синтетические смолы, особо обработанные или видоизмененные в процессе их синтеза, являются отличными ионообменными адсорбентами. Ионообменный адсорбент можно приготовить из такого сырья, как отработанная автомобильная покрышка, остатки от производства органического стекла (плексигласа) и т. д.
Однако гораздо выгоднее не пользоваться продуктами отброса, а синтезировать специальные ионообменные адсорбенты. Они, правда, обходятся дороже в производстве, но прибыль при эксплуатации их покрывает все расходы. Да и стоит ли убеждать вас в преимуществах синтетических ионообменных смол? Инженеры, хорошо знающие «проверку рублем» своего производства, сказали бы вам об этом более убедительно.
Для получения простейшей синтетической ионообменной смолы можно взять два довольно хорошо известных вещества: фенол (называемый карболовой кислотой) и формальдегид (называемый формалином). Вот их химические формулы:
НС СН формальдегид
Фенол
Здесь формула фенола выглядит в виде шестиугольника, так ее всегда рисуют химики. У каждого атома углерода имеются четыре валентные связи, обозначаемые черточками. Три из них связывают соседние углеродные атомы, а одна показывает присоединение атома водорода (Н) или гидроксильной группы (ОН). При замене одного из атомов водорода фенола на сульфогруппу (БОзН) получается сульфофенол, из которого при соединении с формальдегидом получается твердый, стеклообразный продукт — суль- фофенольная смола. В этом веществе водородный атом сульфогруппы ЭОзН является подвижным атомом, образующим в водном растворе ион водорода (катион), могущий заменяться на ионы (катионы) магния, кальция, меди и т. д.
Твердую сульфофенольную смолу дробят на мелкие кусочки, отсеивают от пыли и помещают в колонку. Через эту колонку и пропускают раствор, который хотят очистить от вредных примесей. Время от времени смолу подвергают регенерации, то есть ее промывают слабым раствором кислоты.
Таким образом, в настоящее время мы имеем возможность искусственно получать различные ионообменные смолы в больших количествах.
Мы отметили, что при помощи ионообменных смол или сульфоугля нельзя обессолить воду, а можно только заменить вредные соли жесткости (кальций и магний) на безвредные для паровых котлов — соли натрия, хорошо растворимые и не дающие накипи.
Однако такая вода непригодна для современных прямоточных паровых котлов. В этих котлах испаряется не часть воды, накачиваемой в котел, а вся вода, подаваемая в накаленные трубы. Ясно, что на стенках труб будут оставаться все соли, заключавшиеся в воде. Инженеры предъявляют очень жесткие требования к воде, питающей прямоточные котлы. Количество сухого остатка после выпаривания должно составлять не более двух десятых миллиграмма на литр. Такой воде могут позавидовать многие аналитические лаборатории, которые, как известно, применяют в анализах исключительно дистиллированную воду.
Но и при таком количестве сухого остатка в трубах котла, испаряющего в час 400 тонн воды, за одни сутки скопится около двух килограммов накипи. А сколько это будет за неделю, за месяц? Потребуется очистка котла, иначе дело может дойти до аварии.
Котел, конечно, можно поставить на ремонт и чистку. Но как поступать с паровой турбиной, остановка которой экономически чрезвычайно невыгодна? «При чем же тут турбина? — спросите вы.— Ведь вода испаряется в котле, а в турбину идет только чистый пар». Вот в том-то и дело, что технический пар — не чистый пар. При высокой температуре испарения воды кремневая кислота, содержащаяся в природной воде, растворяется в водяном паре и с ним летит из котла в турбину. Там кремневая кислота оседает на лопатках рабочего колеса, лопатки загрязняются, ухудшается их обтекаемая форма, и в результате уменьшается коэффициент полезного действия всей паросиловой установки. Вот какая коварная вещь эта кремневая кислота.
Кремневая кислота — слабая кислота, как ее характеризуют химики. Ее кислотный остаток, анион БЮз", не поглощается ни сульфоуглем, ни ионообменными смолами (катионитами). Ничего удивительного в этом, конечно, нет: и сульфоуголь, и смолы являются катионообменными сорбентами, подвижный ион водорода (катион) этих обменников может замещаться только ионами (катионами) металлов.
Нельзя ли для данного случая придумать, изготовить и применить вещества, которые обладали бы способностью обменивать не катионы, а анионы? Да, можно. Подобные вещества давно уже синтезированы и находят широкое применение, и названы они анионообменными сорбентами или просто анионитами.
Аниониты представляют собою также синтетические смолы, у которых подвижным ионом является не ион водорода, а ион гидроксила (ОН — анион). Этот ион характерен для щелочей. Этот подвижный анион может обмениваться на другие анионы, находящиеся в растворе. Реакция будет проходить по следующей схеме:
(смола-ион гидроксила) + анион кремнекислоты —
—^(смола-анион кремнекислоты) + ион гидроксила,
Нужно заметить, что изыскание способов синтеза анионита, хорошо поглощающего именно кремнекислоту, продолжалось довольно долго и закончилось успешно.
Теперь в наших руках имеется простой способ полного удаления всех солей и кислот из воды. Посмотрим, как это осуществляется на примере удаления соли из раствора хлористого натрия, который, как известно, образует при растворении в воде ион натрия (катион) и ион хлора (анион).
Наполним колонку зерненым катионитом и будем фильтровать через него воду. Схема реакции нам уже знакома:
(катионит-ион водорода) + ион натрия + ион хлора—
—►(катионит-ион натрия) -4-ион водорода ион хлора
Ч _ . / ^__ - - /
В колонке в растворе
Обратите внимание на то, что в профильтрованном растворе содержатся ионы водорода и хлора, то есть мы получили раствор соляной кислоты. Пропустим теперь
|
|
ОН^ОН* он' он' |
|
НЩРн НЩРн Н *- н Н |
|
|
С1С1‘ СГ^С1/ Сь' сг а* С1* |
|
V N0 . N0 у . , |Г— нд |
|
1сг, А У . |------ н, оН Чистая вода |
|
6) Поглотились анионы СУ |
|
Рис. 13: Схема работы ионообменнйка в процессе обессоливания воды. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
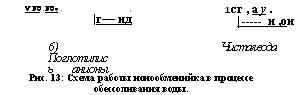 |
Полученный раствор через колонку с анионитом, содержащим подвижный гидроксильный ион:
(анионит-ион гидроксила)-|- ион водорода + ион хлора—►
—Цанионит-ион хлора) +ион водорода -|- ион гидроксила
X— > V у
----- V— —'V— —
В колонке в растворе
Но ион водорода и ион гидроксила образуют воду. Последовательным фильтрованием раствора хлористого натрия через колонки с катионитом и анионитом мы удалили соль из раствора, то есть получили без перегонки «дистиллированную воду».
Весь этот процесс изображен схематически на рис. 13 в виде трех последовательных стадий А, б и в. В колоннах нарисовано только по нескольку зерен ионообменников с сидящими на поверхности их ионами.
Как же поступать с отработанными слоями зерен, когда они почти полностью насытятся соответствующими ионами, как их регенерировать (восстановить)? Да очень просто: слой катионита промывают слабым раствором кислоты, а слой анионита — слабым раствором щелочи. После промывки водой для удаления остатков кислоты и щелочи ионообменники снова готовы к работе.
Такова схема приготовления чистейшей воды для современных прямоточных котлов. Разумеется, в действительности технологические установки гораздо сложнее, но принципиально они ничем не отличаются от этой схемы.
Адсорбционные процессы привлекательны тем, что в них не участвуют сложные механизмы и машины, здесь все основано на действии невидимых молекулярных сил притяжения.
Конечно, адсорбционные установки содержат большое количество резервуаров, поглотительных колонн, труб, вентилей и т. д. Но это, так сказать, вспомогательные детали, без них обойтись нельзя. Нельзя обойтись и без источников энергии, иначе мы с вами получили бы «перпетуум моби - ле» — вечное движение, что, как давно уже доказано наукой, невозможно.
Вспомните, что для того, чтобы десорбировать пары, поглощенные углем или силикагелем, нужно было продувать слой сорбента горячим паром. А чтобы получить пар, нужно затратить топливо. Таким образом, адсорбционные установки представляют собою тоже «тепловые машины», но без движущихся частей. В этом отношении они похожи на дистилляционные устройства, где топливо идет только на получение пара.
Ну, а ионообменные установки? Ведь в них не применяется никакого процесса выпаривания, не расходуется ни грамма топлива. Вот это последнее обстоятельство сразу и сказывается на экономике процесса. Чистая вода на этих установках получается в десятки раз дешевле, чем на выпарных установках. Но, во-первых, умягчение воды еще не является ее обессоливанием, а во-вторых, здесь мы не выделяем каких-либо продуктов в чистом виде. Вот, когда дело доходит до полного обессоливания воды и до регенерации сорбентов, тогда уже приходится применять и дорогостоящие реактивы (химикалии), на получение которых нужно было затрачивать энергию. И все же обессоленная путем ионного обмена вода гораздо дешевле дистиллированной, так как самый дорогой процесс — выпаривание — исключается.
Применение ионного обмена исключительно многообразно. Вот перед вами обычный кусок сахара. Смотрите, как блестят мельчайшие кристаллики, из которых он сложен. Голубовато-белый блеск, синева в тенях — как это привлекательно и вкусно! Привлекательность пищевых продуктов обязана большой заботе технологов.
Молодые читатели этого не знают, а те, кто жил до революции, помнят, как в религиозные праздники, например, в «великий пост», в продаже появлялся так называемый «постный сахар»—мягкие кристаллические кусочки сахара, окрашенные в розовый, желтый и зеленоватый цвета. Почему этот сахар был окрашен? При очистке сахарных сиропов их и прежде пропускали через адсорбент — костяной уголь. При этом сахарный сироп превосходно очищался, окрашивающие его примеси органических веществ хорошо сорбировались на угле. Однако фильтровать сахарный сироп через уголь животного происхождения считалось предосудительным во время соблюдения религиозного поста. Желтизну же продукта приходилось маскировать какой-либо безвредной краской. Таким образом, «постный сахар» являлся попросту неочищенным сахаром.
В настоящее время производственные сахарные сиропы, имеющие желтоватую окраску, обусловленную присутствием органических веществ, фильтруют через слои активированного угля. Уголь, как вам уже известно, прекрасно поглощает растворенные органические вещества.
Сахарная промышленность является очень крупным потребителем активированного угля.
Однако уголь поглощает из сахарных сиропов только красящие вещества. А как влияют на свойства сахара растворенные в воде различные соли? Оказывается, что кальциевые соли придают готовому продукту, уже очищенному активированным углем, некрасивый сероватый цвет. С этим можно было бы мириться, но дело в том, что сахар образует с солями кальция химическое соединение — са- харат кальция. Это вещество хорошо растворимо в воде, и при кристаллизации сахара значительное его количество остается в растворе, что вызывает большие потери готового продукта. Что же делать? Очищать воду, применяемую в производстве, от кальциевых солей? Этого недостаточно, так как много кальция вносится и со свеклой, и в некоторых технологических операциях.
Вот тут на помощь и приходит ионный обмен. Ионообменными адсорбентами из сахарных сиропов могут быть извлечены кальциевые соли. Казалось бы, не очень сложная операция, а в результате ее осуществления выход готового продукта может быть в некоторых случаях увеличен на 6—8 процентов, и все это при тех же самых посевных площадях сахарной свеклы!
При помощи ионного обмена можно извлекать из воды не только кальций и магний, но и другие металлы, попадающие в воду в различных производствах. В производстве искусственного шелка в сточные воды уходит довольно большое количество солей меди. Помимо того, что это представляет опасность загрязнения водоемов, с экономической точки зрения выбрасывание цветного металла недопустимо. Ионный обмен позволяет улавливать и возвращать в производство все медные соли. Подсчитано, что, затратив при эксплуатации ионообменной установки на регенерацию смолы один литр серной кислоты (один литр кислоты стоит около одного рубля), можно получить столько же меди, сколько ее получится при выпаривании 4,2 тонны раствора, что обойдется не менее 200 рублей.
Сточные воды фабрик, производящих кинопленку, содержат некоторое количество солей серебра. Ионообменные установки на фабрике в Вольфене (Германская Демократическая Республика) извлекают из сточных вод от трех до шести килограммов серебра в день. Очень много серебра можно получать из сточных вод кинофабрик, так как при фиксировании проявленной пленки из светочувствительного слоя переходит в раствор значительное количество бромистого серебра.
Блестящие детали автомобилей, радиоприемников, бытовых приборов — все это заставляет промышленность применять огромные количества солей хрома для создания хромовых покрытий. Электролитические' хромовые ванны непрерывно требуют возобновления. Отработанные растворы хромовых солей пропускают через ионообменные колонны, в которых задерживаются соли хрома и вновь возвращаются в производство.
Самое замечательное то, что принцип ионного обмена универсален. Подбирая подходящие условия, можно извлекать из растворов любые катионы и анионы. Не нужно только думать, что все это делается так легко. Дело в том, что одни ионы мешают поглощению других, вытесняют их с поверхности сорбента, образуют нерастворимые соединения и т. д. Научная мысль упорно работает именно в направлении подчинения процессов ионного обмена задачам техники и технологии производств.
Сейчас при помощи ионитов мы можем извлекать из производственных растворов серебро, золото, платину, молибден, никель, цинк и много других металлов, уходивших ранее вместе со сточными водами безвозвратно.

