АДСОРБЦИЯ
|
М |
Ы всегда стараемся понять явления, которые наблюдаем в природе. Почему же пары бензина, нафталина, духов и аптечных лекарств задерживаются на ткани и вообще на всяких поверхностях?
Вопрос этот довольно сложный. Нам придется вспомнить, как в настоящее время ученые разъясняют строение твердого вещества. Все вещества — дерево, металл, ткани, песок, уголь — состоят из мельчайших кристаллов той или иной формы. Уголь состоит из кристаллов углерода, песок — из кристаллов двуокиси кремния, железо — из кристаллов железа и соединения железа с углеродом и другими веществами. Наш всегдашний спутник — поваренная соль — состоит из кристаллов хлористого натрия.
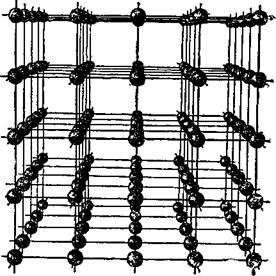
Кристаллы веществ построены из атомов. В кристалле поваренной соли, например, имеются атомы металла натрия и хлора. Кристаллики поваренной соли прочны, они не рассыпаются сами собой. Эта прочность обусловлена тем, что атомы, составляющие кристалл, притягиваются друг к другу электрическими силами. Атом натрия в кристалле имеет положительный электрический заряд, а атом хлора — отрицательный. Противоположные заряды, как известно, притягиваются друг к другу. На рис. 1 показано, как из взаимно притягивающихся друг к другу атомов натрия и хлора может образоваться целая конструкция — так называемая кристаллическая решетка. Здесь каждый атом натрия удерживает около себя атом хлора. Связь эта довольно прочна. Попробуйте растереть соль в мелкий порошок — это можно сделать только при помощи ступки, да и то со значительными усилиями. Растирая соль, вы разрываете электрические связи между заряженными атомами!
Когда разрушают взрывом старое железобетонное здание, на его обломках видны остатки железных стержней — связей, которые обеспечивали прочность всей конструкции. А куда же деваются электрические связи между атомами, когда разрушается кристалл? Они разрываются, а электрические силы остаются свободными. Вся поверхность кристалла покрыта этими свободными электрическими силами, способными притянуть к себе атомы, находящиеся вне этой поверхности. Вот эти невидимые силы и удерживают атомы газов и паров различных веществ на поверхности твердого тела.
Да почему же мы говорим только о газах и парах? А разве атомы и молекулы растворенных веществ не мо -
|
Рис. 1. Схема кристаллической решетки поваренной соли. |
Гут притягиваться из раствора к твердой поверхности какого-нибудь порошка, насыпанного в раствор? Конечно, могут! Ведь здесь действуют те же самые силы — силы электрического притяжения между атомами.
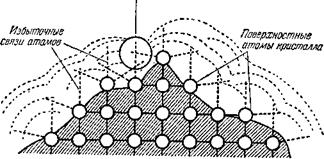
Теперь вы понимаете, что поверхность твердого тела — это не мертвая, монотонная пустыня, не просто контур, обрисовывающий поверхность каждой вещи. Это — изумительная арена борьбы электрических сил притяжения и отталкивания. Атомы вещества, составляющие твердое тело, взаимно и одинаково притягивают друг друга только внутри кристалла. А вот на поверхности кристалла повсюду имеются участки, на которых проявляются остаточные электрические силы притяжения. Посмотрите на рис. 2. Здесь изображена часть поверхности кристалла в разрезе. Атомы вещества, находящиеся на самой поверхности, не полностью связаны со своими соседями по кристаллической решетке; у них остаются избыточные силы, показанные пунктиром. Вот в это «силовое поле» и попадают молекулы газов и паров, находящиеся вблизи поверхности твердого поглотителя (адсорбента).
|
Молекула газа, попавшая в силовое поле поверхности,
Рис. 2. Схематическое изображение силового поля на поверхности сорбента. |
Действие поверхностных электрических сил распространяется на ничтожно малое расстояние. Поэтому неправильно думать, что молекулы газа со всех сторон притягиваются к поверхности из окружающего пространства, что наш поглотитель представляет собою что-то вроде насоса. Нет, он скорее похож на липкую бумагу для мух. Ведь бумага тоже не притягивает к себе мух, она удерживает на своей поверхности только тех мух, которые ее коснулись, да и то не всех: более сильные отрываются и улетают.
Молекулы газов (паров) беспорядочно, с большой скоростью движутся в пространстве и непрерывно бомбардируют поверхность предметов, с которыми эти газы соприкасаются. Если молекула попадает на то место поверхности, где имеются остаточные силы, маленькие электрические силовые поля, могущие притянуть к себе молекулу, последняя задержится на этом месте более или менее долгое время. Молекула газа, обладавшая большой энергией и двигавшаяся быстро, быстро вырывается из плена электрических сил и покидает поверхность адсорбента. Она улетит в окружающее пространство и, так как движение ее беспорядочно, может снова вернуться на ту же поверхность.
Если молекула более «слабая», а электрическое поле поверхности в месте падения молекулы достаточно силь - ное* молекула газа задержится более долгое время. Наконец, если молекула ударится о место поверхности, на котором нет силового электрического поля, она тотчас отскочит, как упругий шар.
Сколько же времени молекула газа может задерживаться на поверхности адсорбента? Очень недолго: всего от десятитысячных до стотысячных долей секунды. «Так мало?» — спросите вы. Тогда непонятно, как же некоторые поглотители (адсорбенты), с которыми мы познакомимся ниже, могут, удерживать вполне ощутимые, весомые количества газов и паров.
Представьте себе платформу железнодорожных весов, на которых можно взвешивать целые вагоны. Пусть поперек этой платформы идет длинная вереница людей, так, что на платформе одновременно оказываются три человека; это будет зарегистрировано весами. Каждую секунду на платформу вводит один человек и сходит с нее тоже один человек. Вереница людей движется непрерывно, а весы показывают одну и ту же цифру — вес трех человек, так как количество людей, прибывающих на платформу и покидающих ее, в единицу времени остается постоянным.
Не изменяя скорости движения, попросим наших людей идти через платформу весов по диагонали. Тогда каждый человек будет находиться на весах дольше, на платформе уместится большее количество людей, скажем шесть человек; в этом случае при той же скорости движения весы покажут цифру в два раза большую.
Когда весы придут в равновесие, мы можем попросить всю вереницу людей бежать с любой скоростью или плестись еле-еле: все равно равновесие при этом не изменится. Важно здесь то, что на платформе весов всегда пребывает определенное количество людей. То же происходит и на поверхности адсорбента. Чем дольше молекулы задерживаются на поверхности, тем большее количество их одновременно на ней присутствует, тем больше величина адсорбции. Время пребывания молекул на поверхности, как мы говорили, очень мало; в «игре» участвуют миллиарды молекул, что и приводит к совершенно ощутимым, весомым количествам адсорбированного газа. Когда количества приходящих и уходящих в единицу времени молекул равны, наступает, как говорят, адсорбционное равновесие. И в этом равновесии продолжается непрерывное хаотическое движение молекул.
Понятно, что если увеличить давление газа, то есть увеличить количество молекул, бомбардирующих поверхность, то адсорбция возрастет. Наоборот, если откачивать газ насосом, то не всякая молекула, покинувшая поверхность, будет иметь возможность вновь возвратиться на нее, и адсорбция начнет уменьшаться, газ будет десорбироваться.
Мы часто используем явление десорбции и, конечно, не применяем никаких насосов. Чтобы скорее удалить пары нафталина с одежды, ее проветривают. При этом молекулы паров нафталина, покидающие поверхность, уносятся чистым воздухом и не возвращаются обратно.
Из физики известно, что при нагревании газа энергия его молекул возрастает. Значит, при повышении температуры молекулы адсорбированного газа начнут с большей легкостью преодолевать силы притяжения поверхности, начнут улетать с нее* десорбироваться. Десорбцию, следовательно, можно вызвать не только откачкой газа насосом, но и повышением температуры адсорбента, содержащего газ.
Иногда очень трудно начисто отмыть флакон из-под хороших, сильно пахнущих духов. Это объясняется тем, что пары некоторых ароматических веществ крепко удерживаются поверхностью стекла. Прогревание же флакона в печке или духовке обычно приводит к желаемым результатам.
А сушка? Всегда, когда нужно высушить какой-либо материал (дерево, зерно, уголь, бумагу и т. п.), мы обрабатываем его при повышенной температуре. В этом случае молекулы воды (а она-то и обусловливает влажность материала) десорбируются (испаряются) не только с поверхности, но и из глубинных слоев адсорбента.
Мы все время говорим о молекулах, то есть о ничтожно малых количествах газов и паров. А на самом деле в технике поглощения парообразных веществ адсорбируемые количества весьма велики. Например, одна тонна специально приготовленного угля может поглотить до двухсот килограммов паров бензина, то есть 280 литров ценного горючего. А одна тонна поглотителя водяных паров (твердые пористые зерна двуокиси кремния — «силикагеля») улавливает более четверти тонны воды из влажного воздуха. Подумайте только, что почти все количество поглощенных паров ценных веществ (бензола, бензина, спирта и др.) может быть десорбировано и легко сконденсировано в виде жидких продуктов, и вы поймете, как высоко ценятся сорбционные процессы в народном хозяйстве!
Как измерить адсорбцию газа? Можно ли ее наблюдать?
Наблюдать адсорбцию можно очень просто. На чашку обыкновенных магазинных весов поставьте небольшое решето. Если весы не стрелочные, решето с углем необходимо уравновесить гирями. В решето насыпьте побольше угля, взятого из старого противогаза. Если теперь на поверхность угля направить слабую струю углекислого газа, того самого, которым газируют воду, то через несколько секунд можно увидеть, как решето с углем довольно заметно прибавит в весе. Для этого опыта я взял именно решето, а не коробку, так как вы могли бы возразить, что прибавление в весе вызвано самим углекислым газом, который тяжелее воздуха.
Вам придется долго ждать, пока уголь «проветрится», газ десорбируется и весы снова придут в равновесие.
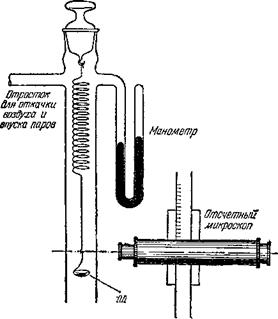
В научных лабораториях адсорбция исследуется точными методами. Вот один из них (рис. 3). В стеклянной трубке подвешена миниатюрная пружинка, сделанная из тонкой кварцевой нити. Кварц — это горный хрусталь, прозрачное кристаллическое вещество; при сильном разогревании из него, как и из стекла, могут быть вытянуты нити.
К нижнему концу пружинки подвешена стеклянная чашечка, в которую и помещают исследуемый адсорбент в количестве 0,1—0,3 грамма. Из стеклянной трубки насосом предварительно откачивают весь воздух через ее боковой отросток. Затем через этот отросток малыми порциями впускают пары того вещества, адсорбцию которого хотят исследовать. Пары входят в трубку и адсорбируются на поглотителе; вес поглотителя увеличивается. Поглотитель, став более тяжелым, растягивает пружинку, и чашечка опускается вниз. Это удлинение пружинки настолько мало, что простым глазом незаметно. Но микроскоп, помещенный сбоку, дает возможность обнаружить это удлинение. Обычно оно равно сотым долям миллиметра.
Конечно, вам уже ясно, что прибор представляет собою не что иное, как обычный пружинный безмен, но обладающий большой точностью взвешивания. При каждом впуске
|
Чтшв V Ус адсорбентом Рис. 3. Пружинные микровесы. |
Пара по манометру можно отметить его давление и величину поглощения на адсорбенте. Эти данные являются наилучшей характеристикой поглотителя. По ним можно судить, насколько пригоден адсорбент для того или иного заводского процесса.