Химические методы очистки
Химические методы очистки основаны на химическом взаимодействии между молекулами примеси и вносимого в водно- спиртовый раствор химического реактива, в результате чего образуются новые вещества. Если бы образовавшиеся вещества были нерастворимыми и (или) нелетучими, а очищающий реактив : взаимодействовал только с определенной примесью (или группой примесей) и не взаимодействовал с основным компонентом — этиловым спиртом, то такой метод очистки был бы идеальным. Однако на практике это недостижимо, так как в большинстве случаев многие примеси по химическим свойствам близки между собою и к этиловому спирту. Кроме того, диапазон действия реактивов широк; их частицы взаимодействуют как с молекулами нейтрализуемой примеси и родственными ей, так и с молекулами примесей других групп, а также и с этиловым спиртом, а образовавшиеся новые вещества во многих случаях растворимы и летучи. Новые вещества, образующиеся при нейтрализации той или иной примеси, являются новыми примесями. И хотя некоторые из них улучшают органо-лептические показатели водно-іСпиртового раствора, но могут оказаться не менее ядовитыми. чем нейтрализуемая примесь, то есть при очистке раствора от некоторых примесей будет происходить его загрязнение другими примесями и маскировка неприятного запаха. По этой причине целесообразность применения для очистки водно - спиртовых растворов химических веществ, особенно сильнодействующих, постоянно подвергалась сомнению. В результате многочисленных исследований в промышленном производстве спирта сочли возможным производить очистку перманганатом калия, каустической и кальцинированной содой. (Обработку спирта названными веществами называли исправлением спирта, а полученный в результате такой обработки спирт — исправленным.) В настоящее вр^мя перманганат калия применяется в промышленной технологии приготовления некоторых высокосортных водок и широко Используется в бытовых " условиях. При этом, как правило, повторной перегонки не производят. Ниже описана применявшаяся в России технология очистки водно-спиртовых растворов с применением указанных веществ. Кратко рассмотрим механизм действия перманганата калия, кальцинированной и каустической соды на основные группы органических летучих примесей водно-спиртового раствора.
Перманганат калия (КМПО4). Представляет собой кристаллы красно-фиолетового, почти черного цвета, с зеленоватым металлическим блеском. Плотность — 2,71 г/см. Растворимость в воде — 6,51 . Раствор КМп04 в дистиллированной воде дает нейтральную реакцию. Нейтрализующее действие КМПО4 основано на его способности выделять атомарный кислород в водных растворах, являющийся сильным окислителем в отношении ряда органических веществ. При этом, в зависимости от кислотности (щелочности) среды, разложение КМп04 происходит с участием веществ, определяющих кислотность (щелочность) среды, и различным образом. В частности, в щелочной или нейтральной среде окончательное превращение описывается уравнением
2КМп04 = К20 + 2Мп02 + 3x0, то есть 2 молекулы КМпОд выделяют 3 атома кислорода; в кислой среде:
2КМп04 = К20 + 2МпО + 5x0, Ю есть 2 молекулы КМ11О4 выделяют 5 атомов кислорода.
Как отмечалось ранее, атомарный кислород может окислять спирты и альдегиды. Карбоновые кислоты, за исключением муравьиной, им не окисляются.
При Окислении спиртов водно-спиртового раствора в зависимости от кислотности (щелочности) раствора могут образовываться альдегиды и (или) карбоновые кислоты. В частности, в кислой среде метиловый спирт окисляется в формальдегид, этиловый — в уксуСный альдегид, изоамиловый — в изоамиловый альдегид. Окисление этилового, метилового, изоамилового и других спиртов происходит одновременно согласно, например, уравнениям: СНзОН + О = СН20 + Н20 і метиловый формаль - вода спирт Дещд
СН2СН3ОН + О = СНзСНО + Н20. этиловый уксусный вода спирт аліьдегид
Следовательно, из ядовитого метилового спирта образуется столгі же ядовитый, неприятно пахнущий формальдегид (водный раствор формальдегида — формалин — сильнодействующий яд); из этилового спирта образуется уксусный аільдегид, имеющий при сильном разбавлений приятный фруктовый запах; из изоамилового спирта образуется изовалериановый альдегид, кипящий при 92°С |И также имеющий приятный фруктоВый запах. Что касается формальдегида, ТО ситуация Облегчается тем, что он химически очень активен, в силу чего его молекулы сразу же вступают в ряд химических реакций и превращений. Преобладание того или jjtaoro продуктов этих реакций зависит от температуры, состава. list. кислотности очищаемого раствора. Часть из них может окислиться, превратившись в муравьиную кислоту; часть после (ряда реакций превращается в ацеталь — альдегидоподобное соединение, но с более высокой, чем у исходных альдегидов, температурой кицения и приятным запахом; и наконец, часть из {ірих может ґіревратиться в малолетучее полимерное вещество параформ. В сВою очередь, муравьиная кислота под действием атомарного кислорода перманганата калия окисляется с образованием воды и углекислого газа, і І Что касается уксусного альдегида, то в процессе дальнейшего окисления часть его превращается в уксусную кислоту, а часть — в ацеталь (этилаль), а изовалериановый альдегид іа1 в изовалериановую, кипящую при 176,7°С, или метилэтилуксусиую, кипящую при 177°С, кислоты и изоамиловый эфир изова - "лериановой кислоты, соединение с сильным и приятным яблочным запахом. Отметим, что этот эфир под названием "яблочная эссенция" используется в кондитерском производстве. Соответствующие превращения с образованием веществ, имеющих аромат роз, лаванды, кориандра, эвкалипта, претерпевают и другие спирты сивушного масла.
Необходимо отметить, что окисление этилового, метилового и другах спиртов происходит одновременно. Однако скорость их окисления различна при одной и той же температуре, увеличиваясь с ее повышением: на колоде или комнатной температуре в водно-спиртовом растворе метиловый спирт окисляется полностью, этиловый незначительно, а спирты сивушного масла существенно меньше этилового.
Казалось бы, что эффект очистки водно-спиртового раствора от спиртов сивушного масла можно усилить путем введения в раствор избыточных количеств КМп04 и проведения окисления при более высоких температурах. Однако это ничего не даст из-за более высоких способностей к окислению и доли этилового спирта в растворе по Сравнению со спиртами сивушного масла. В общем можно считать, что Очистка водно-сдиртового раствора от спиртов сивушного масла с помощью КМп04 малоэффективна. Наблюдаемое же на практике некоторое улучшение запаха водно-спиртового раствора (самогона), обработанного КМп04, обусловлено сильно и приятно пахнущими веществами, которые образуются в результате незначительного окисления спиртов сивушного масла и фактически маскируют (заглушают) неприятный запах последнего.
Фурфурол под действием атомарного кислорода превращается в пирослизевую кислоту (С4Н3ОСООН), плавящуюся при 133°С, малорастворимую в воде и сильно — в этиловом спирте, которая под действием щелочей превращается в малолетучую, но растворимую в спирте, смолу.
Что же касается других альдегидов, имеющихся в растворе к началу его нейтрализации, то все они легко окисляются атомарным кислородом, образующимся из перманганата калия, до карбоновых кислот, образующих в щелочной среде нелетучие соли. Таким образом, в результате воздействия перманганата калия на водно-спиртовый раствор происходит очищение его от метилового спирта и альдегидов при одновременном загрязнении его эфирами, карбоновими кислотами и малолетучими, но растворимыми в спирте смолами. При этом практически не происходит очистки водно-спиртового раствора от таких компонентов сивушного масла, как спирты, уксусная и другие карбоновые кислоты (За исключением муравьиной кислоты).
При добавлении водного раствора КМПО4 к спирту с течением времени цвет, смеси меняется. Многочисленными опытами установлено, что чем медленнее происходит изменение окраски, тем более высокими органолептическими показателями обладает спирт. Это явление изменения окраски положено в основу метода испытаний, называемого пробой на окисляемость (старое название — проба Ланга или хамелеонная реакция: хамелеон — название минерала, состоящего преимущественно из КМпС>4, а также старое техническое название КМп04), позволяющего судить, но не измерять, о наличии в спирте примесей, легко поддающихся окислению, и определять количество КМпС>4, необходимое для их нейтрализации. Испытание на окисляемость легко провести и в бытовых условиях.
Показатель Ланга определяете^ следующим образом. Подлежащую анализу порцию спирта объемом 50 мл помещают в стакан из химически стойкого бесцветного стекла и доливают в него 2 мл раствора пермангата калия. Этот раствор готовят растворением 0,2 г КМпС>4 віл дистиллированной воды. Температура спирта во время опыта должна быть 18°С. После добавки к спирту раствора КМпС>4 полученную смесь взбалтывают и начинают отсчет времени, в течение которого цвет смеси изменится от фиолетового до цвета семГи, а в условиях современного промышленного производства спирта, по сравнению с цветом эталона, имеющего желго-розовую окраску. Многочисленными опытами установлено, что чем выше показатель Ланга, тем более высокие органолептические показатели имеет спирт. В частности, в работе [32] установлено, "...что длительность изменения цвета в ректификованных спиртах составляет: а) высшей очистки — минимальная tMHH = 24 мин, максимальная імакс = 90 мин; средняя tCp = 55 мин; б) высокой очистки — 1мин "» 10 мин» tMaKC = 60 мин; tCp = 32 мин; в очищенных — tMHH = 0 мин; Імакс = 26 мин; tCp = 13 мин... Средняя скорость обесцвечивания хамелеона ректификованными спиртами, идущими на приготовление обыкновенного казенного вина, равна 22 мин 44 с, Спиртами двойной ректификации, идущими на приготовление столового вина, — 52 мин 55 с...".
Определение количества КМ1О4, необходимого для исправления спирта, производится следующим образом [50]. В коническую колбу емкостью 100—150 мл помещают 1 мл раствора КМп04 Полученного, как указано выше. К нему из бюретки при постоянном взбалтывании колбы равномерной струей приливают испытываемый спирт до появления розово-желтой окраски, соответствующей Окраске типового раствора, применяемого при испытаниях спирта на окисляемость. При этом типовой раствор наливают для сравнения в другую колбу, идентичную первой. Скорость истечения спирта должйа быть около 50 мл/мин. Когда смесь приобретает розово-Желтую окраску, прилив спирта прекращают и выполняют расчет.
Пусть, например, прилив к 1 мл раствора КМп04 25 мл спирта смесь ириобйш. розово-желтый цвет. Тогда с учетом того, что 1 мл (0,001л) раствора КМп04 содержит 0,0002 г КМ11О4, можно записать очевидную пропорцию: -
0,0002 г КМпОд раскисляют 0,025 л спирта, х г —, 1 л —"— .
Откуда X - 0,0002г х 1л/0,025 л - 0,008г - 8 мг КМп04 на исправление 1 л спирта.
Кальцинированная сода ШагСОз). Растворы соды обладают щелочными свойствами. При взаимодействии с карбоновыми кислотами ЫагСОз образует нелетучие соли. На с. 135 приведена реакция нейтрализации уксусной кислоты, которая лежит в основе технологии очистки водно-спиртового раствора от нее. Аналогичным образом ИагСОз взаимодействует и с другими карбоновыми кислотами. Масса ЫагСОз, необходимая для нейтрализации кислот, определяется титрованием.
Каустическая сода. Преобладающим компонентом каустической соды является гидроксид натрия (едкий натр, NaOH). Он также нейтрализует карбоновые кислоты с образованием нелетучих солей. Реакция взаимодействия сложных эфиров с NaOH при температуре кипения с образованием соответствующих солей карбюновых кислот называется омылеиием. Например, омыление уксусноэтилового эфира протекает согласно реакции СН3СООС2Н5 + NaOH 1- CHsCONa + С2Н5ОН.
Аналогичным образом происходит омыление и других эфиров. Однако необходимо отметить, что реакции омыления затянуты во времени и к тому же их скорости различны для различных эфиров. Поэтому при излишне быстрой перегонке часть эфиров вместе с этиловым спиртом переходит в дистиллат.
В случае Присутствия в растворе альдегидов, NaOH катализирует их превращения с образованием 1>гидроксикарбонильных соединений.
Определение требующегося количества каустической Соды для исправления спирта проводится на основании результатов анализа спирта на содержание в нем кислот и эфиров. Если эти данные не известны, то требуемое количество NaOH определяется по методу А. Н.Грицианова следующим образом [50], В колбу емкостью 200 мл с обратным холодильником наливают І 00 мл (0,1 л) анализируемого спирта и к нему приливают 10 мл 0,1 N раствора NaOH. Смесь в течение 1 ч подвергают слабому кипячению. После охлаждения колбы до 40—50 С, то есть до состояния, при котором колбу можно свободно держать рукой, добавляют одну каплю 1%-ного раствора фенолфталеина и 10 мл 0,1 N раствор H2SO4 и оттитровывают избыток введенной кислоты 0,1 N раствором NaOH.
Количество NaOH, которое требуется для исправления испытуемого спирта, находят на основании. объема 0,1 N раствора NaOH, который пошел на оттитровывание кислоты.
Например, на оттитровывание H2SO4 пошло 3,2 мл 0,1 N
|
Таблица 43. Показатели спирта-сырца и ректификованного спирта II сорта (40]. |
||
|
Показатели |
Спирт-сырец |
Ректификованный спирт П сорта |
|
Вкус и запах |
Нормальные |
Нормальные |
|
Крепость |
88°,7 |
95°,9 |
|
ФмЛгрол, , , |
Следы |
0 |
|
Альдегиды, об. %, на абсолютный спирт |
0,008 |
0,011 |
|
Сивушные масла, масс '%, на абсолютный спирт |
0,39 |
0j21 |
|
Общая кислотность (на уксусную кислоту), мг на 1 л абсолютного спирта |
31,1 |
14,4 |
|
Эфиры (в пересчете на уксусно-этиловый); мг, на 1 л абсолютного спирта |
280,5 |
33,9 |
Раствора NaOH, тогда, с учетом того, что в 3,2 мл 0,1 N раствора NaOH содержится 3,2 х 0,004 г = 0,0128 г NaOH, можно составить пропорцию
0,0128 г NaOH исправляют ОД л спирта X г —,1 л.
Откуда X - 0,0128 г х 1 л/0,1 л - 0,128 г =128 мг NaOH.
Таким образом, при воздействии КМп04, №гСОз и NaOH на водно-спиртовый раствор в нем происходит ряд сложных химических превращений. Если целью нейтрализации является понижение кислотности, то для этого применяется кальцинированная или даже пнщев ія (№НСОз) сода. Если же решаемая задача многоплановая, то применяются КМп04 и NaOH в приведенной последовательности. В любом случае обработанный химикатами водно-спиртовый раствор необходимо перегнать до употребления вовнутрь, чтобы стимулировать в нем реакцию Окїй^ения сложных эфирОв и очистить его от образовавшихся в нем растворимых солей и растворимых в спирте малолетучих органических соединений, а также повысить его крепость.
Согласно работё [40], технология обработки спирта проводится комбинированно несколькими реактивами. Самыми употребляемыми являются едкий натр (каустическая сода) и марганцевокислий калий. Чаще всего эти реактивы применяются одновременно и # такой последовательности — сначала обрабатывают спирт? или его рассиропку марганцевокислым калием, а затем —- едким натром (рассиропка — термин, означающий разбавленный водою спирт). Реже используют только один из этих реактивов. Если в дополнение к двум вышеназванным реактивам используется кальцинированная сода, то сначала ею обрабатывают спирт, после этого перманганатом калия, а затем каустической содой. Количество реактивов устанавливается на основе анализа каждой порции спирта, подлежащей очистке, И поэтому в каждом конкретном случае оно будет различным:
|
|
Недостаток реактивов или их избыток отрицательно сказываются на результатах очистки. Масса вносимого едкого натра определяется по результатам анализов спирта на содержание в нем кислот и эфиров; перманганата калия — на основе пробы Ланга. Обычно на 1 л спирта-сырца использовалось не более 0,6 г перманганата калия, 1,0—1,2 г кальцинированной и 1,4—1,6 г каустической соды.
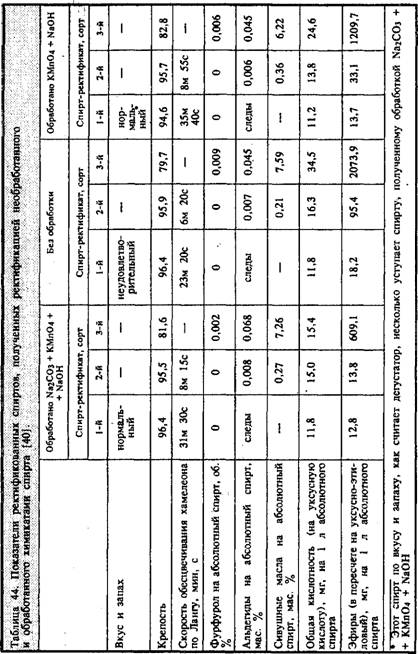
Технологию очистки рекомендовалось осуществлять следующим образом. Исходя из результатов анализа примесей в спирте-сырце и его объема рассчитываются необходимые количества реактивов и готовятся их водные растворы. Сначала в спирт при перемешивании вливают раствор кальцинированной соды, после Этого раствор перманганата калия и, наконец, спустя 15—20 мин, каустической соды. Обработанный таким образом спирт выдерживают 15—20 ч, после чего разбавляют водой до крепости 60 и подвергают ректификации, в процессе которой выделяется три сорта спирта. Какого же качества спирт получают в результате такой обработки и последующей ректификации? В какой-то степени ответ на этот вопрос дают авторы работы [40], которые провели сравнение показателей ректификованного спирта, полученного путем перегонки необработанной химикатами смеси спирта-сырца, с ректификованным спиртом II сорта и обработанной: а) перманганатом калия и каустической содой, б) кальцинированной содой, перманганатом калия и каустической содой. В каждом опыте использовался спирт-сырец одного и того же состава, а ректификованный II сорта для каждого последующего Опыта получали в предыдущем. Поэтому приведенные в табл. 43 характеристики спирта-сырца относятся ко всем опытам, а ректификованного — к первому. Состав ректификованных спиртов II сорта, используемых во втором и третьем опытах, приведен в табл. 44.
Анализ табл. 44 показывает, что обработка спирта химикатами приводит к существенному уменьшению в нем кислот и эфиров. Показатель Ланга у обработанного химикатами спирта лучше, чем у необработанного, что происходит за счет уменьшения фурфурола и, по-видимому, кротонового альдегида и акролеина, и с чем, вероятно, связаны более высокие органолептические показатели обработанного химикатами спирта.