Перегонка
Очистку спирта производят перегонкой, в основе которой лежит испарение жидкостей и последующая конденсация их паров, двумя. физическими методами: дистилляцией и ректификацией. Дистил - * ляция (лат-distillatio — стекание по каплям) — перегонка жидкости с целью очищения. Дистиллат — OiaT. distillatus — стекший по каплям) — продукт дистилляции. Ректификация (лат. гесШсаНо — выпрямление) — способ тщательной очистки жидкости путем ее перегонки. Ректификат ^aT. rectificatus — исправленный) — продукт ректификации.
Обычно в спиртовой промышленности термины перегонка и дистилляция употребляются как равнозначные и обозначают процесс, конечным продуктом которого является спирт-сырец, а термином ректификация обозначают процесс тонкой очистки спирта-сырца от примесей с целью получения ректификованного спирта.
Поступающая на перегонку зрелая бражка содержит 8-10 об.% этилового спирта, свыше 70 об.% воды, а также значительное количество летучих и нелетучих веществ. Цель перегонки — получить максимально концентрированный этиловый спирт - сырец, то есть очистить его от воды и нелетучих веществ. Очистка спирта от летучих органических примесей на этапе получения спирта-сырца незначительна. Процесс перегонки подчиняется законам, сформулированным М. С.Вревским и Д. П.Коноваловым, описанным в [26,28 ]. Их понимание требует подготовки читателей по термодинамике и физической химии, что выходит за рамки популярного издания. Поэтому мы опишем перегонку в общедоступном виде.
В науке при рассмотрении сложных систем и явлений зачастую учитывают только их главные параметры и свойства, то есть они описываются простейшими (модельными) представлениями. Применительно к перегонке зрелой бражки модельные представления заключаются в том, что ее рассматривают как раствор, состоящий только из воды и этилового спирта. Это оправдано тем, что при обычно применяющихся температурах перегонки нерастворимые вещества, входящие в ее состав, являются практически нелетучими, а из числа летучих в зрелой
Бражке преобладают вода и этиловый спирт. Разумеется, что при рассмотрении процесса ректификации, то есть получения спирта с минимальным содержанием примесей, перегоняемая жидкость так рассматриваться уже не может.
Состояние растворов и процесс их перегонки количественно описываются рядом физических параметров, основным из которых, наряду с объемом, температурой и концентрацией, является давление насыщенных паров раствора и образующих его веществ.
Рассмотрим процесс испарения в общих чертах. При любой температуре над поверхностью раствора в парообразном состоянии находится определенное число молекул, входящих в его состав. При этом происходит постоянный обмен молекулами между жидкой и газообразной фазами: часть молекул из раствора испаряется, а часть возвращается назад в раствор. Если число частиц испаряющихся равно числу конденсирующихся, то такой установившийся процесс называют состоянием динамического равновесия. Если раствор поместить в замкнутый объем, то вначале равновесия не будет. Оно наступит только по истечении определенного времени. Пар, находящийся в равновесии с жидкостью, называется насыщенным паром. Давление насыщенного пара над раствором является величиной, постоянной при неизменной температуре. Состоянию равновесия отвечает определенная для данной температуры концентрация пара. С повышением температуры давление насыщенного пара повышается и в случае, коща оно достигает атмосферного, жидкость закипает. Если компоненты раствора летучие, то образующийся пар будет содержать молекулы всех веществ, входящих в состав раствора. В таком случае общее давление насыщенного пара над раствором Робщ будет равно сумме индивидуальных (парциальных) давлений, создаваемых молекулами этих веществ, то есть Робщ=Рі+Р2+...+Рп, ще Pi, Р2..., Pn — давление насыщенного пара отдельных веществ в объеме, равном объему этой смеси. Казалось бы, что парциальные давления насыщенных Паров компонентов раствора должны быть пропорциональными концентрации этих веществ в растворе. Однако это бывает только в том случае, коща молекулы компонент раствора близки по величине, строению, составу и не взаимодействуют друг с другом. На самом деле, в большинстве случаев молекулы веществ, образующие раствор, не просто равномерно распределены между собой, но и связаны химически, что сказывается как на свойствах растворов, так и на величине парциальных давлений их паров. Поэтому в большинстве случаев состав пара отличается от состава раствора и сложным образом зависит от него.
К такому типу растворов относятся и водно-спиртовые, особенности перегонки которых рассмотрены ниже.
|
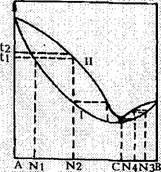
Рис. 16. Диаграмма состав-температура кипения водно-спиртового раствора [28]. |
В термодинамике для наглядности анализа процесса пользуются графическими (диаграммными) зависимостями тех или иных его параметров от других. К примеру [28], на рис. 16 представлена экспериментально измеренная зависимость температуры кипения водно-спиртового раствора от его состава (кривая I). Кривая II характеризует зависимость состава его насыщенных паров от температуры кипения. Точка В соответствует 100%-ному содержанию в растворе компонента с более низкой температурой кипения (этиловому спирту), а точка А — 100%- ному содержанию компонента с более высокой температурой кипения (воде). Понятно, что при перемещении по горизонтальной кривой от А до В концентрация воды в растворе уменьшается, а этилового спирта увеличивается и, наоборот, при перемещении от В к А концентрация этилового спирта уменьшается, а воды — увеличивается. В рассматриваемом случае составу В соответствует температура кипения 78,4°С, составу А — 100°С. Анализ кривой I показывает сложный характер зависимости температуры кипения водно-спиртового раствора от его состава. В частности, в интервале концентраций между точками А и С, с увеличением концентрации спирта температура кипения раствора понижается от 100 до 78,13 С, после чего возрастает и достигает 78,4°С при 100%-ном содержании спирта. Прежде чем совместно рассмотреть кривые I и II, следует обратить внимание на то, что при кипении температуры раствора и его насыщенного пара равны. Поэтому на участке концентраций, например от А до С, составу раствора, обозначенному буквой Ni, при одной и той же температуре пара и раствора ti, будет соответствовать состав пара, обозначенный буквой N2, то есть доля спирта в паре и дистиллате из него будет больше, чем в растворе, из которого они образовались. Поскольку в процессе перегонки происходит постоянный уход испарившихся молекул за пределы перегонного куб, раствор в процессе перегонки будет обедняться спиртом. Следовательно, концентрация спирта в перегоняемом растворе будет непрерывно понижаться, а температура его кипения соответственно повышаться. В конечном итоге, в случае достаточно длительного подвода тепла к раствору с начальным составом Ni в результате перегонки, он разделится на две части: одну, состоящую только из вещества А, то есть воды, и вторую, представляющую собой водно-спиртовой раствор. Из кривой также видно, что концентрация спирта в этом растворе будет выше, а температура его кипения ниже, чем у исходного раствора с составом,
|
Таблица 25. Зависимость между содержанием спирта в водно-спиртовом растворе и содержанием спирта в парах,: выделяющихся из раствора при его кипении (2,8].
|
Обозначенным буквой Ni. Проводя ряд последовательных перегонок водно-спиртовых растворов со все возрастающей начальной концентрацией спирта, можно получить раствор состава С, кипящей при 78,13°С и содержащий 97,2 об.% или 95,57 мас.% спирта. Из раствора такого состава отделение спирта от воды невозможно вследствие их одинаковой испаряемости, благодаря чему состав раствора и его насыщенного пара одинаковы. Раствор указанного состава называется нераздельно кипящим или азеотропним.
Проводя аналогичные рассуждения для состава раствора, находящегося между точками С и В (точки N4 и N3), можно показать, что раствор такого исходного состава путем перегонки можно разделить на чистый компонент состава В, то есть этиловый спирт, и азеотропний раствор состава С, из которого выделить этиловый спирт путем перегонки невозможно.
Для наглядности изложения, кривые рис. 16 изображены без соблюдения масштаба. Численные соотношения между составом водно-спиртовых растворов, температурами их кипения и соответствующими этим температурам составами насыщенных паров определялись и уточнялись рядом исследователей. В табл. 25 представлены соответствующие значения, полученные Тренингом [2,8].
Несмотря на то, что в современной справочной научно-технической литературе приведены более точные таблицы, для бытовых целей точность приведенных данных вполне достаточна.
Из табл. 25 видно, что водно-спиртовому раствору с определенным содержанием спирта соответствуют определенные температура кипения и состав насыщенных паров. Например, при перегонке зрелой бражки с содержанием спирта 10 об.% ее температура кипения будет равна 92,6°С, а пары и соответственно конденсат из него, будут содержать 57,2% об. или 49,4 мас.% спирта. Разумеется, что эти цифры соответствуют только началу перегонки, а в ее процессе концентрация спирта в бражке и образующемся конденсате будут понижаться, а температура ее кипения повышаться. Но эти изменения всегда будут соответствовать приведенным в таблице численным параметрам. Если отсутствует спиртомер, то, определив температуру кипения бражки по термометру и приняв за начало кипения начало образования конденсата, можно на момент измерения температуры достаточно точно определить крепость бражки и получающегося дистиллата. Постоянно измеряя температуру кипения в процессе перегонки, с помощью табл. 25 можно непрерывно определять концентрацию спирта в бражке и конденсате.
Не менее важна для практического применения табл. 26, составленная Деницем на основе табл. 25, позволяющая производить ряд практически важных вычислений.
Пример. Необходимо определить: 1) вес конденсата, в котором находится весь спирт, содержащийся в поступившей на перепонку бражке; 2) содержание спирта
|
Таблица 26. Связь между темперэтурой кипения, массой (весом) перегоняемого остатка водно-спиртового распора и содержанием ш нем спирта [8]. |
|||||||
|
Температура кипения, "с |
Масса остатка, кг |
Доля спирта |
Температура кипения, "с |
Масса остатка, кг |
Доля спирта |
||
|
Об. % |
Мае. % |
Об. % |
Мае. % |
||||
|
79,1 |
1000 |
90,0 |
85,8 |
83,5 |
39,2 |
44,0 |
37,0 |
|
79,2 |
536 |
88,0 |
83,2 |
83,8 |
37,6 |
42,0 |
35,2 |
|
79,4 |
355 |
86,0 |
80,7 |
84,1 |
36,0 |
40,0 |
33,4 |
|
79,6 |
264 |
84,0 |
78,3 |
84,4 |
34,6 |
38,0 |
31,6 |
|
79,7 |
208 |
82,0 |
75,9 |
84,7 |
33,3 |
36,0 |
29,9 |
|
79,9 |
172 |
80,0 |
73,6 |
85,0 |
32,0 |
34,0 |
28,1 |
|
80,1 |
146 |
78,0 |
71,3 |
85,3 |
30,8 |
32,0 |
26,4 |
|
80,3 |
127 |
76,0 |
69,1 |
85,7 |
29,7 |
30,0 |
24,7 |
|
80,5 |
111 |
74,0 |
66,8 |
86,2 |
28,6 |
28,0 |
23,0 |
|
80,6 |
99,3 |
72,0 |
64,6 |
86,6 |
. 27,6 |
26,0 |
21,3 |
|
80,8 |
89,9 |
70,0 |
62,5 |
87,1 |
26,7 |
24,0 |
19,6 |
|
81,0 |
82,0 |
68,0 |
60,4 |
87,7 |
25,9 |
22,0 |
17,9 |
|
81,2 |
75,3 |
66,0 |
58,3 |
88,3 |
24,9 |
20,0 |
16,3 |
|
81,3 |
69,5 |
64,0 |
56,2 |
89,0 |
24,0 |
18,0 |
14,6 |
|
81,5 |
64,7 |
62,0 |
54,2 |
89,7 |
23,2 |
16,0 |
13,0 |
|
81,7 |
60,4 |
60,0 |
52,2 |
90,6 |
22,3 |
14,0 |
11,3 |
|
81,9 |
56,6 |
58,0 |
50,2 |
91,5 |
21,5 |
12,0 |
9,7 |
|
82,1 |
53,3 |
56,0 |
48,3 |
92,6 |
20,7 |
10,0 |
8,1 |
|
82,4 |
50,2 |
54,0 |
46,3 |
93,9 |
19,9 |
8,0 |
6,4 |
|
82,6 |
47,6 |
52,0 |
44,4 |
95,2 |
19,0 |
6,0 |
4,8 |
|
82,8 |
45,2 |
50,0 |
42,5 |
96,6 |
18,1 |
4,0 |
3,2 |
|
83,0 |
43,1 |
48,0 |
40,7 |
98,2 |
17,1 |
2,0 |
1,6 |
|
83,3 |
41,1 |
46,0 |
38,8 |
100,0 |
14,5 |
0,0 |
0,0 |
В конденсате, то есть его крепость; 3) вес неперегоняемого остатка, то есть вес барды. Пусть на перегонку поступило 100 кг бражки и с помощью термометра установлено, что температура кипения ее составляет 92,6°С. Тоща из табл. 26 видно, что указанной температуре кипения соответствует бражка, содержащая 10 об.% или 8,1 мас.% спирта и при перегонке 20,7 кг такой бражки вес остатка, не содержащего спирт, будет составлять 14,5 кг, а вес водно-спиртового раствора, в котором находится весь ранее находившийся в бражке спирт — 20,7 кг — 14,5 кг - 6,2 кг. Составив очевидную пропорцию, получим, что при перегонке 100 кг бражки в перегонном кубе должно остаться (14,5 кг х 100кг)/20,7 кг ~
- 70,05 кг не содержащего спирт остатка, а перегнать необходимо 100 кг — 70,05 кг - 29,95 кг водцо-спиртового раствора, в котором будет находиться весь спирт. Содержание спирта в дистилляте будет равно (8,1 кг/29,95 кг) х 100%-
- 27,0 мас% или 32,7 об.%. То есть его крепость будет равна 32,7°.
Проведя аналогичным образом измерения температуры кипения бражки с любым содержанием спирта, можно определить ее крепость, вес неперегоняемого остатка, вес и крепость дистил - лата.
|
Таблица 27. Платность водных растворов этилового спирта (С2Н3ОН + НгО) (г/мл) (кг/л) [431. |
|||||||||||
|
Мае. % |
О |
1 |
2 |
3 |
4 |
S |
Б |
7 |
8 |
9 |
|
|
0 |
0,9982 |
0,9964 |
0,9945 |
0,9928 |
0,9910 |
0,9894 |
0,9878 |
0,9863 |
0,9848 |
0,9833 |
|
|
Ю |
9819 |
9805 |
9791 |
9778 |
9761 |
9751 |
9739 |
9726 |
9713 |
9700 |
|
|
20 |
9686 |
9673 |
9659 |
9643 |
9631 |
9617 |
9602 |
95&Т |
9571 |
9555 |
|
|
Н: |
30 |
9538 |
9521 |
9504 |
9486 |
9568 |
9449 |
9431 |
9411 |
9392 |
9372 |
|
[І |
Ij^O |
9352 |
9331 |
9311 |
9290 |
9269 |
9247 |
9226 |
9204 |
9182 |
9160 |
|
Ft" |
І'ІО |
9138 |
9116 |
9094 |
9071 |
9049 |
9026 |
9003 |
8980 |
8957 |
8934 |
|
8911 |
8888 |
8865 |
8842 |
8818 |
8795 |
8771 |
8748 |
8724 |
8700 |
||
|
Щ |
8677 |
8653 |
8629 |
8605 |
8581 |
8556 |
8532 |
8508 |
8484 |
8459 |
|
|
8434 |
8410 |
8385 |
8360 |
8335 |
8310 |
8284 |
8258 |
8232 |
8206 |
||
|
90 |
8180 |
8153 |
8126 |
8098 |
8071 |
8042 |
8014 |
7985 |
7955 |
7924 |
|
|
100 |
7893 |
|
Таблица 28. Температура кипения водно-спиртовых растворов при пониженных давлениях f2). |
|||
|
Доля |
Давление, мм рт. ст. |
||
|
Спирта в растворе, мае. % |
200 |
400 |
600 |
|
Температура кипения, и( |
|||
|
0 (вода) |
66,5 |
83,3 |
93,2 • |
|
10 |
60,5 |
76.7 |
87,0 |
|
20 |
56,2 |
72,0 |
82,0 |
|
30 |
54,0 |
69,3 |
79,3 |
|
40 |
53,5 |
67,7 |
77,7 |
|
50 |
51,2 |
66,2 |
75,0 |
|
60 |
50,5 |
64,9 |
74,6 |
|
70 |
49,8 |
64,5 |
74,2 |
|
90 |
48,6 |
63,3 |
73,2 |
В частности, из 100 кг бражки с объемным содержанием спирта 4 об.% получается 19,89 кг дистиллата с 16 мас.% или 19,7 об.% спирта;
6 об.% получается 23,67 кг дистиллата с 20,2 мас.% или
24.7 об. % спирта;
8 об.% получается 27,14 кг дистиллата с 23,6 мас.% или
28.8 об.% спирта.
Табл. 26 дает возможность определить крепость дистиллата и в случаа, повторной перегонки.
Например, в случае бражки с исходным содержанием этилового - спирта 10 об.% получается водно-спиртовскй раствор с со - г держанием спирта после:
. «О 5-237
1-ой перегонки — 27,0 мас.% или 32,7 об.% спирта
И-ой " — " 50,2 " — " — " 58,3 " — " — "
Ш-ей " — " 67,5 " — " — " 74,8 " — " — "
IV - ой " — " 77,1 " — " — " 83,2 " — " — "
V - ой " — 82,3 * — " — «♦ 87,3 " — " — ".
Пример. Необходимо определить вес и крепость дистиллата, получаемого в результате перегонки водно-спиртового раствора неизвестного состава, если процесс перегонки необходимо прекратить при содержании спирта в остатке, равном 10 об.% или 8,1 мас.%., Пусть, например, на перегонку поступило 100 кг раствора и с помощью термометра установлено, что температура кипения его равна 84,1 С. Тоща с помощью Табл. 26 определяем, что на перегонку поступил раствор, содержащий 40,0 об.% или 33,4 мас.% спирта. Далее, из этой же таблицы видно, что при перегонке 36 кг такого раствора получается остаток 20,7 кг с содержанием спирта 10,0 об.% или 8,1 мас.%. Отсюда, при поступлении на перегонку 100 кг водно-спиртового раствора, содержащего спирта 33,4 мас.%, вес остатка с 8,1 мас.% спирта! будет (100 кг * 20,7 кг)/36 кг - 57,5 кг, а вес дистиллата — 100 кг — 57,5 кг — 42,5 кг. Доля спирта в дистиллате будет: (100 кг х 33,4 мас.% — 57,5 кг х 8,1 мас,%>/42,5 кг - 67,6 мас.% или 74,7 об.%, то есть его крепость будет 74,7°. Всего в 42,5 кг дистиллата будет (42,5 кг к 67,6 мас.%)/100 мас.% - 28,7 кг спирта, а в 57,5 кг остатка — (57,5 кг х х 8,1 мас.%)/100 мас.% — 4,7 кг Спирта. В свою очередь, нз табл. 25 видно, что в начале перегонки дистиллят образовывался за счет паров, содержащих 82,3 об.% или 76,3 мас.%, а в конце 57,2 об.% или 49,4 мас.% спирта. За время перегонки температура кипения раствора повысилась от 84,1°С до 92,6°С.
На практике удобнее измерять объем, а не массу жидкости. Переход от единиц массы к единицам объема и от единиц объема к единицам массы можно - произвести с помощью табл. 27 по формуле Р = m/V, т и V — соответственно масса и объем водно-спиртового раствора. Например, водно-спиртовой раствор с долей спирта 32 мас.% имеет, плотность р = 0,9504 г/мл и содержит в 100 мл раствора 32 г спирта.
Перегонка при пониженном давлении. Из сказанного ранее следует, что температуры кипения чистых жидкостей и их растворов зависят от величины давления окружающей среды. Соответствующие значения для чистых жидкостей приведены в табл. 22, водно-спиртовых растворов — в табл. 28.
Из табл. 28 видно, что, понижая давление над бражкой, можно вскипятить ее и соответственно произвести перегонку спирта при более низких температурах, чем соответствующих, как обычно принято, атмосферному давлению. Указанный принцип перегонки не получил применения в спиртовой промышленности, но реализован в промышленных технологиях некоторых стран при производстве винного и плодово-ягодного спиртов. При этом качество спирта, перегоняемого при пониженных давлениях и температурах кипения, получается более высоким.