Строение каталитического комплекса
Косси [153] считал, что АЦ,
Образовавшийся при взаимодействии СПМ и металлор - ганического соединения (МОС), представляет собой монометаллический комплекс, центральным атомом которого является ион переходного металла, находящийся в октаэдрическом окружении; одно из координационных мест занято алкильной группой, которая оказалась у переходного металла вследствие обмена с МОС, и, по крайней мере, еще одно координационное место в комплексе должно быть вакантным для координации оле - фина. Другие места координации могут быть заняты другими лигандами,-По Косей разрыв Ті—С-связи гемолитический и рост цепи происходит по схеме:
R
Хх
Х^ сн,
X 2
|
R X |
Л-комплекс
Х\1 /X - Ті
Сн2
АЦ располагается на латеральных (боковых) гранях кристаллов хлоридов переходных металлов, поверхность которых составляет около 5% от общей поверхности.
В согласии с монометаллическим механизмом находятся результаты, полученные Бреслоу [154] и Буром [155], синтезировавшими высокомолекулярный полипропилен без специального добавления МОС. Бестиан [145] показал, что «безалкильный» катализатор на основе Ті(СНз)С1з активен в полимеризации этилена, а Каррик и Керол [156] установили, что относительная реакционная способность мономеров при сополимеризации зависит только от природы переходного металла и не зависит от типа металла МОС. Согласно Буру [157], центры роста при использовании катализаторов, содержащих
И не содержащих алкилметаллы, идентичны, и кон-, станты скорости роста в обоих случаях близки. Авторы работы [106] считают, что правомочны оба АЦ, причем биметаллический комплекс образуется при взаимодействии АОС с атомами титана, имеющими первоначально две свободные вакансии.
Таким образом, Косси и другие авторы, хотя и высказали необходимость вакантного места для координации мономеров в октаэдрической координации титана, роль алкила они видели только в алкилировании переходного металла и в освобождении реакционной среды от примесей.
Сога [158] предполагает существование биметаллического
\/\/ / V х
\
—Ті—R /
II
Комплексов, причем биметаллический комплекс устойчив даже при высокой температуре и обеспечивает получение стереорегулярного полипропилена. Однако, хотя ядром катализатора является алкилированный переходный металл с координационно-связанным олефином, наличие металл-углеродной связи М—R есть необходимое, но недостаточное условие для образования активного состояния.
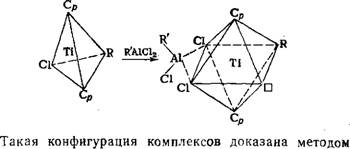
Как показали Оливе [69], растворимое титаналкиль - ное соединение дициклопентадиенилэтилтитанхлорид (С5Н5)2Ті(С2Н5)С1 имеет связь Ті—С, однако без добавления алкилалюминия не является активным. Это соединение имеет тетраэдрическую конфигурацию лигандов у титана. Добавление АОС приводит к перекоординированию лигандов именно при комплексообразовании с ал - килом алюминия в октаэдрическую форму (Ср — цикло-
ЭПР.
Таким образом, алюминийалкилы образуют немедленно при сливании компонентов комплекс, в котором А1 связан с Ті посредством хлорных мостиков. При таком комплексообразовании с участием МОС достигаются два самых существенных условия формирования АЦ каталитической реакции:
1) дестабилизация связи Ті—С при изменении симметрии и лигандов (мостичные связи более растянуты) и'координации мономера;
2) появление в октаэдрическом комплексе свободного положения для координации мономера.
Степень стабильности связи Me—С чрезвычайно важна для каталитической реакции: если связь слишком стабильна, то не сможет раскрыться для встраивания мономера, а если слишком нестабильна, то скорость распада будет выше, чем скорость внедрения мономера. Для приведенного комплекса в октаэдрическом состоянии связь Ті—С2Н5 в отсутствие мономера в течение 1 ч распадается с восстановлением Ті4+ до Ті3+ и выделением этана и этилена. Ускорение восстановления (дестабилизации связи С—Ті) происходит с увеличением способности добавленного неполимеризующегося олефина к координированию.
|
Пенталиенил): |
|
|
АОС, являющиеся акцепторами электронов, способствуют созданию электронной недостаточности у атома переходного металла, и это повышает склонность последнего к образованию я-комплекса с молекулой а-оле - фина. Оливе связывают такое влияние комплексообразования на каталитическую активность с электронными эффектами заместителей у атома алюминия. С по
мощью правильного выбора лигандов для данной каталитической системы и данного мономера стабильность связи может быть оптимизирована.
Титан различной степени окисленности является ак-. тивным, но каждый раз, согласно Оливе, для достижения оптимальной энергии связи Ті—С должен быть использован соответствующий алкилирующий агент (алкилалюминий, алкилмагний, алкилцинк и т. д.). Центральный атом — переходный металл катализатора— заряжен положительно. Связи между центральным атомом и лигандами слегка поляризованы:
Е - 6+ 6- L—Me—R
6-
Если один лиганд заменить на другой, который является лучшим донором электронов, то положительный заряд металла несколько уменьшится. Вследствие этого ослабевают связи между Me и другими лигандами. Таким образом, электронодонорные лиганды ослабляют связь Ті—С, а электроноакцепторные — стабилизируют. В работе [159] показано, что если для (С5Н5)2Ті(С2Н5)С1 активатором служит А1СЦ, то связь Ті—С так стабильна, что полимеризация не идет; если заменить один СІ в АІСІз на этильную группу (более электроно - донорную), то катализатор достигает нужной активности, если же и второй С1 заменить на С2Н5, связь Ті—С становится настолько нестабильной, что катализатор распадается прежде, чем наступит полимеризация.
На важной роли лигандов в каталитическом комплексе основана модификация катализаторов. Так, в работах Бадаева [160] активность каталитической системы А1(С2Н5)2С1 — ТіСЦ была повышена введением электронодонорных соединений — фенетола, анизола, дибутилового эфира; при этом также увеличивалась молекулярная масса получаемых полимеров.
Таким образом, в настоящее время для активных катализаторов превалирует представление о биметаллическом строении активного комплекса. Это подтверждается и следующими фактами.
Все каталитические системы, содержащие только органическое соединение переходного металла, обладают
Очень слабой активностью, значительно возрастающей
При введении АОС [13].
Стереорегулярность синтезируемого полимера зависит от природы МОС [144]. Так, для алкилгалогенидов алюминия она снижается при уменьшении радиуса галогена при одинаковых алкильных группах:
А1(С2Н5)21 > А1(С2Н5)2Вг > А1(С2Н5)2С1 > А1(С2Н5)з
Скорость полимеризации также зависит от типа МОС. Так, в работе [161] показано, что скорость полимеризации пропилена на ТіС13 при использовании различных алкилалюминийгалогенидов изменяется в следующем соотношении:
А1(С2Н5)2Г: А1(С2Н5)2Вг : А1(С2Н5)2С1 : A1(C2H5)2F : А1(С2Н5)з = = 1 : 1,5:2:3:6
Это, по-видимому, можно объяснить как изменением структурно-геометрических характеристик биметаллического комплекса, а следовательно и условий координации мономера, так и электронным влиянием заместителей (лигандов) на состояние (прочность) активной связи Ті—С.
По данным Северовой [74], относительная активность сомономеров этилена и пропилена при полимеризации в присутствии ТіСЦ и различных АОС меняется в зависимости от природы АОС.
Образование в циглеровских системах активных для полимеризации а-олефинов биметаллических комплексов обнаружено экспериментально: для системы (С2Н5)ТіС12 — А1(С2Н5)з рентгеноструктурным анализом [162], для системы (С2Н5)2ТіС12-А1(С2Н5)2С1 ИК-спектроскопией [163].
Как будет показано ниже, роль различных лигандов в биметаллическом комплексе велика как в реакциях роста, так и в реакциях обрыва и переноса цепи.