Механизм реакций роста и ограничения полимерной цепи
Особенности строения АЦ металлорганических комплексных катализаторов предопределяют протекание реакции роста цепи при полимеризации а-олефинов. Согласно работам Натта [164] реакция роста цепи происходит в две стадии: 1) координация мономера на катализаторе и 2) внедрение мономера по связи Me—R:
/□ к h2CJCH2 L„Me( + C2H4s=t L„Me—R-----------
. » /CH*—1сн,—Я-
Эта гипотеза была впервые выдвинута Натта на основании исследования относительной реакционной способности производных стирола при их стереоспецифиче - ской полимеризации под действием каталитических систем ТіСЦ — А1(С2Н5)з и ТіСЦ — АІ (С2Н5)3. Было обнаружено, что скорость реакции роста зависит от природы мономера, входящего в растущую цепь, и не зависит от природы концевого звена цепи. Эту удивительную особенность Натта объяснил тем, что реакция роста протекает в две стадии, причем суммарная скорость определяется первой из них [164].
Предположение Натта получило подтверждение в теоретическом квантовохимическом исследовании Косси [153], Армстронга с сотрудниками [165] и Авдеева с сотрудниками [166]. Разделяя точку зрения Натта о предварительной координации олефина, Косси [153] в основу теории механизма действия катализаторов положил концепцию я-связи олефина и переходного металла. По мнению Косси, в результате координации этилена с переходным металлом происходит перегруппировка уровней энергии, облегчающая последующие стадии. Разделяя мнение о том, что рост цепи осуществляется путем внедрения молекулы мономера между атомом металла и алкильной группой, Косси считал, что для осуществления этого необходимо, чтобы соединение переходного металла имело октаэдрическую конфигурацию, при этом одна позиция октаэдра является свободной, а остальные заняты другими лигандами.
Отдельные авторы [156] придерживаются гипотезы одностадийного механизма роста полимерной цепи без стадии предварительной координации мономера.
Однако исключение этой стадии, как показали кванто - вомеханические расчеты [166], привело бы к значительному (до 546 кДж/моль) увеличению активационного барьера роста цепи. Это не соответствует экспериментальным данным по полимеризации олефинов.
Вопрос о том, какая из двух стадий роста цепи является лимитирующей, также до сих пор остается дискуссионным.
Согласно Косси, точку зрения которого разделяют Оливе [167], лимитирующей является стадия внедрения. Теоретический анализ данного вопроса был выполнен Косси в работах [153, 168]. В них была использована простейшая модель АЦ, представляющая собой октаэд - рический алкилированный комплекс трехвалентного титана (с вакансией):
С1\ I,--С1
ОҐ I С1
Первоначальная геометрия АЦ после цыс-внедрения. мономера восстанавливалась, но с переменой мест вакансии и алкила.
Как показал Косси, связь металл-алкил сохраняется в течение всего реакционного пути, при этом энергетические потери в прочности этой связи не превосходят 20% и полностью компенсируются образованием новой связи. Подобные реакции следует отнести к типу согласованных, характеризующихся синхронным перераспределением электронной плотности в связях, что и обусловливает низкие энергии активации [153, 168]. . Аналогичные работы были проведены Армстронгом [165] для АЦ, моделирующих гомогенные системы. Методом квантовохимического анализа им было рассчи тано распределение зарядов в комплексе АІСЦ> ХТіСН3С13-С2Н4 и показано, что на всех стадиях мети и этилен остаются связанными с атомами титана. Связ между СН3 и Ті осуществляется за счет перекрывания орбитали углерода метильной группы с орбиталью Ті. Это обеспечивает возможность легкого перехода метильной группы к С-атому координированного мономера.
Таким образом, процесс миграции по Армстронгу не требует преодоления высокого потенциального барьера и сопровождается лишь слабым изменением орбитальных энергий комплекса. В связи с малыми значениями энергии активации на стадии внедрения Армстронг предположил, что стадией, определяющей рост цепи, является координация олефина. Процессу координации предшествует перестройка структуры:
АЦ —>• „Пирамида" —„Октаэдр"
В работе [166] подтверждено предположение Армстронга, что лимитирующей стадией является координация олефина. Методом квантовохимического анализа были рассчитаны значения энергии активации стадии внедрения и координации, которые составили соответственно 4,2 кДж/моль и 16,8 кДж/моль.
Таким образом, в настоящее время большинством исследователей приняты следующие основные положения механизма реакции роста полимерных цепей:
1) рост макромолекул включает две стадии — координацию мономера и внедрение его по связи Me—С;
2) лимитирующей стадией является координация мономера;
3) в каталитическом комплексе основная роль принадлежит переходному металлу, входящему в АЦ.
О роли металлорганического компонента в АЦ в процессе роста полимерных цепей до сих пор не существует единого мнения.
По мнению Армстронга [165], роль АОС для растворимых катализаторов заключается в стабилизации структуры АЦ с высоким координационным числом у иона титана, благодаря образованию мостиковых связей Ті и А1. Существенного влияния на энергетические уровни АЦ АОС не оказывают.
В работах Минскера с сотрудниками [169] с помощью квантовохимического анализа сопоставлены стадии внедрения олефина по связям Me—R—А1 и Me—R. В первом случае реакция роста протекает с более низкой энергией активации. По данным авторов, АОС принимает непосредственное участие в реакции присоединения мономера к растущей полимерной цепи путем
Одновременной электрофильной (со стороны ТІСІз) и
Нуклеофильной (со стороны АОС) атаки мономера.
Механизм реакции ограничения полимерной цепи, так же, как и другие элементарные акты процесса полимеризации олефинов, определяется особенностью АЦ комплексных катализаторов, их сложностью и многообразием. Эти реакции весьма разнообразны по природе и вклад их при полимеризации определяется природой компонентов каталитических систем, растворителем и параметрами процесса. Они включают как реакции передачи, протекающие с образованием нового АЦ, так и реакции истинного обрыва, при которых происходит необратимая гибель АЦ.
Впервые исследование реакций ограничения полимерной цепи в процессе полимеризации пропилена было проведено Натта с сотрудниками [144]. Авторы исследовали концевые группы полимерных цепей различными химическими и радиохимическими методами, а также методом ИК-спектроскопии. Изучалась также зависимость степени полимеризации пропилена от концентрации исходных компонентов реакции [катализатор — а-ТІС1з — Al(C2Hs)3]. В результате были предложены основные схемы реакции ограничения цепи, впоследствии принятые Косси и другими исследователями:
1) передача цепи на мономер
Me—СНг—С~
І н н СНз
1 I ^ I
СН2=С —V Me—СН2— СН2— СНз + СН2=С~
I
СНз
2) передача цепи на алюминийорганический компонент А1 (С2Н5)3
СНз
I
Me—СНг—СН~ + А1(С2Нб)з —>•
СНз
—» Me— С2Н5 + (C2Hs)2A1—СН,—СН~
Сн, I
C~
4) передача цепи на водород, растворитель или любой другой регулятор молекулярной массы
Me—СНг—СН—R + Н2 —> МеН + СН3—СН—R
I I
В отсутствие специальных регуляторов молекулярной массы ограничение полимерных цепей происходит главным образом при передаче на мономер и на металлал - кил. Так, в работе [98] было показано, что отношение скоростей основных реакций ограничения роста макро - молекулярной цепи при полимеризации этилена для системы ТіСЦ/MgO— А1(С2Н5)з при 7.0.°С составляет
"о ^" = 5,5:4,9:1,0
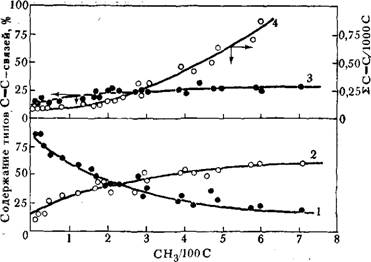
При ограничении цепи алюминийалкилами часть макромолекул содержит на конце цепи химически связанный алюминий [25]. При передаче цепи на мономер в полимере образуются различные концевые группы, соответствующие полимеризуемым мономерам: метальные, этильные, винильные, винилиденовые, транс-вини - леновые. Идентификация этих групп в ИК-спектрах по интенсивности полос поглощения 909, 888, 965 см-1 проведена в работе [19]. Показано, что распределение ненасыщенных связей по типам различно у ПЭ и СЭП. С увеличением содержания пропилена в сополимере возрастает как общее количество С = С-связей, так и доля винилиденовых групп (рис. 5.2). Образование винилиденовых групп, по-видимому, связано с протеканием реакции p-гидридного переноса от последнего про- Пиленового звена на координированную молекулу сомономера :
Me—СН2—СН—R + С2Н4 —* Me—CHS—СНз + R—С=СН2
І I
СНз СНз
|
3) спонтанный обрыв СНз I Me—СН,—С~ I Н |
|
Цепи —* Me—Н + СНг= |
Вероятность реакции ограничения цепи путем спонтанного переноса водорода от P-углеродного атома
к комплексу определяется валентным состоянием центрального иона в каталитическом комплексе. Чем выше его электроотрицательность, тем больше его способность отщеплять водород, находящийся в р-положении по отношению к комплексу, с образованием насыщенных концевых групп и, значит, более коротких макромолекул.
При гомополимеризации этилена эти реакции приводят преимущественно к образованию винильных групп:
Me—СН2—СН2—СН2—СН2—R —>■ —>■ МеН + СН2=СН—СН2—СН2—R (1)
Образование винилиденовых групп возможно за счет последующего встраивания в растущую полимерную цепь образовавшегося в результате реакции (1) оли - гомера:
Me—СН2—СН2—R + СН2=СН—СН2—СН2—R —► —> МеН + СН2=С—СН2—СН2—R
СН2—СН2—R
При сополимеризации этилена с пропиленом вместо винильной группы, при наличии заместителя у (5-угле - родного атома, будет образовываться винилиденовая группа:
Me—СНа—СН—СНа—СН2—R —► МеН + СН2=С—СН2—СН2—R
Г I
СНз СНз
Изучая реакции полимеризации этилена на гетерогенных катализаторах на основе ТІСЦ и различных АОС, Шиндлер [18] методом дейтерообмена определил, что за осуществление реакции ограничения цепи путем переноса лабильного гидрид-иона от р-углеродного атома к центральному иону ответственны каталитические центры, содержащие четырехвалентный титан.
При наличии водорода влияние [5-гидридного перехода на молекулярную массу относительно мало, так как константа скорости этой реакции на два порядка ниже, чем константа передачи цепи на водород. В то же время при одинаковой концентрации водорода увеличение содержания пропилена в системе в случае получения сополимеров этилена приводит к снижению срёднечис - ленной молекулярной массы., Это, видимо, связано
|
Рис. 5.2. Влияние состава СЭП на распределение С=С-свяаей при полимери* зацин на каталитической системе А1(«зо-С,}Нд)2Н : ТіСІ4= 1:1: |
/ —винильиые группы; 2— винилиденовые; 3 —транс-виниленовые; І—2 С=С/1000С^
|
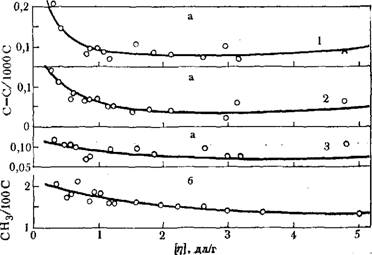
Рис. 5.3. Распределение С-=С-связей (а) и СНз-групп (б) по фракциям СЭП, полученного на каталитической системе А1(С2Н5)д: ТіСІ4=1 :1: /— винильиые группы; 2 — винилиденовые группы; 3 - транс-винилеиовые групцц..
|
С тем, что вероятность передачи цепи на водород для звеньев этилена и пропилена близка, а скорость реакции роста, определяемая координацией мономера, существенно различна.
Экспериментальное исследование С=С-связей по фракциям сополимеров показало [19], что основное их количество сосредоточено во фракциях с более низкой молекулярной массой. С ростом молекулярной массы фракции (до [л] = 1 2) содержание С = С-связей всех типов (винилиденовых, винильных и тракс-виниленовых) уменьшается, причем значительно, а далее меняется мало (рис. 5.3). Это связано с тем, что наиболее длинные макромолекулы образуются, когда практически отсутствует АЦ с ТіСЦ.
Можно полагать, что снижение молекулярной массы сополимера при увеличении содержания пропилена объясняется принципиально разными причинами при сополимеризации в отсутствие и в присутствии водорода. В первом случае это реакция p-гидридного перехода С последующим присоединением пропиленового звена, а во втором — снижение скорости роста цепи в связи с затруднением координации молекулы пропилена j 170].
ТАБЛИЦА 5.1. Содержание С=С-связей и распределение их по типам в ПЭ и СЭП, полученных на разных катализаторах
|
Содержание С=С-связей |
|
А> = К Ч х <0 ь- §2 X ш Й ° О ь |
|
Катализатор |
|
2 с=с 10U0C |
I
И
СЭП А1(С2Н5)2С1—ТіСЦ А1(С2Н5)з—ТіСЦ А1(изо-С4Н9)2Н—ТіСЦ А1(изо-С4Н9)2Н—ТіСЦ А1(«зо-С4Н9)2С1—VO(OC2H5)3 ПЭ АЦС2Н5)з—ТіСЦ
Al(C2H5)2Cl-VO(OC2H5)3
|
2 |
3,9 |
0,60 |
45 |
ЗО |
25 |
|
1 |
2,6 |
0,39 |
37 |
38 |
25 |
|
1 |
3,7 |
0,45 |
47 |
ЗО |
23 |
|
20 |
3,0 |
0,12 |
20 |
25 |
55 |
|
20 |
3,2 |
0,10 |
25 |
ЗО |
45 |
|
1 |
0,2 |
0,2 |
20 |
65 |
15 |
|
20 |
0,1 |
0,5 |
15 |
55 |
ЗО |
В случае применения гомогенных катализаторов при полимеризации олефинов реакции переноса цепи на мономер и спонтанный перенос протекают с меньшей вероятностью (табл. 5.1). В этом случае характерен перенос на алюминийалкил, что объясняется особым строением каталитического комплекса.
На гетерогенных нанесенных катализаторах обрыв цепи в основном осуществляется спонтанно или путем переноса цепи на мономер. Скорость этих реакций весьма мала, поэтому молекулярная масса ПЭНД, получаемого на этих катализаторах в отсутствие агентов обрыва цепи достигает нескольких миллионов.
Рассмотренные акты ограничения полимерной цепи, как правило, сопровождаются передачей кинетической цепи. Таким образом, на одну кинетическую цепь приходится много материальных цепей. Вновь образовавшиеся АЦ в основном менее активны, так как связь М—Н более стабильна.
Кроме того, возможен и бимолекулярный обрыв цепи, связанный с гибелью АЦ:
2Ме— СН2—СН2—R —> 2Ме + СН3—СН2—R + СН2=СН—R
Одновременно с обрывом цепи по этому механизму происходит восстановление переходного металла до более низкой степени окисленности.