ПУТИ РАЗВИТИЯ СОВРЕМЕННОГО ОРГАНИЧЕСКОГО СИНТЕЗА ЧТО МОЖНО ПОЛУЧИТЬ ИЗ УГЛЯ
|
К |
Оличество продуктов современного органического синтеза исчисляется многими миллионами тонн. Поэтому, как правило, промышленный синтез пользуется дешёвым сырьём, которое можно иметь в неограниченном количестве.
Для органического синтеза необходим, прежде всего, углерод. Природа щедро снабдила химиков этим сырьём: обычный каменный уголь — это почти чистый углерод.
План добычи угля в нашей стране на 1953 год составляет 320 миллионов тонн. Реализация решений XIX съезда партии в области добычи угля поставит угольную промышленность СССР на первое место в мире.
Кроме угля, для органического синтеза нужна вода. Правда, необходимы и другие более ценные химические продукты — кислоты, щёлочи и т. д. Но каждый из этих продуктов требуется в несравненно меньших количествах.
Что же можно получить из угля?
При нагревании без доступа воздуха из угля выделяются газообразные вещества и каменноугольный дёготь. В остатке мы получаем кокс — практически чистый углерод. Кокс идёт на нужды металлургии. Из кокса же теперь получают большое количество синтетических органических веществ.
При взаимодействии нагретого кокса с водой образуется главным образом смесь двух газов — водорода и окиси углерода (угарного газа). Эти газы находят разнообразнейшее промышленное применение как в виде смеси, так и порознь. Разделение их легко осуществляют путём глубокого охлаждения до температуры минус 190°; окись углерода превращается при этом в* жидкость, а водород остаётся в виде газа.
Из водорода и окиси углерода под давлением, при высокой температуре, получают жидкий продукт, по своему составу сходный с бензином и керосином,— с и н - т и н. Синтин вполне пригоден для использования его в качестве моторного топлива.
Если синтин обработать смесью хлора и сернистого газа, а затем щёлочью, то можно получить высококачественные мыла, называемые мерзолями. Такие мыла имеют ценную особенность. Когда мы моем что-либо обычным мылом в так называемой «жёсткой» воде (водопроводной, колодезной), то часть мыла тратится на то, чтобы «смягчить» воду, связать имеющиеся в пей соли кальция я других металлов. Эта часть мыла расходуется, таким образом, без пользы. Мерзоли же не боятся «жёсткой» воды. За это их часто называют сверхмылами. Смесь водорода и окиси углерода используется в больших
|
Жиры |
|
Раствори - Формаль - тели дегид Рис. 1. Эти продукты получают из каменного угля* |
|
Лекарственные Вещества Красители |
|
|
|
|
 |
|
|
|
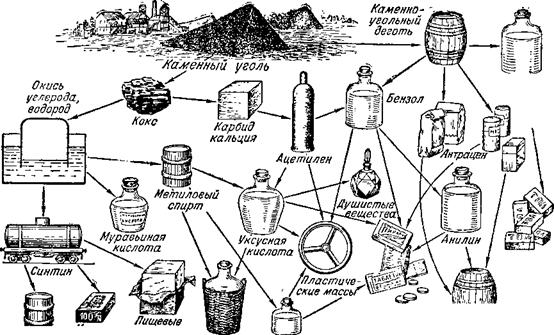
Количествах для получения метилового спирта. Этот спирт называется также древесным, так как раньше он добывался путём сухой перегонки дерева. Для получения метилового спирта смесь окиси углерода и водорода нагревают до 350—400° под давлением в 200 атмосфер в присутствии окиси хрома и окиси цинка.
Метиловый спирт находит разнообразное применение. Особенно много метилового спирта идёт для приготовления формальдегида. В настоящее время формальдегид получают действием кислорода воздуха на метиловый спирт. Сам формальдегид в огромных количествах идёт на приготовление пластических масс. Метиловый спирт находит и другое применение: он используется для синтеза растворителей, как горючее и т. п.
Недавно найден способ получения уксусной кислоты из метилового спирта. Для этого метиловый спирт нагревают с окисью углерода под большим давлением.
Окись углерода — ценнейшее органическое сырьё. Из неё, например, получают муравьиную кислоту (муравьиная кислота была обнаружена впервые в муравьях, откуда и получила такое название; между прочим, жгучее ощущение от прикосновения крапивы к телу человека обусловлено наличием в крапиве муравьиной кислоты, попадающей под кожу человека). Эта кислота находит разнообразное применение. 1,25-процентный раствор муравьиной кислоты, так называемый «муравьиный спирт», применяется в медицине как средство против ревматизма. Муравьиная кислота служит в качестве вспомогательной протравы при крашении шерсти и как консервирующее средство для фруктовых соков.
В промышленности муравьиную кислоту получают теперь нагреванием окиси углерода с едким натром при 150 градусах под небольшим давлением.
Если смесь кокса и известняка (мела) нагреть в электрической печи до 3000 градусов, то образуется карбид кальция. При действии на карбид кальция воды получается газ ацетилен, хорошо известный по применению для автогенной сварки. Чистый ацетилен лишён запаха. Характерный запах этого газа при сварочных работах обусловлен посторонними примесями.
Из ацетилена получают большое количество ценных веществ. Одно из них — уксусная кислота.
Без уксусной кислоты не может обходиться современная химическая промышленность. Уксусная кислота необходима в производстве пластических масс и красителей, искусственного шёлка и органических растворителей, душистых веществ, каучука и взрывчатых веществ. Кроме того, она уже давно применяется в текстильной и консервной промышленности, в кондитерском деле и т. д. До XV века, когда спрос на неё был небольшим, уксусная кислота приготовлялась кустарным способом — путём скисания вина. Когда потребность в ней возросла, уксусную кислоту стали получать путём сухой перегонки дерева. Этот способ долгое время был основным. Однако всё возрастающая потребность в уксусной кислоте поставила вопрос о получении уксусной кислоты из другого сырья. В 1881 году русский химик М. Г. Кучеров нашёл, что ацетилен в присутствии солей ртути взаимодействует с водой, образуя уксусный альдегид. Последний легко может быть переведён в уксусную кислоту. Для этого его нужно только окислить, то-есть соединить с кислородом.
Новый способ получения уксусной кислоты постепенно вытесняет старый. Однако у него есть один существенный недостаток: потребность в большом количестве электроэнергии. На получение одной тонны уксусной кислоты из ацетилена расходуется свыше 8500 киловатт-часов электроэнергии. Новый способ получения уксусной кислоты выгоден там, где есть дешёвая электроэнергия.
Химики стремятся найти и другие способы синтеза уксусной кислоты, без использования карбида кальция. Весьма важным является способ получения уксусной кислоты из метилового спирта и окиси углерода. Один из современных способов промышленного получения уксусной кислоты заключается также в окислении этилового спирта.
Невозможно здесь подробно рассказать о разнообразнейшем применении ацетилена в органическом синтезе. Ацетилен играет важную роль в приготовлении пластических масс и растворителей, искусственного каучука и лекарственных препаратов. Существует целая область науки — химия ацетилена. Выдающаяся роль
В её разработке принадлежит крупнейшему советскому химику — академику Алексею Евграфовичу Фаворскому.
Интересно, что долгое время замечательные исследования Фаворского казались сугубо теоретическими, так как ацетилен тогда получался трудным, дорогостоящим путём. Но как только был открыт дешёвый способ получения ацетилена из карбида кальция, эти работы сразу же приобрели огромное практическое значение. После смерти Фаворского исследования в области ацетилена успешно продолжаются И. Н. Назаровым, М. Ф. Шостаковским и многими другими советскими химиками-органиками.