Моделирование миграции подземных вод
Сорбция
Сорбцией называется процесс совместного действия адсорбции и десорбции, т. е. связывания или освобождения мигрантов на поверхности твердой фазы, выполняющей при этом лишь функцию «носителя», без изменения вещественного состава мигрантов и «носителя» (исключением является так называемая хемосорбция, имеющая обычно необратимый характер). Сорбция происходит под действием поверхностных сил, мерой потенциала которых является молярная энтальпия адсорбции Ahr, зависящая от форм связи адсорбируемых частиц. Основными видами таких поверхностных сил являются ван-дер-ваальсовы силы притяжения (Айг>50 кДж/моль); силы притяжения Кулона, возникающие вследствие противоположного заряда адсорбата и адсорбента; химические связи в результате ионных или ковалентных связей (АЛГ>500 кДж/моль).
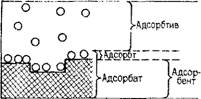
На рис. 3 приведены понятия, применяемые при описании сорбционных процессов: мигрант в адсорбированном и неадсорби - рованном состояниях называется соответственно адсорбтом и адсорбтивом, твердая фаза с прочно локализованным ад-
сорбом называется адсорбентом, а вместе с адсорбтом составляет адсорбат.
Если адсорбируемые частицы (мигранты) являются ионами, то процессы сорбции называют ионным обменом, а адсорбент — ионообм єн н и ко м. Количество вещества - всех, ионов, которое способен связать адсорбат, называется емкостью ионного обмена, или емкостью поглощения; она указывается обычно в виде количества вещества (миллимоли) на 100 г адсорбента.
Наиболее выражена способность к ионному обмену и сорбции у глинистых минералов, которые Являются слоистыми силикатами. Наиболее важны четыре глинистых минерала: каолинит (негидра - тированный диоктаэдрический двухслойный силикат), иллит (не - гидратированный диоктаэдрический алюмо-трехслойный силикат), монтмориллонит (гидратированный диоктаэдрический трехслойный силикат), хлорит (негидратированный триоктаэдрический че - тырехслойный силикат).
|
Рис. 3. Наглядное представление понятий, используемых при описаниях сорбционных процессов |
В межслойные промежутки трехслойных силикатов включены катионы, молекулы боды и гидрйтированные катионы. Их присутствием объясняется набухание (усадка) трехслойных силикатов. Способность глинистых минералов к конному обмену основана прежде всего на отрицательном заряде слоя, который возникает вследствие замещения ионов высокой валентности низковалентными (например, замена Si4+ в тетраэдрнческом и А13+ на Mg2+ в октаэдрическом слоях). Емкость анионного обмена глинистых минералов в противоположность катнонному незначительна (исключение каолинит). В качестве обменных анионов в глинах находятся РО43-, S042- и в очень небольшом объеме С1~ и N03~. Анионный обмен происходит преимущественно на поверхностях разрыва глинистых минералов и связывает анионы в гидроксиды алюминия. В табл. 4 приведены некоторые значения емкости поглощения для глинистых минералов в сравнении с гуминовыми кислотами и другими органическими веществами.
|
Таблица 4 Емкость обмена (поглощения) глинистых минералов и гумуса при рН7
|
Ионный обмен всегда происходит в эквивалентных количествах вещества (закон сохранения электронейтральности раствора). При ионном обмене с горными породами в качестве адсорбентов действуют прежде всего глинистые минералы» цеолиты, гидрокси - ды или гидроокись железа, марганца, алюминия, органические вещества (гуминовые вещества, продукты обмена веществ микроорганизмов), а также в незначительном количестве породообразующие минералы, такие как слюда, полевые шпаты, роговая обманка. Все они обнаруживают более или менее отчетливо выраженную селективную способность по отношению к различным частицам адсорбта.
С ростом размера частиц сорбционная способность, как правило, уменьшается. При сорбции ионов увеличиваются связи с зарядом частиц. Исключения из этих основных правил отмечаются в тех случаях, когда ионы входят в кристаллическую решетку и их обмен становится затруднительным. Несмотря на наличие таких структурных особенностей, между адсорбатом и адсорбентом можно указать следующий обычный ряд по энергии поглощения для гидролизированных катионов: Li+>Na+>H+>-K+>NH4+> >Rb+>Cs+; Mg2+>Ca2+>Sr2+>Ba2+. Способность к сорбции очень сильно зависит от значения рН. Адсорбент называют амфотерним, когда он при определенном значении рН — изоэлектри - ческом пункте — изменяет способность катионов и анионов к адсорбции. Это типично не только для глинистых минералов, но и для кремнистой кислоты, гидроокиси или окислов А1 и Fe (прежде всего для еще не полностью выкристаллизованных), которые имеют на своих поверхностях функциональные группы с амфотер - ными свойствами.
В качестве примера рассмотрим подробнее обмен катионов Na+ И Mg2+ в обменнике катионов R : 2Na++Mg=i?3^Mg2++ +2Na==i?. Отсюда получается константа термодинамического равновесия К•
Mg = (Mg2+) (Na (ad)}2 /({Na+}2 {Mg (ad)}) и соответственно
[Mg2+}/{Na+}2 = Кш> Mg (Mg(ad)\/{Na (ad)}2.
Если рассматривать адсорбционную пленку обменника катионов как твердый бинарный раствор, то можно записать
{Mg (ad)} - 7м* (erf) [Mg(J)]+(2?Na(arf)] ~ Тм« INa (ad)\ 2[Na(ad)] --y x
И после этого получить
2
К __ {Mg2"1-} TNa (а4)*Уа (ad)
Na. Mg }Na+}2 lMg(ad)xMg(ad) '
Константа равновесия для Na (ad)=yMg{ad)=\ называется коэффициентом селективности Ks a, Mg. Используются также другие определения этого коэффициента, например:
Г = /IMg.(fltf)1 = / [Mg (ad)]
Na-Mg 2[Na+]/2[Na (atf)l [Na+] / [Na (arf)l
Для описания равновесного состояния сорбционного процесса используются изотермы сорбции, связывающие концентрацию мигранта с в растворе (жидкой фазе) с сорбцйонной емкостью, представляющей собой удельное (в единице объема породы) содержание мигранта в твердой фазе [4]. Форма и параметры изотермы сорбции устанавливаются экспериментально. Наиболее простой и употребительной является линейная изотерма Генри [7, 11, 29, 37]:
N^Kdc, (3.1)
Где Kd — коэффициент распределения, являющийся важнейшим параметром сорбционных процессов. (Применяемые в зарубежной литературе величины Ка отличаются от принятого в выражении (3.1), поскольку используют определение сорбцйонной емкости относительно единицы массы (навёски) поррды). Изотерма Генри применима при сравнительно небольших концентрациях мигранта и широко используется, в частности, при изучении загрязнения подземных вод.
Более общий характер имеет изотерма Ленгмюра [11, 26, 36]:
Где No и Kl — параметры, причем N0 имеет смысл предельной сорбцйонной емкости (при с->оо). Изотерма Ленгмюра получается в предположении, что интенсивность сорбционного процесса пропорциональна концентрации раствора и числу незанятых мест для поглощающегося мигранта в твердой фазе, а1 интенсивность десорбции пропорциональна количеству поглощенного вещества. Нетрудно видеть, что изотерма Генри представляет собой частный случай изотермы Ленгмюра при КОс.
Используются также некоторые другие формы изотермы сорбции, в частности, изотерма Фрейндлиха [11, 35] : N — — KfC~i, где Kf й q — параметры изотермы, определяемые эмпирическим путем.
При ионном обмене соотношение между концентрациями двух катионов в жидкой и твердой фазах основывается на законе действующих масс. В частности, для бинарного раствора, включающего два катиона с валентностями г1 и z2, равновесное распределение их концентрации в жидкой фазе сг и с2 и в твердой фазе N і и
|
Еровалентік (Zi = l, z2=: ДГ = і 4іУ0(Са-Сі) 2(са~с,) Ц /С12сі2 |
Nz, в соответствии с законом действующих масс описывается уравнением
Где Ki2 — константа равновесия.
Кроме того, из условий сохранения электронейтральности раствора и постоянной емкости поглощения следует, что
+ й = л^ + л^іУо, (3.4)
Где с а — концентрация анионов в растворе; N0— полная емкость катионного поглощения.
В общем случае многокомпонентного раствора выражение для парциальных констант равновесия Кц имеет вид
<3-5)
Где Ni и Nj — удельное содержание І-го и /-го катионов в твердой фазе при их концентрации е,- и с/ в растворе.
Условия сохранения энергии и вещества при этом можно записать в следующем виде: 2с£ = еа; 'LNi—No.
Уравнение изотермы сорбции для многокомпонентного раствора с концентрацией мигрантов Сі и Ni в жидкой и твердой фазах можно получить, считая число свободных мест в поглощающей (твердой) фазе пропорциональным N0—2ЛГ,-. При такой предпосылке при равновесной реакции ионного обмена оказывается справедливой изотерма ленгмюровского типа:
Основываясь на этих выражениях, можно показать, что графическое представление реакций ионного обмена N\-~-Ci (или Лг.-ьс2) дает все три основные формы изотерм — линейную, выпуклую, вогнутую.
Для описания кинетики ионного обмена, следующего изотерме Генри, чаще всего используется уравнение обратимой линейной кинетики первого порядка:
(W); Р = (3.7)
Это уравнение применялось для расчетов сорбции гербицидов, органических веществ, нитратов и нитритов.
Для процессов, следующих изотермам Ленгмюра и Фрейндлиха,, используются аналогичным образом построенные уравнения нелинейной кинетики сорбции [29].
При миграции суспензированных частиц характерна физическая сорбция, которая обусловлена механическим удерживанием и отрывом частиц в пористой среде, (в почве или породе). Физическая сорбция также является процессом взаимодействия адсорбции и десорбции, которые, соответствуя заданным условиям, стремятся к динамическому равновесию. Возможность переноса взвешенных частиц в пористой среде контролируется геометрическим критерием, учитывается связь между узкими местами каналов течения в пористой среде fi? Kmln и движущимися частицами с диаметром d, которые должны пройти ' через эти узкие места: d < FdK, причем величина фактора проходимости F зависит от метода оценки d и dKmln, величины транспортируемых частиц (F увеличивается с ростом d), формы частиц, фактора образования мостиков между частицами и др. [7].
Кинетика физической сорбции обычно упрощенно описывается уравнением необратимой реакции первого порядка для скорости осаждения [7]
Ъ'ос =* К«с, (3.8)
Где с — концентрация мигранта в жидкой фазе; Кос — константа скорости осаждения.
Если объемы сорбируемого вещества и порового пространства становятся сопоставимыми, то происходит так называемая кольма- тация, приводящая к уменьшению проницаемости породы. Теоретическая модель этого процесса, учитывающего его кинетику согласно уравнению (3.8), описана в работе [7]. Вместе с тем на кольматацию могут оказать существенное влияние такие организмы, как черви, коловратки, инфузории и. т. п., которые используют кольматационный материал (содержащий наряду с суспензированными частицами и коллоидами неорганических и органических веществ бесчисленное множество микроорганизмов) в качестве пищи, очищая при этом поровые каналы и создавая новые ходы. Сочетание таких процессов приводят к тому, что в поровом пространстве устанавливается состояние равновесия, характеризуемое определенной водопроницаемостью.