Моделирование миграции подземных вод
Окислительно-восстановительные процессы
В то время как отличительным признаком реакции протолиза была передача протона Н+ от кислоты к основанию [см. выражение (2.27)], при окислительно-восстановительных Процессах (Red-ox - процессы) происходит передача п элементов е~ от восстановителя Red к окислителю ох:
VRed Z чох + пег. (2.30)
Под окислением понимают процесс отдачи (восстановитель •окисляется), а под восстановителем — приема (окислитель восстанавливается) электронов. Электроны, распределенные между двумя атомами, произвольно относят к более электроотрицательному из них или делят поровну, если атомы одинаковы.
Полная передача электронов', как и полная передача протонов, требует соединения двух сопряженных окислительно-восстановительных пар [см. уравнения (2.27) —(2.29)]. Свободные электроны в водном растворе постоянно не присутствуют:
Отдача ег (окисление) Redt: v, Redx v, ox + ne~; прием e~ (восстановление) ox2: \ox2 ^ y2Red2 Red-ox-$e&Kiim\ ytRedx + v2ox2 vxox, - f - vtRed2.
Определение константы равновесия К для окислительно-восстановительных процессов осуществляется по аналогии с вышеописанным.
Пример.
Fe2+ Fe3+ - f е-, &rG° = + 74,40 кДж;моль; 1 /4 02 + Н+ + er it Н20; ArG« = - 118,65 кДж/моль; 1 /4 02 + Fe2+ + Н+ ^ 1 /2 Н20 + Fe3+; Д^О0 - — 44,25 кДж/моль; lg*ojr —13,03; = 20,79; lg = 7,75.
Степень окисления железа повышается от 2 до 3, а у кислорода в молекуле воды она снижается от 0 до —2.
По аналогии с величиной рН как степенью активности протона используется значение рЕ=—lg {е~} в качестве степени актив - 32 ности электрона. Для основного уравнения (2.30), согласно уравнению (2.6), получим значение ArG:
A#G =..V? o + 2,3RTlg({oxy fe~}"/{Red}%
Тогда в условиях термодинамического равновесия (A#G = 0)
РЕ=рЕ°+ (v/n) lg ({ox}/{Red}), pE° = A#G0/(«2,3/?T). (2.31)
Вместо значений pE часто используют величину окислительно - восстановительного потенциала Eh:
Eh - (2,3RT/F) pE, (2.32)
Где F — постоянная Фарадея. При F—9,65-104 кл/моль и RT25 °с= = 2,479-103 Дж/моль согласно выражению (2.32) Eh=0,059 рЕВ.
Уравнение Нернста можно получить из уравнений (2.31) и (2.32):
Eh = Eh° + [v2,3RTi(nF)} lg ({ox}/{Red
Eh0 —&RG° I (nF).
Для рассмотренного выше примера получим: Fe2+^F3+-f-e~; A^G°=74,4 кДж/моль; рЕ°= 13,05; соответственно Eh°= +0,77В. Увеличивающийся восстановительный потенциал (восстановительная среда) характеризуется низкими значениями рЕ° и Eh°.
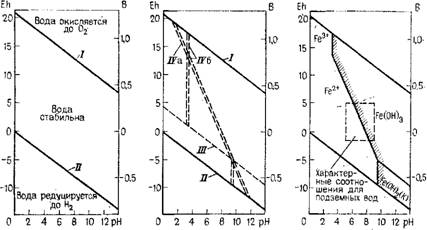
Диаграммы рН = рЕ часто называют диаграммами стабильности. Они получили достаточно широкое распространение в гидрогеохимии. Для понимания сути этих диаграмм упрощенно поясним их построенйе на примере водорастворимых соединений железа. Прежде всего охарактеризуем стабильность самой воды с помощью двух полуреакций: 1/4 02(г) [3] + 1/2 Н20; A*G°=
=—11,8,65 кДж/моль; lgtf=20,8; Н20+ 1/2 Н2(г)+ОН-; A«G°=79,9 кДж/моль; lgK=—14,0, где К—коэффициент равновесия.
Согласно уравнению (2.8) с учетом (2.3) запишем: 1 / К(г)1н+} ) = 102М; хЩ{г) {ОН-\l\er\ = 10-», а логарифмируя, получим
РЕ = 20,8 - рН + 1/4 lgx02(r); pE = - рН - 1/2 lg^{r). (2.33)
Уравнения (2.33) получены при допущении, чтолг0і = 1 и хНі = 1, т. е. пои парциальном давлении 10s Па (линии / и II на рис. 2,а). Выше линии7 Н20 разлагается вследствие окисления на газообразный кислород и Н+, а ниже линии II, при восстановлении, на газообразный водород и ОН - [6].
Границу стабильности между Fe(OH)3 и Fe(OH)2 в качестве твердых веществ можно получить из реакции: Fe(OH)3(k)-fH+-f - + (ОН)2(k) +Н20 ArG°~ —26,2 кДж/моль lg/C=4,59, что
Соответствует положению линии III на рис. 2,6 согласно выраже
ниям: 1/({Н+) {<?-}) = І0+4'59 или рЕ —4,59— рН. Ниже этой линии стабильна Fe(OH)2, а выше — Fe(OH)3.
Граница стабильности ионов Fe3+ в растворе в пересчете на Fe(OH)3(K) устанавливается по следующим выражениям Fe(OH)3(K) + 3H+=pfcFe3+ + 3H20;
27,5 кДж/моль; lg >C=4,82; {Fe3+}/{H+}3 = 104-82 или pH= = 1,61—1/3 lg {Fe3+}.
При предположении (!), что активность.,Fe3+ = 10~s или JO-6, получим соответственно линии 7Va и IVв на рис. 2,6. При допущении (!) Fe2+=.10^5 или 10—5 из уравнения реакции следует: Fe(0H)2+2H+=^Fe2++2H20; ARG — ——75,7 кДж/моль; lgtf= 13,26; {Fe2+)/{H+}2= І О13 26 или рН = = 6,63—l/21g{Fe2+}, что и определяет в восстановительной среде положение линий Va и Ув.
В заключение отметим еще границу между Fe2+ и Fe(OH)3: Fe(OH)3+ + ЗН++е~Fe2++3H20; ДдЄ°=—101,9 кДж/моль; lgtf= 17,85; Fe2+'/({H+}3X Х{е~}) = 1017'8S, соответственно уравнение этой границы можно записать в следующем виде: рН=1/3(—IgFe^-f 17,85—рЕ); при {Fez+}=10-5 или 10-6, оно определяет положение линий VIа и У/в (на рис. 2,6).
При практическом использовании подобных диаграмм стабильности нужно иметь в виду, что получаемые по ним границы действительны лишь при условии использования активностей и стандартных потенциалов Дц°. Но последние для таких соединений, как Fe(OH)3(k), зависят и от типа кристаллического вещества [25]. Тем не менее эти диаграммы, конечно, могут быть использованы для наглядной интерпретации гидрогеохимических данных. Более детально их применение и приёмы построения изложены в работе [6].
|
А 6 в |
|
Рис. 2. Диаграммы стабильности воды (а) и Ьсновиых соединений железа (б, в) в водном растворе |
Наибольшие ограничения связаны с неравновесностью многих природных систем, обусловленной медленной и весьма сложной кинетикой природных процессов. 34
Различают две серии типичных окислительно-восстановительных процессов в подземных водах в зависимости от того, постоянно присутствует в них растворенный кислород почвенного воздуха (открытая система) или нет (замкнутая система).
После проникновения инфильтрата в грунтовые воды (водона - сыщенную зону) воздух зоны аэрации практически не дает дополнительного притока 02 (замкнутая система). Кислород, ранее растворенный в инфильтрате, расходуется на окисление органических ветцеств, которые одновременно служат донором электронов и источником энергии. Если весь кислород в грунтовых водах израсходован, то функция акцептора электронов переходит к нитратам, которые при этом восстанавливаются. После использования нитратов в усиливающейся восстановительной среде (убывающие значения рЕ или Eh) восстанавливаются Мп4+ и Fe3+ и в конечном счете: сульфат до сульфида, диоксид углерода до метана и азотсодержащие вещества до аммония.
Ниже приведена серия типичных окислительно-восстановительных процессов, при которых СН20 органических веществ (условно называемые «сахарный элемент») реально представлен, например, моно-, ди-, олиго - и полисахаридами, жирными кислотами, аминокислотами или фенолами [57]:
Реакция Уравнение
Эоздушная респирация СН20+02(в)->С02-|-Н20
Деиитрификация СН20+4/5 N03-+4/5 Н+-»С08+2/5 N2(r) +7/5 HjO
Восстановление Мп4+ СН20+2Мп02(к)+4H+->2Mn2+-f ЗН20+С02
Восстановление Fe3+ CH20+8H++4Fe(0H)3->4Fe2+ + iiH20+C02
Восстановление сульфа - СН20+ І/2 S042~ +1/2 Н+-Н/2 Н-+Н20+С02 тов
Метановая ферментация СН20+1/2 С02->1/2 СН4+С02
Фиксация азота СН20+Н20+2/3 N2+4/3 Н+->4/3 NH<+ + С02
Начало восстановления N03- при Eh 0,45—0,55 В (рН7)
Начало образования Мп2+ при Eh 0,35—0,45 В (рН7)
Подтвержденная граница для растворенного кислорода при Eh 0,33 В
Подтвержденная граница для N03~Eh 0,22 В
Начало образования Fe2+Eh 0,15 В
Начало образования S042" и S2-Eh 0,03 В
Подтвержденная граница для S042~Eh 0,18 В
Кислород воздуха, постоянно поступающий в зону аэрации посредством диффузии с определенным градиентом парциального давления кислорода, определяет свою серию типичных окислительно-восстановительных процессов [57]:
Реакция Уравнение
Воздушная респирация 02(в) +СН20-*-С02(в) +Н20
Окисление сульфидов 02(в) +1/2 HS--H/2 S042~+1 /22Н+
Окисление Fe2+ O2(B)+4Fe2+ + 10H2O->4Fe(OH)3+8H+
Нитрификация 02(в) +1/2 NH4+-H/2 N03~+H+ +1 /2 Н20
Окисление Мп2+ 02(в)+2Мп2++2Н20->2Мп02(к)+4Н+
Все эти процессы катализируются микроорганизмами, а именно подвергаются каталитическому действию энзимов (продуктов обмена веществ) при достижении определенной скорости реакции обмена. Важнейшими организмами такого «биокатализа» в водо - насыщенной зоне служат бактерии, а в зоне аэрации — грибки, водоросли и т. п. Размер бактерий соизмерим с размером коллоидов, но они меньше суспендированных частиц (от 0,3 до 5-10"6 м). Выделяемые энзимы резко уменьшают необходимую для реакций окисления и восстановления энергию активации. При этом локальная микросреда около этих микроорганизмов существенно отличается от средней статистической. Из окислительно-восстановительных процессов бактерии извлекают энергию, необходимую для обмена веществ. При этом минимальная молярная энтальпия реакции ArH равна или превышает 60 Дж/моль [57].
В зависимости от того, требуется ли для жизнедеятельности бактерий кислород, различают аэробные, анаэробные и факультативные бактерии. Для питания они используют такие доноры электронов, как углерЬд, азот, серу или фосфор. Отдельные виды бактерий часто отличаются по потреблению микроэлементов.
Даже из этого краткого описания видно, что роль бактерий в подземных водах очень велика, однако исследование микробиологических процессов в почвенных и грунтовых водах все еще находится в начальной стадии.