ВАНАДИЙ
В 1830 г. шведский химик Зефстрем открыл в железной руде из г. Таберга (Швеция) новый элемент, которому из-за цветового многообразия соединений дал название "ванадий" по имени древнескандинавской богини красоты Ванадис.
В 1867 г. английский химик Роско выделил металлический ванадий (чистотой около 96 %) путем восстановления VC12 водородом. В дальнейшем многие исследователи безуспешно пытались получить более чистый ванадий. Ванадий в силу трудности его очистки от кислорода, азота, углерода и водорода получался только в виде хрупких образцов. Лишь в 1927 г. Мардену и Ричу удалось получить первые образцы ковкого ванадия восстановлением V2Os кальцием.
Свойства ванадия
Ванадий - элемент V побочной группы периодической системы. Высокая химическая активность ванадия обусловлена ertf положением в начале ряда с законченной 18-электронной оболочкой.
Некоторые физико-химические свойства ванадия приведены ниже:
Порядковый номер 23
Атомная масса 50,942
Атомный радиус, им 0,13112
Атомный объем, см3/г-атом 9,1
Ионный радиус Э+5, нм 0,04
Изотопы (природные) 47;48;49;50;51;52
Плотность (при 20 С), г/см3 .... 6,11
Температура плавления, С 1900±25
Температура кипения, С 3350
Твердость по Бринеллю с обжатием
Более 99 %, МПа 600
Скрытая теплота плавления, Дж/г. . 334,4
Удельная теплоемкость, Дж/(г • К) . . 0,480 (при 0-100 °С)
Удельное электросопротивление
Р • 106, Ом 'см 26 (после холодной
Обработки)
Температурный коэффициент электросопротивления • 10~4, Ом • см/К. • 35 (при 20 С) Удельная магнитная восприимчивость
■ 106, ед +1,4 (при 18 °С)
Температурный коэффициент линейного
Расширения а • 106 ,К-1 9,6 (при 20-1100 С)
Коэффициент теплопроводности,
Дж/(см • с • К) 0,309 (при 100 °С)
Сечение захвата тепловых нейтронов
Л' 1024 , см2 5,1±0,2
Ванадий кристаллизуется в кубической объемноцентрированной кристаллической решетке с периодом а = 0,30282 нм.
В виде порошка ванадий имеет серый цвет, в компактном виде - стальной серый. Чистый металл, не содержащий нитрида и карбида, пластичен. Его можно легко протягивать в проволоку и при обычной температуре прокатывать в листы и тонкую фольгу. Металл, содержащий нитриды или карбиды, тверд и хрупок.
В виде порошка при нагревании ванадий энергично соединяется с кислородом, серой и хлором. Компактный металл при обычной температуре даже во влажном воздухе остается блестящим. При нагревании в воздухе и в кислороде он, изменяя цвет, покрывается оксидами различных степеней окисления и, наконец, сгорает в высший оксид V2Os. При нагревании в азоте - образует нитриды VN, VN2, V3N. В избытке хлора ванадий образует тетрахлорид. Ванадий растворяет водород Ідо 42 % (ат.)].
В компактном состоянии устойчив к действию различных реагентов. Ванадий, помимо HF, растворяется только в кислотах, являющихся сильными окислителями: HN03, царской водке. Растворы щелочей на металл не действуют, однако расплавленные щелочи постепенно его растворяют. Твердые углеродсодержащие восстановители и углеродсодержащие газы при нагревании взаимодействуют с ванадием с образованием карбида VC.
Оксиди. Получено четыре типа соединения ванадия с кислородом: монооксид ванадия VO (или V,02) - черный порошок, оксид ванадия (III) V203 (черный порошок), диоксид V02 (голубого или черного цвета, в зависимости от способа получения) и оксид ванадия (V) V2Os. Высший оксид ванадия, или ванадиевый ангидрид, V2Os - наиболее важное из всех соединений ванадия. Оксид ванадия (V) бывает двух модификаций - аморфной и кристаллической. Аморфный V2Os - красный, оранжевый или желтый порошок, кристаллический - красного цвета. Плотность V2Os 3,32-3,56 г/см3, температура плавления 660 С. Плавление сопровождается выделением кислорода; наличие щелочных металлов способствует разложению. Вещество негигроскопично. Растворимость в воде невелика: 0,005-0,07 % при 25 С по данным различных авторов.
Водные растворы V2Os имеют кислую реакцию и, реагируя со щелочами, образуют соли. В зависимости от кислотности раствора выделяющийся в осадок гид-
ратированный V2Os имеет состав V2Os ■ 3H20, V2Os • 2Н20, V2Os ■ Н20, что соответствует орто-, пиро - и метаваиадиевым кислотам.
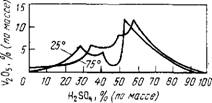
На рис. 34 представлены области существования фаз в системе V205-H2S04-H20 при 25 и 75 С. Три ветви каждой из изотерм отвечают выделению из растворов перечисленных гидратных форм при увеличивающихся концентрациях серной кислоты. Если концентрация H2S04 при 25 С выше 53,17 % и при
Рис.34. Изотермы растворимости при 25 и 75 С в системе V2Os - H2SO, - н2о
75 °С выше 57,56 % (четвертая ветвь изотерм), то в растворе устойчива фаза V2Os. При добавлении минеральвых кислот к растворам ванадатов происходит постепенное изменение состава ионов, содержащих ванадий. В конечном счете из растворов выпадает красновато-коричневый студенистый осадок гидратиро- ванного оксида V2Os • ЛЯ20.
Ванадати. Соли, в состав которых в качестве кислотной части входит в химически связанном состоянии V2Os, очень многочисленны и подразделяются на несколько типов. Наиболее обычны три типа ванадатов: ортованадаты 3Ме20' V20, или Me3VOA, пированадаты 2Ме20 * V2Os, или Me4V207, метаванадаты Afe20 • V2Os, или MeV03 (где Me — ион одновалентного металла). Некоторые из зтих солей имеют и некоторое число молекул воды.
Кроме указанных типов солей, существует обширный класс ванадиевых солей, называемых гюливанадатами. Отношение числа молекул V2Os в составе этих солей к числу молекул основного оксида выше, чем в метаванадатах. Пример - гексаванадаты - соли гексаванадиевой кислоты H4V6017, или 3V2Os • 2Н20. При обработке ортованадата натрия Na3V04 возрастающими количествами соляиой кислоты в конечном растворе находят ионы [HV6017]3-. Изменение состава ионов происходит в следующей последовательности (начиная с иона VOJ-, при-, сутствующего в случае ортованадата):
2V04 + 2Н+ *"V207 + Н20 (пированадат, рН-12^10,6);
3V207 + 6Н+ *-3V30^ + ЗН20 (метананадат, рН-9*8,9);
2V3Oj + ЗН+ »HV6Oi7 + Н20 (гексаванадат, рН-7*6,8).
Метаванадаты аммония NH4V03, кальция Ca(VO-j)2, железа Fe(VOJ)2 малорастворимы.
Галогениды. Ванадий образует галогениды и оксогалогеииды степени окисления 2; 3; 4; 5. Практический интерес представляют VFS, VC12, VC13, VC14, VOCl3. Высшие галогенопроизводные - легколетучие соединения, низшие - при нагревании диспропорциоиируют. В воде разлагаются в результате гидролиза.
Сульфиды. Ванадий и сера образуют сульфиды: VS(V2S2), V2S3 и V2S5. Сульфиды - вещества темно-коричневого или красного цвета. На воздухе окисляются с образованием V2Os и S02.
Области применения
В качестве легирующих добавок ванадий стали применять в металлургии еще в конце прошлого столетия.
Возможность использования самого металла и сплавов на его основе появилась совсем недавно - после освоения производства чистого металла. Значительную часть ванадия используют в виде оксидов, солей и других соединений.
Черная металлургия. Около 90% ванадия используют для легирования сталей и чугунов. В специальных сортах сталей ванадий способствует образованию тонкой и равномерной структуры, делает сталь более плотной, повышает вязкость, предел упругости, временное сопротивление, предел прочности при изгибе, расширяет интервал закалочных температур. Карбиды ванадия повышают твердость стали, увеличивают сопротивление истиранию и ударным нагрузкам. Ванадий - важная добавка в инструментальной (до 2 %) и конструкционной (до 0,2 %) сталях, сталях для газопроводов высокого давления. Развитие тяжелого и транспортного машиностроения "обязано" ванадиевомарганцевой стали, отличающейся большим сопротивлением удару и усталости. Ванадий используют для легирования сталей в комбинации с хромом, никелем, молибденом, вольфрамом. Ванадием легируют также чугун. В машиностроении применяют чугунное литье с присадкой 0,1- 0,35 % V для изготовления паровых цилиндров, поршневых колец и золотников паровых машин, прокатных валков, матриц для холодной штамповки. Он - компонент сплавов для постоянных магнитов. Вводят ванадий в сталь в виде феррованадия - сплава железа с 35-80% V.
Цветная металлургия. Ванадий применяют для производства сплавов на железной основе (меднованадиевые сплавы и ванадиевые бронзы). Из сплава Ti-4%Al-4%V изготовляют элементы авиационных реактивных двигателей, ракет. Аналогичное применение находят сплавы Ті - 13 % V - 11 % Сг - 3% Al и Ті - 6% Al - 4% V. Ванадий применяют как материал для оболочек ядерных реакторов и покрытия топливных элементов, производства сверхпроводящих сплавов.
Химическая промышленность. Оксид ванадия V2Os имеет большое значение как активный катализатор при синтезе органических веществ (ацетальдегида и уксусной кислоты, бензальдегида и бензойной кислоты), при контактном способе производства серной кислоты. VOCl3 - катализатор в производстве некоторых каучуков и других полимеров.
Химические соединения ванадия. Ванадаты элементов І-Ш групп используют для получения люминофоров с белым свечением и со свечением в любом диапазоне видимого света, для применения в ртутных лампах высокого и низкого давления, для цветных и обычных кинескопов. Описаны лазеры на основе ортованадатов иттрия, лантана, гадолиния, лютеция. В сельском хозяйстве растворимые соли мышьяко - вистованадиевой кислоты используют в качестве фунгисидов и инсектисидов. Текстильная промышленность применяет ванадаты в качестве протрав при крашении хлопчатобумажных тканей. В медицине применение ванадия основано на окислительных и антисептических свойствах его соединений. Соединения ванадия широко используют в стекольной и керамической промышленности благодаря их разнообразной окраске, а также в фотографии и кинематографии в качестве проявителей, сенсибилизаторов и красителей фотопленки и отпечатков.
Основные производители ванадия и его соединений в капиталистическом мире - ЮАР, США, Финляндия и Чили. Производство ванадия в 1981-1989 гг. составляло (44-45 тыс. т в пересчете на V2Os).
Большая часть ванадия (~83%) расходуется в виде феррованадия и нового ванадиевого сплава (83-86 % V, 10-13 % С, 1-3 % Fe), Новый сплав, получивший название "Карван", по свойствам не уступает феррованадию, а стоимость его значительно ниже. Около 3 % ванадия расходуется в виде оксида ванадия (V), 3 % - в виде метаванадата аммония NH„V03.
Экспортная цена на оксид ванадия (V) - 24,5 долл. за 1 кг (1989 г.), феррованадия - около 114 долл. в расчете на 1 кг ванадия.
Минералы, руды и месторождения
Массовое содержание ванадия в земной коре (0,02 %) превышает содержание меди, цинка или свинца. Однако самостоятельные промышленные месторождения встречаются редко - он рассеян в различных минералах и горных породах. Характерная особенность промышленных ванадиевых руд -
комплексность. Из собственно ванадиевых минералов (всего их известно более 50) наибольшее значение имеют следующие.
Роскоэлиг KV2[AlSi3O10](OH)2 - ванадийсодержащий мусковит (32,4 % V203). Руда представляет собой песчаник, сцементированный роскоэлитом. Содержание V203 в рудах достигает 3-5 %. Месторождения известны в Западной Австралии, США и СССР.
Роскоэлитовая руда Центрального Казахстана характеризуется тесным переплетением рудных минералов с глинистыми и углисто-органическими веществами. Содержание V203 в не - обогащенной руде 0,06-0,10 %.
Патронит V2Ss';cS - очень редкий минерал. Известно лишь одно крупное месторождение в Перуанских Андах. Содержит 19-25 % V2Os. Ассоциирован с гипсом, куискуитом.
Ванадинит Pb5(V04)3Cl. Встречается в зоне окисления свинцово-цинковых сульфидных месторождений. Содержит 19,40 % V2Os. Крупнейшие месторождения находятся в Юго - Западной Африке. Найден в СССР. К этому же типу относится ряд других минералов, в которых свинец частично замещен цинком и медью: деклуазиты.
Карнотит K2(U02)2[V04]2-3H20 содержит 19,80% V2Os. Распространен в зоне выветривания осадочных пород, главным образом песчаников, обогащенных органическими остатками. Известные месторождения находятся в США. В добываемой сейчас руде содержится 1,5-2,0 % V2Os; 0,2-0,4 % U3Og. К этому же типу уранил-ванадатов относится тюямунит Ca(U02)2[V04]2 • 8Н20, образующийся за счет замещения в карнотите калия на кальций. Содержит 19,06 % V205; 59,96% U03.
В рассеянном состоянии ванадий находится в образованиях магматического и осадочного происхождения. Среди них имеются следующие.
Магнетити и титаномагнетитовые руды. Ванадий в них изоморфно замещает железо (радиусы ионов V3+ и Fe3+ соответственно 0,065 и 0,067 нм). Содержание ванадия (в пересчете на V2Os) в титаномагнетитах различных месторождений колеблется от 0,2 до 1,8 %, титана - от 10 до 20 % Ті02.
129
Крупные месторождения титаномагнетитов найдены также в США, Финляндии, КНР, Индии.
Бокситы часто содержат ванадий. Некоторые алюминиевые заводы предусматривают попутное получение ванадиевых концентратов.
Железофосфорисгые руды многих месторождений (Лотарингия, Финляндия, СССР - керченские руды) содержат до 0,1 % V2Os. В рудах этого типа ванадий, по всей вероятности, изоморфно замещает фосфор. Ванадийсодержащие фосфориты (до 0,3 % V2Os и до 34 % Р205) представлены огромными залежами в США (штаты Айдахо, Монтана, Юта, Вайоминг). Предполагается, что ванадий в них присутствует в углеводородах органического вещества, содержание которого в фосфоритах достигает 10-15 %.
Ванадийсодержащие горючие полезные ископаемые. Ванадий концентрируется в асфальтитах (в патроните до 25 % V2Os), битумах, нефти, горючих сланцах. В асфальтитах (США) содержится до 1,17 % V2Os, а в их золе - 25 % V2Os. В золе венесуэльской нефти 5-35 % V2Os, иранской ~5 %. В СССР основной источник ванадия - железные руды.
Обогащение ванадиевых руд. Роскоэлитовые руды плохо обогащаются. Обогащение включает следующие операции: дробление, помол, мокрое обогащение по плотности на столах. Содержание в концентрате при этом повышается до 7-8 %.
Патронит как сульфидную руду обогащают флотацией. Пат - ронит при этом вместе с углистым веществом отделяется от примесей. В результате последующего обжига получается концентрат, содержащий, %: V2Os около 80, Si02 14, Fe203 4, NiO 1,5, М0О3 1,5.
Обогащение ванадинитовых руд включает дробление, помол, выделение концентратов гравитационным способом и их флотацию. Титаномагнетиты легко обогащаются магнитной сепарацией, за исключением случаев, когда зерна ильменита и магнетита мелки и взаимно прорастают. При магнитной сепарации магнетит [FeO • (Fe, V)203] отходит в магнитную, а ильменит FeO • Ті02 - немагнитную фракцию.
2. ПРОИЗВОДСТВО СОЕДИНЕНИЙ ВАНАДИЯ
Проблема промышленного получения ванадия в основном решена использованием рассеянного ванадия, встречающегося в железных рудах. При доменной плавке ванадийсодержащих железных руд или агломератов после магнитного обогащения получается ванадиевый чугун, в который переходит 80-85% ванадия.
Извлечение ванадия из чугуна слагается из следующих стадий:
Получение обогащенного ванадием шлака в процессе передела чугуна в сталь;
Переработка ванадиевого шлака с получением оксида ванадия, ванадата кальция или ванадата железа;
Выплавка феррованадия;
Получение металлического ванадия или его соединений высокой степени чистоты.
Ванадий и другие примеси, находящиеся в чугуне - кремний, марганец, хром, фосфор - в составе оксидов переходят в шлак. Поэтому для получения шлаков с высоким содержанием оксидов ванадия стремятся выплавлять чугуны с низким содержанием кремния и марганца и повышенным содержанием ванадия. Состав ванадиевого шлака зависит от характера руды, из которой выплавлен чугун.
Извлечение ванадия из фосфористого чугуна
Богатые ванадием шлаки (до 4-5 % V) получают при переделе фосфористого чугуна в две стадии. Сначала продувают чугун в конвертере с кислой футеровкой. В первую очередь окисляется ванадий, который переходит в образующийся шлак. Ванадиевый шлак сливают и ведут дальнейший передел чугуна в конвертере с основной (доломитовой) футеровкой, дополнительно вводят в конвертер известь. При этом получают фосфористые (томасовские) шлаки с содержанием до 20 % P2Os, используемые после помола в качестве удобрений.
Извлечение ванадия из титано-магнетитових руд
Диоксид титана в титано-магнетитах затрудняет доменную плавку руды, так как повышает температуру плавления и вязкость шлаков. Для устранения этого в шихту доменной плавки предложено добавлять доломит (способ акад. М.А. Пав - лова) - образуются менее вязкие и менее тугоплавкие шлаки. Для плавки в домне концентрат агломерируют. Ванадиевый чугун переделывают на сталь в бессемеровских конвертерах, получая обогащенные ванадием шлаки.
Извлечение ванадия из передельных шлаков
Ванадий в шлаках содержится в основном в составе соединений типа шпинели FeO - V203 и MnO-V203. Ванадиевые шлаки представляют собой ванадиевые концентраты, относительно легко перерабатываемые на оксид ванадия или ванадат кальция, поскольку при переделе чугуна на сталь ванадиевые шлаки получают попутно. Это обусловливает сравнительно низкую себестоимость ванадия в шлаках. Оксид ванадия, лучаемый из шлаков, может конкурировать с оксидом ванадия, получаемым из богатых ванадиевых руд и концентратов. Ванадиевый шлак содержит, %: V2Os до 18; FeO 19-20; MnO 10-25; Si02 12-30; Ті02 4-6; Cr203 5-15; CaO 20-10.
Ванадиевые шлаки перерабатывают следующими способами:
Окислительным обжигом с хлоридом натрия или сильвинитом;
Окислительным обжигом с карбонатом натрия;
Хлорированием.
При переработке высокоизвестковых шлаков (содержание СаО выше 10 %) обжиг с содой дает более высокое извлечение, чем обжиг с поваренной солью. Хлорированием извлекают из конверторных шлаков наряду с ванадием также титан. При обжиге с хлоридами или содой ванадий образует водорастворимые ванадаты, при переработке хлорированием получается оксохлорид ванадия.
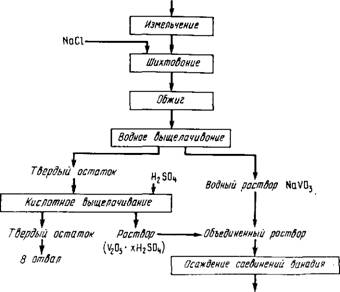
Способ окислительного обжига с хлоридами
Принципиальная технологическая схема переработки шлака приведена на рис. 35.
Обжиг. Установлено, что при температуре выше 800- 850 С в окислительной атмосфере реакция
2NaCl + 1/2 02 = Na20 + Cl2 (3.1)
Значительно ускоряется в присутствии оксидов железа, марганца и особенно ванадия (V). Образующийся Na20 реагирует с V2Os:
Na20 + V2Os = 2NaV03. (3.2)
Окислительная атмосфера в зоне обжига способствует окислению ванадия (III), входящего в состав шпинели. Выделяющийся при обжиге хлор также участвует в процессе вскрытия шпинели
FeO • V203 + 4 1/2 Cl2 = 2VOCl3 + FeCl3 + 02. (3.3)
Оксотрихлорид ванадия, а также хлориды железа, марганца неустойчивы при температуре обжига и переходят в присутствии кислорода в оксид. Если в шихте NaCl столько, сколько необходимо для реакции с V2Os, то примеси кремния, фосфора и хрома переходят в раствор незначительно, так как NaCl в этих условиях избирательно реагирует с соединениями ванадия.
Шлак
V20s-xH20, дано даты кальция или железа
На производства феррованадия, чистых соединений ванадия и др.
Ршс.35. Принципиальная технологическая схема переработки ванадиевого шлака спеканием с хлоридами
Шихта для обжига состоит из измельченного до размера частиц 0,2 мм шпака и хлорида натрия или сильвинита (в виде природного продукта). Более грубое дробление требует большей продолжительности обжига, интенсивного перемешивания, уменьшения толщины слоя шихты. Более мелкий помол способствует образованию легкоплавкого силиката натрия. Появляющаяся жидкая фаза вызывает спекание шихты, ухудшает условия окисления шпака и, в конечном счете, снижает извлечение ванадия. Спекаемость шихты можно уменьшить, если предварительно ее гранулировать. При этом извлечение водорастворимого ванадия повышается от 80-88 % (без грануляции) до 95 %. Добавляют хлорида 8-10 % от массы шпака.
Вскрытие шпака улучшается при добавке в шихту селитры для более полного окисления ванадия. Предварительный окислительный обжиг шпака перед обжигом с хлоридами также увеличивает степень перевода ванадия в водорастворимую форму. Шпинель, в которой сосредоточен весь ванадий, представляет собой твердый раствор замещения следующих основных компонентов: FeV204, FeCr204, FeFe204. При окислении шпинепя распадается твердый раствор, образуя новые минеральные виды этих элементов. Неполнота извлечения ванадия из шпака объясняется частичным сохранением неокис - ленных зерен шпинели в обожженном шпаке, а также присутствием ванадия в качестве изоморфной примеси в составе нерастворимых в воде и слабой серной кислоте соединений железа, хрома, титана. Температура обжига не должна превышать 900 °С. При более высокой температуре шихта плавится, превращаясь в аморфную стекловидную массу, из которой извлекать ванадий очень трудно. Стеклование происходит тем легче, чем больше кремнекислоты содержит шлак. При температуре ниже 800 °С выход ванадия падает.
Чтобы шихта хорошо перемешивалась и был контакт с окислительной атмосферой, ее спекают в трубчатых вращающихся печах. Длина печи 20-50 м, наклон печи и число оборотов подбирают так, чтобы шихта находилась в зоне реакций 4-5 ч. Печь футеруют шамотным кирпичом. Обогревают ее за счет сжигания генераторного газа или мазута. Весьма эффективно спекание в печи с "кипящим слоем" ввиду лучшего контакта твердой и газообразной фаз. После обжига шихта поступает в трубчатый холодильник, а затем на выщелачивание. Отходящие газы содержат хлор, поэтому их направляют на нейтрализацию.
Выщелачивание. Обожженный материал выщелачивают водой или последовательно водой и разбавленной серной кислотой (6-8 %). Кислотное выщелачивание позволяет извлечь из спека ванадий (IY), не окислившийся в процессе спекания с хлоридами. Водные растворы содержат NaV03, примеси фосфора (Na2HP04), кремния (Na2Si03) и хрома (Na2Cr04). При кислотном выщелачивании в растворе образуются сопи ванадила V0S04. В случае спекания шпаков с содой переход примесей в раствор выше, чем в случае спекания с хлористыми солями.
Выщелачивают спек преимущественно в пневматических вы- щелачивателях - пачуках. Для непрерывного выщелачивания применяют батарею из нескольких пачуков, связанных друг с другом с верхней части сливными лотками или патрубками. В первый аппарат - смеситель поступают шпак и вода в соотношении 1:2. По мере заполнения его избыток пульпы стекает в следующий аппарат. Из последнего выщелачивателя пульпа самотеком поступает на вакуум-фильтры. Здесь отделяют твердые остатки шихты - хвосты, промывают их и направляют на дальнейшую переработку. Хвосты содержат не более 0,05 % V. Выщелачиватели бывают деревянные, стальные с футеровкой из керамических плиток, железобетонные. Всего в раствор извлекается 90-92 % ванадия.
Осаждение ванадия из растворов. Для выделения ванадия из растворов предложены методы осаждения его в составе гидратированного оксида или солей. Выбор метода зависит от природы сырья, способа его переработки, концентрации растворов и других причин. Растворы после выщелачивания в зависимости от состава шлаков содержат 5-35 г/л V2Os. Наибольшее распространение получило выделение ванадия в составе: а) гидратированного оксида ванадия V2Os • лН20; б) ванадата кальция; в) ванадата железа; г) ванадата аммония. Из растворов, содержащих более 20 г/л V2Os, целесообразно выделить гидратированный V2Os как соединение с большим содержанием V2Os. Из более бедных растворов выгоднее осаждать ванадаты - значительно менее растворимые соединения, чем V2Os. Гидролиз концентрированных растворов V2Os выражается условной реакцией:
V2Os• 2H2S04+nH20 V205-nH20 +2H2S04. (3.4)
Оптимальные условия кислотности для выделения ванадия из растворов - 0,05-0,14 н. В процессе гидролиза непрерывно изменяется кислотность, поэтому необходимо постоянно регулировать рН раствора добавлением щелочи. После добавления щелочи раствор нагревают и выдерживают 2—4 ч при 95 "С. Если ванадий в процессе обжига не полностью окислился, то в кислых растворах он может находиться в составе V0S04. Для окисления соли ванадила до соединений ванадия (V) в раствор перед нейтрализацией добавляют окислители, например хлорат калия. При осаждении ванадия из щелочных растворов в них добавляют серную кислоту до нейтральной или слабокислой реакции. Учитывают, что в процессе кипячения раствора и выпадения гидратированного оксида ванадия кислотность значительно повышается.
При соблюдении оптимальных условий из растворов, содержащих более 20 г/л V205, может быть осаждено до 98 % V205. Осаждение ведут в реакторах, футерованных керамической плиткой. После отстаивания осадка V205-nH20 маточный раствор декантируют, осадок репульпируют и подают на плоский вакуум-фильтр. Во избежание коллоидообразования промывают осадок на фильтрах водой, 1 %=ным NH4Cl. Сушат V205 при 450-500 °С. Высушенный V205 переплавляют в ванной плавильной печи при 700-800°С. При плавлении удаляются некоторые примеси, например S03.
Расплавленный продукт выпускают из печи на охлаждаемый водой вращающийся стол-гранулятор. V205 застывает тонким слоем и в форме пластинок сбрасывается в вагонетку. Плавленый оксид ванадия (V) обычно имеет темно-бурый цвет из - за образующихся в процессе плавки низших оксидов. Продукт имеет следующий примерный состав, %: V205 88,1; Si02 1,2, Al203 1,3; Fe203 5,5; CaO 1,4; MgO 0,5; MnO 1,4; Cr203 0,3. Общее извлечение из шлаков ~80 %, при повторной переработке хвостов от выщелачивания - 85-90 %. Однако общее извлечение из руды из-за низкой концентрации ванадия составляет 20 %. Так, при доменной плавке керченских руд с 0,08 % V2Os теряется 13 %, при переработке чугуна 60 %, при хлорирующем обжиге 40 % от поступившего на операцию количества. В растворы при выщелачивании переходит не свыше 22 % содеращегося в руде ванадия. Однако попутное извлечение ванадия при крупнотоннажных производствах, каким является получение стали из чугуна, обусловливает сравнительно низкую себестоимость ванадия и делает его извлечение экономически выгодным.
Способ окислительного обжига с карбонатом натрия
В окислительной атмосфере вскрытие ванадиевой шпинели содой, как и спекание с хлоридом натрия, ведет к получению ванадата натрия и описывается суммарной реакцией:
4FeO • V203+4Na2C03+502 = 8NaV03+4C02+2Fe203.
При обжиге ванадиевого шлака с содой в барабанных вращающихся печах оптимальная температура составляет 730— 745 °С, отношение в шихте Na2C03:V205 = 0,64-5-0,68 (по массе), что близко к стехиометрическому в расчете на образование ванадата натрия. Более высокая температура вызывает спекание шихты. Если шихту предварительно гранулировать, то температуру обжига можно повысить, при этом увеличится степень вскрытия и уменьшится спекание.
Более высокое содержание в шихте соды позволяет несколько повысить извлечение ванадия в раствор при водном выщелачивании, ухудщает фильтрацию. Указанное содержание соды в шихте близко к стехиометрическому по отношению к необходимому для образования ванадата натрия из V2Os; рН раствора при выщелачивании 7—8. Выщелачивание проводят водой при соотношении Т:Ж=1:4 и 60 °С, затем — дважды 3 %-ной H2S04 при Т:Ж=1:3 и комнатной температуре. В раствор переходит до 95 % ванадия. Оксид ванадия (V), осажденный из полученных растворов, содержит 86—89 V205.
Варианты содовой технологии извлечения ванадия из шлаков, кроме обжига с содой, включают также операции выщелачивания (водного и кислотного), выделения ванадия из растворов.
Преимущество способа обжига с содой по сравнению с хлорирующим обжигом состоит в том, что не образуются хлорсодержащие газы, и это избавляет от необходимости организации громоздкой системы нейтрализации отходящих газов.
Недостаток технологии в том, что применение соды, как химически более активного реагента по сравнению с хлоридом натрия, приводит к получению растворов ванадата натрия, более загрязненных примесью сопутствующих элементов.
Осаждение ванадата кальция. Из бедных ванадием растворов наибольшая полнота выделения ванадия достигается при осаждении его в составе ванадата кальция. Так, при переработке керченских шпаков растворы содержали всего 2,5-5 г/л V2Os.
Осаждение ведут известковым молоком, раствором СаС12, сухой известью или известковой пастой при нагревании раствора до 90 °С и перемешивании. Полнота осаждения ванадия 99,6-99,7%. Состав осадков близок к 2СаО • V2Os+Ca(OH)2. Осадок загрязнен примесями Ca3(P04)2, CaSi03, CaS04. Высушенный ванадат кальция содержит, %: V2Os 28-32; СаО 44-50; MgO 1,5-3,5; S03 3-5; Si02 1,3-2,5. При значительном содержании фосфора растворы очищают, выделяя Mg(NH4)P04 при добавлении в раствор MgCl2 и NH3. При содержании в растворе 0,06-0, г/п P2Os (керченские руды) осаждается 98-99% форсфора.
Ванадат кальция можно переработать на V2Os или использовать для получения феррованадия.
Осаждение ванадатов железа. Феррованадаты, пригодные для выплавки феррованадия, получают лишь тогда, когда выделяют ванадий из растворов, содержащих более 20 г/л V205. При осаждении из растворов с более низким содержанием V2Os получают осадки, являющиеся промежуточными продуктами и требующие дальнейшей их переработки. В этом случае осаждают ванадаты железа с целью концентрирования ванадия. Для осаждения используют дешевый железный купорос FeS04-7H20. Из растворов осаждается 99-100% ванадия.
Осаждение ванадата аммония. Ванадат аммония осаждают хлоридом аммония из щелочных растворов. Растворимость NH4V03 уменьшается с увеличением избытка NH4C1 в растворе. При концентрации в растворе 85- 100 г/л NH4Cl осаждение ванадия практически полное. При температуре осаждения 50-60 °С, концентрации V2Os 45-60 г/л и пеермешивании получается крупнокристаллический (~ 0,4 мм) легко фильтрующийся NH4V03. Его прокаливают, получая чистый V2Os, необходимый для производства катализа - 138 торов, чистого металла и сплавов. При большом избытке NH4Cl в маточных растворах его регенирируют: растворы упаривают, хлорид аммония выкристаллизовывают осаждением растворов, отделяют и используют повторно.
Способ хлорирования
Хлорировать ванадиевые шлаки газообразным хлором можно в расплаве хлоридов щелочных металлов. Метод широко применяют в производстве магния и титана и во многих случаях он предпочтительнее хлорирования брикетированной шихты. При хлорировании в солевом расплаве осуществляется хороший контакт между хлором и хлорируемым объектом за счет энергичной циркуляции твердых частиц в газо-жидкостной системе хлор-расплав. Механизм хлорирования в солевом расплаве недостаточно изучен. Решающими факторами, которые определяют степень хлорирования компонентов, являются кинетика протекающих процессов на границе раздела фаз и скорость удаления образующихся хлоридов из расплава. Процесс напоминает кипящий слой, причем пылеунос незначителен, так как частицы материала смочены расплавом. Хлорирование в солевом расплаве сравнительно легко осуществимо, высокопроизводительно. Применительно к ванадиевым шлакам этот процесс имеет то преимущество, что образующиеся хлориды железа и алюминия связываются хлоридами щелочных металлов в малолетучие соединения типа MeFeCl4 и МеА 1С14, давление пара которых во много раз меньше давления пара индивидуальных хлоридов (рис.36).
Хлоратор представляет собой шахтную электропечь прямоугольного сечения, подача хлора - через боковые или центральную (сверху) фурмы. Шлак измельчают и в смеси с 15 % кокса загружают в хлоратор с помощью шнекового питателя. Расплавленной средой служит отработанный электролит магниевых электролизеров состава,%: КС1 73,2; NaCl 19,5; MgCl2 4,5; СаС12 1,4. Отработанный расплав периодически сливают по мере накопления в нем железа и нехпорируемого остатка. Образующиеся пары VOCl3, TiCl4, SiCl4 вместе с другими газами очищают в рукавном фильтре от твердых хлоридов железа, алюминия и шихты, механически унесенной из хлоратора в виде пыли. Рукава выполнены из стеклянной ткани. Очищенную паро-газовую смесь (110-120 °С) направ-

Ршс.36. Принципиальна! технологическая схема переработки ванадиевого шлака методом хлорирования
Ляют в холодильник для конденсации хлоридов ванадия, титана и кремния. В качестве хладагента применяют рассол СаС12.
Хлорирование идет за счет тепла экзотермических реакций. Средний состав конденсата, %: VOCl3 45; TiCl4 21, SiCl4 32, AlClj 0j8, CC14 0,45, примеси СОС12,С6С16, HCl.
Таким же способом можно перерабатывать технический оксид ванадия (V).
Недостатки метода: необходимость разделения смеси VOCl3-TiCl4-SiCl4 (температура кипения 127, 136 и 57 °С соотвеуственно); высокий расход хлора на хлорирование примесей (главным образом железа).
Очистка оксотрихпорида ванадия. Смесь VOCl3, TiCl4, SiCl4, полученную в результате переработки конвертерных шпаков, разделяют ректификацией. Вначале проводят первую, очистную ректификацию, чтобы получить смесь VOCl3 и ТіС14, достаточно очищенную от примесей. Фракцию, содержащую в основном SiCl4, направляют на дальнейшую очистку.
Колонну предварительной ректификации выполняют с тарелками провального типа, устойчивыми против инкрустации твердыми хлоридами. При производительности 2,5 т/сут смеси хлоридов колонна имеет диаметр 200-220 мм, высоту 6,5 м и 20 реальных тарелок.
Система VOC1 - TiCl4 близка к идеальной. Относительная летучесть ссуосі /ТіСІ ~ 1>25, поэтому смесь целесообразно
3 4
Разделять в две стадии, так как для. проведения процесса в одной колонне требуется много теоретических ступеней равновесного контакта. После предварительной ректификации получается 2 т смеси: ~60 % VOCl3, ~40 % TiCl4, 0,05 % легколетучих, ~0,01 % труднолетучих примесей. Разделяют такую смесь двумя последовательными ректификациями в колоннах диаметром 220-240 мм, высотой 10 м с 65 реальными тарелками. Если требуется получить продукт, содержащий более 99,9 % VOCl3, то необходима дополнительная ректификация.
Применяют различные схемы гидрометаллургической переработки карнотитовых руд для комплексного извлечения содержащихся в них ванадия и урана. Во всех случаях измельченную руду прежде всего обжигают, добавляя NaCl (6-10 % от массы руды). Температура обжига 850 °С. При более высокой температуре соединения ванадия реагируют с Si02, образуя нерастворимые силикаты, и извлечение ванадия резко падает. По одному из вариантов обожженную руду выщелачивают водой для извлечения ванадия (уран при этом в раствор не переходит), пульпу фильтруют, из раствора выдепя - ют ванадий. Нерастворимый остаток (кек) поступает на дальнейшую переработку для извлечения урана. Другие варианты заключаются в совместном выщелачивании ванадия и урана из обожженной руды растворами минеральных кислот (H2S04, НС1) или растворами соды; ванадий и уран образуют при этом соответствующие соли ванадила и уранила.
Кислотное выщелачивание обеспечивает наибольшее извлечение ванадия, но оно применимо лишь при небольшом содержании в руде карбонатов. Аппараты для сернокислого выщелачивания изготавливают из танталовой стали, кремнистого чугуна и снабжают крышками для отвода агрессивных паров кислоты. Из-за большого отношения твердого к жидкому (Т:Ж) вязкость пульпы обычно высока, поэтому материал аппаратуры, трубопроводов и насосов должен иметь повышенную износостойкость. Иногда вскрытие серной кислотой проводят в наклонных обогревамых трубчатых печах. Руду и кислоту подают в верхнюю часть печи, продукты реакции удаляют через нижнюю часть.
Для выщелачивания растворами соды требуется руда более мелкого помола, так как сода не воздействует заметно на сопутствующие минералы, которые могут экранировать частицы ванадиевой руды. Выщелачивание ведут и в периодическом, и в непрерывном (прямоточном или противоточном) режиме в аппаратах с механическим или пневматическим перемешиванием - при обычных температурах и при подогреве пульпы.
Выщелачивание раствором соды имеет следующие преимущества перед кислотным: 1) растворы менее агрессивны, поэтому оборудование может быть изготовлено из более дешевых материалов; 2) способ особенно пригоден для переработки руд с высоким содеражнием известняка; 3) растворы Na2C03 легко регенерируются путем барботажа через них С02 или дымовых газов в обычной абсорбционной башне. Недостатки метода: 1) скорость выщелачивания часто ниже, чем в кислотном процессе; 2) сульфидные минералы взаимодействуют с Na2C03 в присутствии окислителя, вызывая повышенный расход соды.
Вскрытие карнотита карбонатом натрия происходит по реакции:
К20 • 2U03 • V205+6Na2C03+2H20 =
= 2NaV03+2Na4[U02(C03)3]+2Na0H+2K0H. (3.5)
После реакции с минералом маточник становится более щелочным. Поэтому выгодно к соде добавлять гидрокарбонат натрия, который в процессе выщелачивания переходит в карбонат
NaHC03+Na0H = Na2C03+H20. (3.6)
При совместном выщелачивании ванадия и урана усложняется их раздельное выделение из раствора. Описаны разные способы получения ванадиевых и урановых продуктов из содовых кислых растворов. Некоторые из них основаны на раздельном осаждении этих элементов из раствора, другие - на совместном осаждении с последующим разделением коллективного химического концентрата. В последнее время наибольшее значение приобретают методы, основанные на сорбции ванадия ионитами и экстракции его органическими реагентами. В качестве экстрагентов соединений ванадия предложены алифатические амины, вторичные жирные спирты, трибутил - фосфат и другие органические производные фосфорной кислоты.
Извлечение ванадия из других видов сырья
Извлечение из патронитовых руд. По одним схемам патрони - товые руды подвергают окислительному обжигу, огарок ввиду большого содержания в нем ванадия алюминотермически восстанавливают в электропечах и получают феррованадий. По другим схемам концентрат обжигают и перерабатывают способами, описанными выше, т. е. путем выщелачивания обожженного материала растворами щелочей или кислот с последующим осаждением концентрата V2Os из растворов.
Извлечение из роскоэлитовых руд. Богатые роскоэлитовые руды перерабатывают путем выщелачивания ванадия растворами щелочей или кислот. Из растворов осаждают концентрат ванадия.
Бедные руды (месторождения Казахстана) перерабатывают совместно с фосфоритами при производстве элементарного фосфора электротермическим способом. Ванадиевую руду, содержащую 75-80 % Si02, используют вместо кварцитов в качестве флюсующей добавки:
2
Ca3(P04)2+5C0+3Si02 = 3CaSi03+5C02+P: С02+С = 2 СО.
В процессе плавки, кроме возгона элементарного фосфора, получается шлак и ванадийсодержащий феррофосфор. Его фазовый состав - Fe2P, (Fe, V)2P, y-Fe; содержит до 4 % ванадия.
Ванадиевый феррофосфор перерабатывают путем окислительного обжига с NaCl или смесью NaCl и Na2C03 при 800 °С. Ванадий при этом образует водорастворимый ванадат натрия. Из раствора ванадий выделяют описанными выше способами.
Другой способ переработки ванадиевого феррофосфора - получение ванадиевого шлака путем пропускания через расплав в конветере воздуха. Шлак в этом случае содержит до 20 % V205, его перерабатывают по какому-либо известному способу.
При переработке віт ванадиевого феррофорсфора получают 70 кг V2Os, около 3 т Na3P04; извлечение ванадия из сплава 85-90%, фосфора 90%.
Извлечение из бокситов. При переработке бокситов методом Байера около 65 % ванадия переходит в шлам, остальная часть (соединения ванадия V) - в алюминатный раствор. При наличии в алюминатном растворе 100-300 г/л Na20 растворимость солей ванадия можно значительно снизить, добавив NaF в соотношении V2Os: NaF = 1:2. Ванадий переходит в осадок в составе соли 2Na3V04 • NaF • 19Н20.
Извлечение ванадия из технического тетрахлорида титана
Содержание ванадия в составе VOCl3 в техническом тет - рахлориде титана 0,07-0,08%. Очищенный ТіС14 должен содержать менее 0,001 % V. VOCl3 содержит кислород, который в процессе магниетермического восстановления ТіС14 попадает в титановую губку, и это увеличивает твердость металла.
Для химической очистки ТіС14 от VOCl3 используют низшие хлориды титана, медный порошок, сероводород, минеральные масла. Сущность процесса очистки заключается в избирательном взаимодействии добавляемых веществ с VOCl3,
Кубовый остаток Л ректификации
Переработка в расппаве
Технический ТІСЦ Расплав, обогащенный V
На производства очищенного Т і С14
Хлори'роЬание
Отработанный VOGlj+ТіСЦ
Расплав t
І Ректификация
8 отвал ] 1 I
! Концентрированный ТІСІ4
♦ VOCI3 t
Vucmt/uVOC I3 f На производство
(товарный продукт) Гидролиз очищенного TiCU
Ванадийсодертащий раствор: бОг/л V; КО-200г/л Н С1
№гС0д
Нейтрализация до. рН::21-3 Ванадийсодержащая пупьпа
Острый пар
Гидролиз при рки 25- 45 °С
I
Ванадийсодержащая пульпа Фильтрация
1 Г-1
NaOH
Клар
„Черновой"гидроксис? ванадия Фильтрат
В канапизацию
Острый пар
Растворение, фильтроция
TOC \o "1-3" \h \z I 1
№ NaV03
J, І NH4CI
В отвап I f 1
(после промывки) Осаждение т^ді. фильтрация
I I
Фильтрат NH4VO3
На регенерацию NH^Cl Сушка и прокалка при 500-550С
V2O5 трт х. ч.,ч. д.а - и v.
Хлор
Ршс.37. Принципиальная технологическая схема извлечения ванадия из технического тетрахлорида титана
При этом образуются малорастворимые в ТіС14 высококипяшие соединения ванадия низших степеней окисления, легко удаляемые при очистке тетрахлорида титана, например:
VOCl3+3TiCl3 = VOCl2|+TiCl4; (3.9)
VOCl3+Cu = VOCl2i +CuCl. (3.10)
В отечественной практике наибольшее распространение получил способ очистки низшими хлоридами титана, которые получают, восстанавливая ТіС14 алюминиевой пудрой. Расход А1-пудры 0,8-1,2 кг на 1т ТіС14. Продолжительность контакта низших хлоридов титана с техническим тетрахлоридом титана 1-2 ч. Низшие хлориды титана как восстановители имеют преимущества по сравнению с медным порошком: реагент более дешев (расходуется Al-пудра), повышается степень очистки ТіСІ4 от ванадия. Недостатки способа - взры - воопасность Al-пудры (нижний предел взрывоопасности 40ч/м3), периодичность процесса получения низших хлоридов титана.
Очистку от ванадия с помощью Al-пудры совмещают с процессом ректификации технического ТіСІ4 от твердых веществ. Таким образом, ванадий концентрируется в кубовых остатках II ректификации ТіС14.
Технологическая схема получения V2Os из кубовых остатков представлена на рис.37. По этой схеме кубовой остаток (TiCl4, VOCl2, А1С13, другие твердые хлориды) нагревают в солевом хлораторе, где на первом этапе отгоняют основную часть ТіС14. Затем в хлоратор подают хлор, при этом хлорируется VOCl2:
2VOCl2+Cl2 = 2VOCl3;
Большая часть твердых хлоридов остается в солевом расплаве. Смесь VOCl3 и ТіС14 разделяют ректификацией. ТіС14 возвращают на производство титана; VOCl3 может быть товарным продуктом или переработан на V2Os. В последнем случае ректификацию ведут до получения не чистого, а концентрированного по VOCl3 продукта, который затем растворяют в растворе НС1, получая раствор с бОг/л ванадия и 140-200 г/л НС1. При этом возможны реакции:
V0C13+H20 = V02C1+2HC1; (З. іі)
ТіСІ.+гцо = Ті(ОН)2С12+2НСІ. (3.12)
Раствор нейтрализуеют содой до рН=2*3 и при подогреве острым паром гидролизуют. Пульпу фильтруют. "Черновой гидроксид ванадия" (содержит титан) растворяют в растворе гидроксида натрия при подогревании.
На этой стадии происходит растворение соединений ванадия с образованием NaV03 и очистка от титана; гидроксид титана и титанат натрия - малорастворимы. Из раствора NaV03 с помощью NH4C1 выделяют NH4V03, который сушат и прокаливают при 500-550 °С, получая V205. Извлечение ванадия из кубовых остатков в товарную V2Os 85%.
По этой технологии возможно получение реактивного оксида ванадия (V) марки "хч", содержащего (ТУ 6-09-4093- 75) - не менее 98% V2Os.
Хлорирование феррованадия
Пластичный металлический ванадий можно получить, восстанавливая низшие хлориды ванадия магнием, другими металлами, водородом, а также электрохимическим путем с применением в качестве электролита расплавленной смеси низших хлоридов ванадия и хлоридов щелочных металлов с последующей переплавкой полученного металла в электроннолучевой печи. Источник получения низших хлоридов ванадия - тетрахлорид VC14, получаемый хлорированием феррованадия. Феррованадий в данном случае можно рассматривать как концентрат ванадия.
Процесс получения металлического ванадия слагается из следующих операций: 1) тетрахлорид ванадия превращают в трихлорид перегонкой с обратным холодильником по реакции
2VC14 = 2VC13+C12 (3.15)
В токе газа-посителя, инертного по отношению к хлоридам ванадия; разложение ускоряется в присутствии катализаторов; 2) удаляют VOCl3 из VCl3 дистилляцией; 3) восстанавливают VC13 до металла, контролируя добавку его в расплавленный магний в атмосфере аргона; 4) удаляют магний и MgCL2, вакуумной сепарацией; 5) выщелачивают оставшийся MgCl2, затем промывают и сушат порошок ванадия.
Общее извлечение ванадия невысоко из-за потерь в составе VOCl3 за счет адсорбции хлоридом железа (III). Потери ванадия можно снизить, если хлорировать VOCl3 до
VCL4 в присутствии угля при 700 °С. Другой метод уменьшения потерь ванадия за счет адсорбции хлоридом железа (III) состоит в пропускании газообразных продуктов хлорирования через обогреваемую до 250 °С насадку из кусков хлорида натрия. Хлоропроизводные ванадия не реагируют с насадкой, а хлорид железа образует с хлоридом натрия малолетучий легкоплавкий NaFeCl4. Появляющаяся на солевой насадке жидкая фаза способствует очистке и от других примесей в парогазовой смеси. Конденсат хлоропроизводных ванадия содержит железа не более 0,003 % (считая на оксид).