ТЕХНОЛОГИЯ ПРОИЗВОДСТВА ТОРИЯ
Получение чистых соединений тория
Основным ториевым сырьем служат монацитовые концентраты (см. табл. гл. И). В процессе переработки получают ториевые концентраты в виде осадков гидроксидов, основных солей, фосфатов или оксалатов. Они содержат от 40 до 70 % Th02. В качестве примера ниже приведен состав ториевых концентратов в виде гидроксидов, выделяемых при щелочном способе переработки монацита, %: Th02 50 - 65; P2Os 1 - 2,5; РЗЭ203 2 - 15; Fe203 2-5; U03 1,5 - 2,5; Ті02 0,2- 1.
Из материала подобного состава получают соединения тория высокой чистоты. Большей частью продуктами очистки являются диоксид тория или нитрат тория, из которых затем могут быть получены другие соединения, необходимые для производства металла (напримет, фторид или хлорид тория).
Для отделения тория от редкоземельных элементов и других составляющих ториевого концентрата применяют три группы методов:
Методы избирательного осаждения. К ним относятся: избирательное осаждение гидроксида тория, сульфата, оксалата или фторида тория;
Медоты избирательного растворения, основанные на образовании торием растворимых комплексов с оксалатами и карбонатами щелочных металлов и аммония;
Экстракционные методы очистки, являющиеся в настоящее время основными.
Экстракционный метод очистки
Наиболее распространен процесс экстракции из азотнокислых растворов трибутилфосфатом, который образует с нитратом тория сольват Th(N03)4 ■ 2ТБФ.
Из данных табл. 12 видно, что коэффициенты распределения РЗЭ, титана, фосфора и железа значительно ниже, чем тория. Только уран отличается более высокой экстрагируе - мостью.
ТаблицаИ. Зависимость коэффициентов распределения тория и других элементов от концентрации азотной кислоты
|
| HN03, |
Коэффициенты расп |
Ределения элементов |
||||
|
Моль/л |
И |
Th |
РЗЭ |
Ті |
Р |
Fe |
|
0,5 |
13 |
0,32 |
0,069 |
<0,002 |
<0,003 |
0,011 |
|
1,0 |
23 |
0,68 |
0,072 |
<0,002 |
0,011 |
0,021 |
|
3,0 |
47 |
1,5 |
0,065 |
<0,003 |
0,007 |
0,018 |
|
5,0 |
55 |
2,5 |
0,046 |
<0,003 |
0,007 |
0,024 |
|
7,0 |
- |
3,7 |
0,028 |
0,005 |
0,007 |
0,26 |
|
9,0 |
27 |
4,5 |
0,032 |
<0,002 |
<0,003 |
0,12 1 |
|
* Органическая фаза: 50 %-ный ТБФ в керосине.. Водная фаза содержит, г/л: I Th02 37,12; V3O8 0,56; LnlOz 11,44; Р2О5 5,28; Fe20 3 2,48. | |
Из исходного азотнокислого раствора с концентрацией HN03 4 моль/ л первоначально совместно экстрагируют торий и уран 50 %-ным раствором ТБФ в керосине. Затем, на стадии реэкстракции, разделяют торий и уран. Торий реэкстрагируют разбавленным раствором азотной кислоты (0,1 - 0,2 моль/л), а затем уран - водой.
Из азотнокислого реэкстракта торий может быть осажден в составе оксалата, который прокаливанием превращается в Th02.
Для получения более чистого продукта оксалат тория разлагают раствором щелочи, гидроксид растворяют в азотной кислоте и из нитратного раствора путем выпаривания под вакуумом кристаллизуют нитрат тория [кристаллизуется смесь Th(N03)4 • 4Н20 и Th(N03)4 ■ 6Н20].
Производство тория
В промышленной практике торий получают металлотерми - ческим восстановлением его соединений (диоксида, галогенидов тория) или электролизом расплавленных сред.
Для получения тория особо высокой чистоты (преимущественно для исследовательских целей) используют метод термической диссоциации иодида тория.
Ввиду высокой температуры плавления торий получают в форме порошка или губки, которые затем превращают в компактный металл плавкой или методом порошковой металлургии. Ниже рассмотрены металлотермические методы, являющиеся основными промышленными методами получения тория.
Восстановление диоксида тория кальцием
Этот метод наиболее распространен в промышленной практике. Диоксид тория высокой чистоты большей частью получают термическим разложением оксалата тория при 600 - 650 С. В качестве восстановителя химически прочного диоксида тория может быть использован из доступных только кальций:
(13.17)
-24,7 кДж.
Th02 + 2Са = Th + 2СаО; ізоок = —60 кДж; АС71300К = —
А вакууму
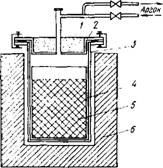
Теплоты реакции недостаточно для внепечного процесса. Восстановление проводят в атмосфере чистого аргона в ап-
Ржс.97. Схема аппарата для восстановления диоксида тория кальцием:
1 — теплоизолирующая засыпка; 2 - крышка с патрубками для присоединения к вакуумной системе и источнику аргона; 3 — корпус аппарата из нержавеющей стали; 4 - тигель из стали или ннконеля с молибденовым покрытием или футеровкой из оксида кальция; 5 — шихта; 6 — печь
царате, схематически показанном на рис. 97. Шихту (смесь Tjh02 с кальциевой стружкой) загружают в стальной тигель, выложенный листовым молибденом или футерованный оксидом кальция. После откачки и заполнения аргоном аппарат нагревают до 1000 - 1100 С и выдерживают при этой температуре некоторое время. После охлаждения реакционную массу выщелачивают водой и разбавленной соляной кислотой для удаления избытка кальция и СаО. Для отделения тонких фракций порошок тория промывают на концентрационном столе. Для удаления оксидных пленок Th02 с поверхности частиц порошок промывают 15 %-ной азотной кислотой, затем водой и сушат в вакуумных шкафах.
С целью увеличения размера частиц порошка рекомендуется вводить в шихту хлорйстый кальций (~40 % от массы Th02). Хлористый кальций плавится при температуре восстановления и растворяет часть образующегося оксида кальция. Это снижает тормозящее влияние СаО на рост частиц тория. Для лучшего использования объема тигля целесообразно предварительное брикетирование шихты (Th02 + Ca + СаС12). Для полного восстановления в этом случае достаточно 25 %-ного избытка кальция в шихте против стехиометричес - кого по реакции (13.17). Извлечение тория в порошок составляет ~90%. Порошок содержит 99,6 - 99,8% Th.
Восстановление тетрафторида тория кальцием
Из металлотермических методов восстановления галогени - дов тория в промышленной практике используют восстановление ThF4 кальцием. Как исходный материал для получения тория фторид имеет преимущества перед хлоридом, который весьма гигроскопичен, что усложняет работу с ним в промышленных масштабах.
Однако использование фторида тория возможно лишь в том случае, если в результате восстановления торий будет получен в виде слитка, хорошо отделяющегося от шлака - CaF2. Если торий получается в виде мелких зерен, распределенных в шлаке, отделение металла от шлака затруднительно вследствие малой растворимости CaF2 в воде и кислотах.
Поскольку торий имеет высокую точку плавлених (1750 °С), в шихту добавляют хлористый цинк с целью получения сравнительно легкоплавкого сплава тория с цинком. Хлористый цинк, кроме того, служит подогревающей добавкой, увеличивающей термичность процесса. Таким образом, при получении тория протекают две реакции
ThF4 + 2Са = Th + 2CaF2, (13.18І)
ЛЯ°500К = -504 кДж; AG°500K = -372 кДж; 1
ZnCl2 + Са = Zn + СаС12, (13.19)
ДЯ°500К = -388 кДж; AG°500K = - 327 кДж.
Исходный фторид тория получают взаимодействием Th02 с фтористым водородом при 550 - 600 С:
Th02 + 4HF = ThF4 + 2Н20 + 178,5 кДж. (13.20)
Процесс проводят в трубчатых реакторах (из сплава ин - конель), в которых расположены шнеки, транспортирующие диоксид тория вдоль труб противоточно потоку фтористого водорода.
Шихта для восстановления состоит из ThF4, ZnCl2 и стружки дистиллированного кальция. Хлорид цинка вводят в таком количестве, чтобы получить сплав тория с 6 - 7 % Zn, который плавится при 1200 С. Поскольку при максимальной температуре восстановления давление паров цинка высокое, процесс ведут в герметичных стальных аппаратах, которые изготовляют из цельнотянутых стальных труб диаметром 150 - 200 мм и длиной 900 - 1100 мм. К трубе приваривают дно и массивный фланец для герметичного присоединения крышки. Реактор футеруют оксидом магния. Реакция начинается при нагревании аппарата до 650 °С. В процессе взаимодействия температура повышается до 1250 - 1300 С и сплав тория с цинком собирается на дне реактора.
Цинк из слитка удаляют отгонкой при 1100 С в стальной реторте при разрежении 0,27 Па. Торий остается в виде губки, которую переплавляют.
Іолучение компактного тория
Для получения компактного тория из порошка или губки применяют плавку или метод порошковой металлургии, і Плавка тория. Торий плавят в дуговых печах с расходуемым электродом или в вакуумных индукционных печах. В последнем случае торий плавят в тигле из оксида бериллия, который устойчив против действия расплавленного тория при 1800 °С и отличается высокой термостойкостью. Тигель из оксида бериллия вставляют в графитовый тигель, нагреваемый индуктором. Плавку ведут под разрежением 0,113 Па или ниже.
Порошковая металлургия тория. Порошки тория обладают высокой пластичностью и допускают высокие давления прессования: кальциетермические 0,8 — 1,2 ГПа, электролитические 0,6 - 0,8 ГПа.
Спрессованные заготовки спекают в вакууме 0,113 - 0,665 Па при температурах 1100 - 1400 °С в течение 30 - 60 мин. Спеченные заготовки имеют плотность 11,5 - 11,6 г/см3 (~98,3 % от теоретической плотности). Они имеют твердость по Бринеллю 520 - 700 МПа, временное сопротивление 170 - 220 МПа.
В зависимости от диаметра проволої
Механические свойства вольфрама и молибдена в большей мере зависят от чистоты металлов, предшествующей механической и термической их обработке. Ковку, волочение и прокатку металлов ведут при нагревании, причем молибден несколько легче поддается механической обработке давлением, чем вольфрам.
Металлы отличаются высокой температурой плавления, низким давлением паров даже при температурах 2000 С и малым температурным коэффициентом линейного расширения. Относительно малое сечение захвата тепловых нейтронов (в семь раз меньше, чем у вольфрама) делает возможным его применение в качестве —у»... і г - "* " ядерных реакторах.
SXISSSSI 17
1 в»шш вшм ГШ ге*к>
»«»«Н-фіМ '
[1] Способ предложен в 1932 г. проф. В. С.Сырокомским и детально разработан проф. И. Н.Масляницким и сотрудниками института "Механобр".
[2]ВА - вольфрам с кремнещелочной и А1203 -присадками для изготовления непровисающей проволоки; ВЧ - чистый вольфрам (без присадок).
[3] В структуре метасолей отсутствуют анионные группировки Э03, поэтому они не являются истинными солями и должны быть отнесены к классу смешанных оксидов, однако обычно сохраняют традиционное название.
[4] Условно реакции написаны со свободными оксидами. В действительности они являются составляющими минерала лопарита.
[6] Подвижность носителей заряда fl характеризует скорость дрейфа (перемещения) электронов или дырок в электрическом поле напряженностью 1 В.
Чистый компактный германий устойчив на воздухе при обычной температуре и быстро окисляется при 600-700 °С с образованием диоксида германия. С азотом германий не взаимодействует, аммиак при 700-800 С реагирует с образованием нитрида германия Ge3N2. Твердый германий практически не реагирует с водородом вплоть до температуры плавления, расплавленный - поглощает водород. В незначительной мере при 1000-1100 С образуются летучие гидриды германия (германоводороды).
Хлор актинно реагирует с порошком германия при обычной температуре, а с компактным германием - при 150-180 С с образованием GeCl4. Пары серы при 200-300 С, сероводород выше 600 °С взаимодействуют с германием, образуя моносульфид GeS.
В воде, соляной и разбавленной серной кислотах германий устойчив. Концентрированная H2S04 медленно растворяет германий, азотная кислота реагирует с образованием гидратированного диоксида Ge02 • ПН20. В царской водке германий легко растворяется. Пероксид водорода растворяет германий с образованием раствора надгерманиевой кислоты.
С графитом и кварцем германий вплоть до температуры 1500 С не взаимодействует, что позволяет использовать эти материалы в технологии получения чистого германия.
Свойства соединений германия
Известны соединения со степенью окисления германия +4 и +2, первые из них более устойчивы. Ниже рассмотрены наиболее важные для технологии соединения германия.
Оксиды и гидроксиды германия. Известны два оксида германия — GeOj и GeO.
Диоксид германия Ge02 - порошок белого цвета, служит основным исходным соединением для производства элементарного германия. Выделяется при гидро-
Предполагается, что читатель знаком с теоретическими основами полупроводниковой электроники.
Таннин - пентадигаллоилглюкоза. Содержится п чернильных орешках, наростах на листьях дуба и др.
Литофильными называют элементы, минералы которых представляют собой силикаты и другие соли кислородных кислот или оксиды.
[9] Ввиду существенного отличия скандия от лантаноидов и малой геохимической связи с ними скандий рассмотрен в отдельной главе.