ТЕХНОЛОГИЯ ИЗВЛЕЧЕНИЯ РЕНИЯ ИЗ РАСТВОРОВ И ПОЛУЧЕНИЯ ПЕРРЕНАТА АММОНИЯ
Основным источником рения служат сернокислые (или азотно-сернокислые) растворы, получаемые в процессе переработки молибденитовых концентратов, и промывная кислота электрофильтров сернокислотных цехов медеплавильных предприятий. Состав этих растворов приведен выше. Кроме того, рений извлекают из маточных растворов после осаждения мо - либдата кальция (при переработке молибденовых промпродуктов) и из маточных растворов после осаждения тетрамолибдата аммония. Растворы содержат 0,01-0,04 г/л рения и 0,2-2 г/л молибдена.
Для извлечения рения из производственных растворов различного состава применяют следующие способы: 1) сорбцию на активированных углях; 2) сорбцию на ионообменных смолах; 3) жидкостную экстракцию; 4) осаждение малорастворимых соединений (KRe04 или Re2S7).
Способы осаждения в настоящее время имеют ограниченное применение. Основными стали сорбционные и экстрацион - ные способы, они рассмотрены ниже. Конечным продуктом переработки растворов является перренат аммония NH4Re04, из которого получают металлический рений.
Сорбция на активированном угле. Из сернокислотных растворов рениевая кислота сорбируется на активированном угле в широком интервале кислотности (от рН=2+3 до концентрации кислоты 30-40 %). Емкость углей низкая - 2-4 % (при концентрации рения 0,03-0,06 г/л). Вместе с рениевой кислотой сорбируются молибдат-ионы. Это требует предварительной очистки растворов от молибдена до концентраций, соизмеримых с концентрацией рения. С этой целью либо осаждают молибдат кальция, либо избирательно поглощают молибден слабоосновной смолой, например типа АН-1 в сернокислой форме при рН = 2-5-3. В этих условиях ионы Re04 почти не сорбируются на смоле.
Десорбцию с поверхности угля можно проводить избирательно: вначале десорбируют молибден холодным 1 %-ным раствором соды, а затем рений - нагретым до 90 С 1-3 %-ным раствором соды. Сорбцию на углях обычно применяют для извлечения рения из бедных растворов (0,01-0,05 г/л рения). В этом случае получаемые после де - 230 сорбции растворы содержат 0,2-1 г/л рения. Чтобы получить более концентрированные растворы, повторяют операцию сорбции на угле или используют более эффективное ионообменное концентрирование. Преимущества угля как сорбента - высокая избирательность в отношении рения; недостаток - малая емкость и потеря активности после 4-6 циклов сорбции - десорбции.
Сорбция на ионообменных смолах. Ионообменную сорбцию используют в различных вариантах для селективного извлечения рения из растворов и его концентрирования. Наиболее высокой емкостью по рению обладают сильноосновные смолы (советские смолы АВ-17, АВ-27, AM и др). При рН = 6*8 их емкость по рению достигает 50-60%. Сродство анионов ReC>7 к сильноосновным смолам столь велико, что рений не элюи- руется со смолы даже растворами гидроксида натрия. Элюи - рование приходится проводить кислотами высокой концентрации: 7 н. НСІ, 4-5 н. HN03 или 1 н. НСЮ4.
Если на сильноосновной смоле вместе сорбированы рений и молибден, можно элюировать вначале молибдат-ионы раствором щелочи, а затем кислотой — рений. Вместо кислот можно в качестве элюента рения использовать раствор роданистого аммония (ионы SCN - имеют высокое сродство к ио - ниту).
У слабоосновных анионитов (советские марки АН-2Ф, АН - 21, АН-82 и др.) емкость по рению значительно ниже, чем у сильноосновных, но элюация легко осуществляется растворами аммиака, что существенно упрощает технологию получения перрената аммония.
Ниже в качестве примера приведены варианты технологии извлечения рения и получения перрената аммония из растворов мокрых систем улавливания, содержащих, г/л: Re 0,5-0,7; Мо 7-12; H2S04 120-150.
Вариант 1. Используется слабоосновная смола АН - 21x16 в S04~- или СГ - форме. Смола из кислого раствора избирательно сорбирует рений (молибден практически не сорбируется). Процесс проводится в двух последовательно соединенных колонках с переключением на третью колонку после насыщения смолы в первой. Обменная емкость смолы по рению 20-30 %. Рений элюируют со смолы 5-6 %-ным раствором аммиака. Полученный раствор (15-20 г/л Re) выпаривают до плотности 1,13-1,14 г/см3. После охлаждения выпадают
231
Кристаллы NH4Re04. В результате одной перекристаллизации получают соль высокой чистоты. Общее извлечение составляет 97-99 %. Та же технология применима для промывной кислоты электрофильтров сернокислотного производства. Однако исходный раствор должен быть разбавлен до концентрации кислоты 100-150 г/л.
Вариант 2. Используется сильноосновная смола типа AM в NOj - или So^-форме. При сорбции из растворов приведенного выше состава емкость по рению равна 10-15 %, по молибдену - 10 %. Рений и молибден сорбируются совместно. Молибден затем избирательно элюируется 10 %-ным раствором щелочи, затем рений элюируется 4 н. HN03. Из элюата (~ 10 г/л Re) после выпаривания до концентрации 100-120 г/л кристаллизуется NH4Re04 (при добавлении
Вариантом этой технологии является сорбция на высокоосновной смоле в роданидной форме (емкость по рению 20-23 %, молибден сорбируется в малой степени). Рений элюируют 3 %-ным раствором NH4SCN. При этом получают раствор NH4Re04, и регенерируется смола. Из раствора кристаллизуют перренат аммония.
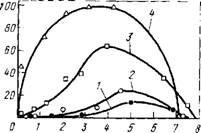
Экстракционные способы. Рений можно экстрагировать из водных растворов различными экстрагентами: спиртами, три - бутилфосфатом, солями аминов и четвертичных аммониевых оснований (рис.61). Высокоэффективный экстрагент при экстракции из сернокислых растворов - соль триоктиламина (ТОА), который извлекает рений с высокими коэффициентами распределения из растворов с концентрацией H2S04 от долей процента до 50 %. Экстракция протекает по механизму меж - фазного анионного обмена:
(R3NH)HS04 + ReO; (Ј3NH)Re04 + HSO" (5.3)
Растворителем амина служит керосин. Чтобы предотвратить выпадение солей аминов, сравнительно малорастворимых в керосине, в органическую фазу добавляют многоатомные спирты (фракции С, - С9) или трибутилфосфат. Реэкстракцию рения проводят 5-10 %-ным раствором аммиака. Из аммиачного раствора выделяют перренат аммония. Молибден, если он присутствует в растворах, экстрагируется солью ТОА вместе с рением. В связи с этим разработаны технологические варианты, в которых первоначально селективно экстрагируют 232
[Нг50ц](), моль/л
Ржс.61. Зависимость коэффициента распределения рения D от концентрации серной кислоты. Исходная концентрация рения 100 мг/л; растворитель - керосин: 1 - изоамиловый спирт, 50 %-ньгй раствор; 2 - диоктиламин; 0,75 %-ный раствор; 3 - трибутил - фосфат, 50 %-ный раствор; 4 - соль триоктиламина, 0,75 %-ный раствор
Молибден катионообменным экстрагентом - ди-2- этилгексилфосфорной кислотой при рН-2 (экстрагируются катионы Мо02+ в составе соединения Мо02(Д2Р04)2 • 2НІ?2Р04). Затем экстрагируют рений солью триоктиламина.
Рационально применение экстракции солью ТОА для промывной кислоты электрофильтров сернокислотного производства, содержащей, г/л: H2S04 500; Re 0,1-0,5; примеси Си, Zn, Fe, As и др.
Экстракцию рения можно проводить без разбавления кислоты, что представляет существенные преимущества, так как кислота может быть возвращена на орошение электрофильтра.
Экстракцию ведут 0,3-0,4 М раствором соли технического ТОА в керосине с добавкой 10% октилового спирта. После промывки органической фазы разбавленной серной кислотой проводят реэкстракцию 8-10 %-ным раствором NH3 при отношении объемов органической и водной фаз, обеспечивающем получение аммиачных реэкстрактов с концентрацией рения 10-15 г/л. Из них выделяют перренат аммония. Общее извлечение рения в перренат аммония 98,5%.
Для получения рениевого порошка перренат аммония восстанавливают водородом:
NH4Re04 + 2Нг = Re + Чг N2 + 4Н20. (5.4)
Перренат аммония перед восстановлением измельчают в покрытых резиной мельничных барабанах с измельчающими телами из обломков рениевых штабиков. Измельченный перренат аммония восстанавливают водородом в трубчатых печах с непрерывной продвижкой лодочек из молибдена. Соль засыпается тонким слоем (6-8 мм). Восстановление ведут в две стадии: при 350-370 °С (до образования Re02), затем при 950-970 °С. Время пребывания лодочек в горячей зоне печи 1-2 ч.
Получение компактного рения
Компактный рений получают преимущественно методом порошковой металлургии. Порошки рения имеют средний размер 1-3 мкм (основная величина зерен меньше 2-мкм), их насыпная масса 1,5-1,9 г/см3. Порошки прессуют в стальных пресс-формах под давлением 500-600 МПа в прямоугольные штабики (12x12x100 мм), плотность которых около 9,5г/см3 45 % от теоретической плотности). С целью некоторого упрочнения и удаления летучих примесей штабики предварительно спекают при 1200 С в вакуумной печи (давление 0,065-0,13 Па) или в водороде в течение 1 ч. Высокотемпературное спекание ведут в водороде в аппаратах, применяемых для спекания ("сварки") вольфрамовых штабиков. Максимальная температура спекания 2800-2850 °С. Степень усадки при спекании зависит от содержания летучих (в условиях спекания) примесей. К ним прежде всего относятся щелочные металлы.
Влияние примеси калия на усадку видно из приведенных ниже данных:
Содержание калия, %. . . . <0,006 0,02-0,05 0,06-0,1 >0,1 Плотность спеченного штабика, % от теоретической плотности >90 86-88 70-80 62-75
Вредная примесь - медь испаряется в условиях спекания. Спеченные штабики, плотность которых должна быть не ниже 19,0 г/см3 90% теоретической плотности), затем уплотняют ковкой или прокаткой на холоду с промежуточными отжигами. Горячую обработку рения не применяют из-за его красноломкости, которая обусловлена образованием легкоплавкого оксида Re207 по границам зерен.
Сложность механической обработки рения состоит в том, что он отличается высоким сопротивлением деформации. Даже при малой степени деформации (5-10 %) его твердость по Виккерсу возрастает от 2500-3000 до 8000 МПа. Поэтому после холодной деформации ведут отжиг при 1700-1800 °С в течение 30-60 мин и далее продолжают механическую обработку на холоду.
Рений относительно легко поддается прокатке. Возможно получение фольги толщиной до 25 мкм. Протяжка металла трудней. Проволоку протягивают до диаметра 75 мкм.
Кроме способа порошковой металлургии для получения компактного рения применяют вакуумную плавку в дуговых и электронно-лучевых печах. Обычно на плавку поступают спеченные штабики.
Глава 6. СЕЛЕН И ТЕЛЛУР 1. ОБЩИЕ СВЕДЕНИЯ
Теллур открыл в 1782 г. венгерский химик Мюллер фон Райхенштейн в минерале, известном под названием "белая золотая руда". Название "теллур" дал элементу в 1798 г. Клапрот (от латинского слова tellus - земля).
Селен открыли в 1817 г. шведские химики Берцелиус и Ган при исследовании осадков, образовавшихся в свинцовой камере при производстве серной кислоты. Осадок рассматривали как возможный источник теллура, однако исследование показало, что в нем содержится, новый элемент, который из-за химического сходства с теллуром назван «selene» (от греческого - Луна).
Изучение свойств селена и теллура, областей применения, источников получения стало интенсивнее с начала XX в., особенно и связи с использованием полупроводниковых материалов в ряде отраслей новой техники. Промышленное производство селена и теллура началось с 1910 г. В СССР иа базе медеэлек - тролитных анодных шламов производство селена организовано в 1928 г., теллура - в 1932 г.
Свойства селена и теллура
Селей и теллур - элементы главной подгруппы VI группы периодической системы элементов. Они обладают близкими химическими и физическими свойствами, что объясняется изоструктурностью электронных оболочек, завершающихся ns2np* электронами.
Селен и теллур в составе элементов VIA подгруппы занимают промежуточное положение между неметаллами (О, S) и металлами (Ро). Элементарный селен, подобно сере, отличается склонностью к аллотропии; для теллура более характерен металлический вид модификаций.
У селена известно несколько модификаций, существующих при атмосферном давлении. Стекловидный селен получается при более быстром охлаждении расплавленного селена; хрупок, черного цвета, плотность 4,28 г/см3, не является полупроводником. Аморфный селен получают восстановлением селенистой кислоты сернистым газом; цвет от ярко-красного до черного, плотность 4,26 г/см3. Моноклинный селен существует в двух модификациях (а и /3), которые кристаллизуются при выпаривании раствора селена в CS-, или бензоле. Оранжево-красный а-селен (плотность 4,46 г/см3, (пл = 170 С) получается при медленном выпаривании раствора; темно-красный - селен (плотность 4,50_г/см3, Ґпл = 180 С) - при быстром выпаривании растворов. Гексагональный (у) селен получается при длительном нагревании других модификаций; серого цвета, плотность 4,80 г/см3.
Теллур имеет серебристо-белый цвет, металлический блеск, характеризуется гексагональной кристаллической решеткой, двумя модификациями а и |3, температура перехода 354 С.
Ниже приведены некоторые физические свойства селена и теллура (параметры решетки, температура плавления и др. для гексагональных модификаций).
Атомный номер
Атомная масса
Плотность* г/см3
Потенциал ионизации, В. . . . Параметры элементарной ячейки кристаллической решетки, нм:
А
С
Ширина запрещенной зоны, эВ. . Твердость по ^ікале Мооса. . . Температура, С: плавления ....
Кипения
Селен 34
78,96
4,80
9,75
Теллур 52
127,60
6,33
9,01
0,4354 0,4949 1,6 2
221 685
6,103 95,30
0,44570 0,59290 0,34 2,3
452 993
17,05 114,53
Теплота, кДж/моль: плавления .... испарения....
Элементарные селен и теллур химически активны, особенно аморфные и мелкодисперсные. При нагревании на воздухе или в кислороде горят, образуя диоксиды. С фтором, хлором и бромом реагируют при комнатной температуре или небольшом нагревании, образуя SeF6, TeF6, SeCl4, ТеС14, SeBr4, ТеВг4. Выше 200 С с водородом образуют H2Se и Н2Те. При нагревании соединяются ^большинством металлов, при этом образуются селениды и теллуриды. При 250 С селен и теллур устойчивы в воде и соляной кислоте.
Концентрированные растворы щелочей при нагревании растворяют селен и теллур:
3Э + 6КОН 2К2Э + К2Э03 + ЗН20, (6.1)
Где Э — селен, теллур.
Селен и теллур реагируют с сернистыми щелочами с образованием сульфодиселенида Na2SSe2 и трвтиотеллурита Na2TeS3. Селен растворяется в растворе сульфита натрия с образованием тиоселената Na2SeS03.
Свойства химических соединений
Для селена и теллура характерна степень окисления -2, +4, +6.
Оксиды. Наиболее устойчивы диоксиды Se02, Те02 и триоксиды Se03, Те03; все они ангидриДы. о Диоксиды - кристаллические вещества. Se02 растворим в воде (67 % при 25 С), Те02 в воде почти нерастворим. Se03 - кристаллическое вещество, растворяется в воде с образованием селеновой кислоты H2Se04; триоксид селена летуч. ТеОэ растворяется лишь в концентрированных растворах щелочей при нагревании, образуя теллураты.
Кислоты. Селенистая кислота H2Se03 - бесцветные кристаллы. Растворимость в воде при О °С 47,4 %, при 20-°С 62,5 %, при 90 С 79,4 %. Малодиссоцииро - вана (К1 = = 3,5 • 10~3), окисляется сильными окислителями до селеновой кислоты H2Se04. Однако в присутствии восстановителей (H2S, S02, HI) восстанавливается до элементарного селена.
Селеновая кислота - сильный окислитель, распюряет золото, серебро, палладий, теллур, серу. Кипит при 205 °С, при 260 С разлагается на диоксид селеиа, кислород и воду.
Теллуристая кислота Н2ТеОэ - малорастворима, легко разлагается при нагревании, образуя Те02.
Теллуровая кислота известна как ортокислота Н6Те06 - белое кристаллическое вещество; растворимость в воде при 0 С 13,9 %, при 100 С 60,8 %, При обезвоживании переходит при 100-200 С в п'олиметателлуровую кислоту (Н2Те04)л, выше 300 С разлагается.
Соли. Соли селенистой и теллуристой кислот называются соответственно селенитами и теллуритами. Селениты и теллуриты щелочных металлов и аммония хорошо растворимы в воде, другие соли - малорастворимы. Селениты при нагревании диссоциируют на оксиды, теллуриты устойчивы до 1000 С.
Соли селеновой и теллуровой кислот - селенаты и теллураты - сильные окислители, по свойствам похожи на сульфаты. Селенаты и теллураты щелочных металлов хорошо растворимы в воде. Теллураты тяжелых металлов - практически нерастворимы.
Галогениды. Основной тип галогенидов селена и теллура - ЭНа14 только с фтором оборазуются гексафториды SeF6 и TeF6. Получаются при взаимодействии селена (теллура) с галогенами.
SeCl4 и ТеС14- твердые вещества, растворяются в концентрированной соляной кислоте с образованием комплексных хлорокислот H2SeCl6, Н2ТеС16. Галогениды - легколетучие (fK„n SeCl4 196 °С, ТеС14 382 °С), при нагревании в воде гидролизуются, например,
SeCl4 + ЗН20 = H2Se03 + +4НС1 (6.2)
Селениды и теллуриды - соединения селена и теллура с другими элементами - получаются синтезом из элементарных веществ или пропускании H2Se и Н2Те через растворы солей. Другой способ - восстановление селенидов и теллури - дов, например, по реакции
2Na2Se03 + ЗС = 2Na2Se + ЗС02 (6.3)
Селениды и теллуриды щелочных металлов растворимы в воде, разлагаются кислородом в растворах:
2Na2Se + 02 + 2H20 = 2Se + 4NaOH. (6.4)
Селениды и теллуриды большинства цветных и редких металлов в воде нерастворимы. Многие обладают полупроводниковыми свойствами.
Области применения
Селен и теллур в настоящее время применяют в электро - и радиотехнике, металлургии, химической промышленности и других областях.
Электротехника и радиотехника. Большая чувствительность селена к колебаниям интенсивности света используется в фототранзисторах, термоэлектирческих устройствах, в солнечных батареях, люминофорах. Теллуриды свинца, олова, ртути и кадмия служат для изготовления инфракрасных излучателей, детекторов радиации. Селеном и теллуром легируют полупроводники.
Металлургия. Теллур и селен улучшают способность к механической обработке малоуглеродистых и некоторых нержавеющих сталей. Теллур резко снижает поглощение азота жидким чугуном и сталью, уменьшает пористость их отливок. Теллуром легируют медь для улучшения ее обрабатываемости (до 0,75 % теллура в меди не снижают ее электропроводности). Добавка 0,1-0,5 % теллура к свинцу увеличивает его прочность и коррозионную стойкость, что необходимо при изготовлении оболочек кабелей, облицовки химической аппаратуры.
Стекольная промышленность. Селен позволяет получать стекла от розового до темно-красного ("рубинового") для сигнальных фонарей. Добавление теллура позволяет получать коричневое стекло. На основе Те02 получают стекла с высокими показателями преломления, а также стекла, пропускающие инфракрасные лучи в широком интервале длин волн. Селен и теллур входят в состав пигментов для керамики, глазурей и эмалей.
Химическая промышленность. Селен и теллур применяют в качестве вулканизаторов и ускорителей для улучшения эластичности и повышения стойкости резины. Постоянно расширяется их применение в химической и фармацевтической промышленности для катализаторов окисления, гидрирования, дегидрирования, галогенирования. Селен и теллур увеличивают стойкость смазочных масел против окисления. Селениды и теллуриды ряда переходных металлов - компоненты атифри- кционных покрытий и материалов. Входят в состав дезинфицирующих веществ, инсектицидов, фунгицидов и гербицидов.
Мировое производство селена и теллура в капиталистических странах в 1985-1986 гг. составляло около 720-1600 и около 220 т соответственно.
Основные производители селена и теллура - Япония 450 т/год Se) и Канада (-350 т/год Se).
Содержание селена в земной коре 6 • Ю-5, теллура 1-10~6% (по массе). Они имеют около 80 собственных минералов, в которых представлены селенидами, теллуридами, окисленными минералами. Селен и теллур не образуют самостоятельных месторождений, находятся в виде примеси в рудах других металлов.
Поведение селена и теллура и их соединений в процессе обогащения руды характеризуется низкой степенью перехода в концентраты. Так, при селективной флотации извлечение в медные концентраты составляет 10-25 %; цинковые 5-10 %, свинцовые 20-35 %, никелевые и молибденовые 0,5-5 % от содержания селена и теллура в руде. Большая часть селена и теллура остается в хвостах обогащения и пиритных концентратах.
В процессе металлургической обработки сульфидных руд и концентратов (меди, никеля, цинка, свинца), золотосодержащих руд и пиритных концентратов селен и теллур распределяются и накапливаются в отходах и полупродуктах предприятий: в пылях процессов агломерации, плавки и обжига концентратов цветных металлов, шламах электролитического рафинирования меди, никеля, в шламах и илах сернокислотного производства, отходах рафицирования свинца и др.
Основной источник селена и теллура - анодные шламы электролитического рафинирвоания черновой меди. Их состав, %: Си 10-32, Ag 7,5-30,5, Аи 0,2-1,4, Se 2,0-16,0, Те 0,3-8,0, Bi 0,1-1,2, As 0,4-0,5, Sb 0,1-11,0, Pb 2,3-24,0, Ni 0,2-2,5, Fe 0,3-0,5, Si02 1,6-9,7, S 2-10.
Селен и теллур извлекают из шлама попутно с извлечением из него меди, золота и серебра.
Другой важный источник селена и теллура - шламы сернокислотного и целлюлозно-бумажного производства, в которых содержится 3-42% Se и 0,2-14% Те. Отходы и полупродукты свинцового производства в возрастающих количествах перерабатывают, извлекая селен и теллур.
2. ВЫДЕЛЕНИЕ ЭЛЕМЕНТАРНОГО СЕЛЕНА И ТЕЛЛУРА ИЗ РАСТВОРОВ
В процессе переработки полупродуктов или отходов селен и теллур переводят в щелочные, щелочно-содовые, серно - и солянокислые растворы, в которых они находятся в составе ионов SeOl", Se042", ТеО|~, TeOj", Se2-, Те2-.
Осаждение элементарных селена и теллура восстановлением сернистым газом. Процесс основан на протекании окислительно-восстановительных реакций:
Н2Ме03 + 2SOz + Н20 = Me + 2H2S04, (6.5)
Где Me - селен, теллур.
На практике принято раздельное выделение селена и теллура при совместном присутствии их в растворах: из сильнокислых растворов вначале сернистым газом осажают селен, затем раствор разбавляют, осаждая теллур.
Селен в степени окисления +6 сернистым газом не восстанавливается, поэтому селеновую кислоту предварительно восстанавливают до селенистой кислоты добавлением концентрированной соляной кислоты
H2Se04 + 2НС1 = H2SeOj + Cl2 + Н20 (6.6)
Или добавлением солей двухвалентоного железа.
Получение элементарного селена и теллура селенидным и теллуридным способом. По этому способу селенит или теллу - рит в щелочном водном растворе восстанавливают металлическим алюминием:
Na2Me03 + 2А1 + 2NaOH + 3H20 = Na2Me + 2Na[Al(OH)J.(6.7)
Затем, пропуская через раствор воздух (операция"аэра - ции"), получают элементарный селен (или теллур):
2Ш2Ме + 02 + 2Н20 = .2 Me + 4NaOH. (6.8)
Осаждение элементарного теллура электролизом в
F
Щелочной среде. Электролиз теллурит - иона протекает в соответствии с уравнениями:
На катоде ТеО2- + ЗН20 + 4е = Те + бОН"; (6.9)
На аноде 40Н~ - 4ё = 2НгО + 02. (6.10)
Показатели процесса электролиза: содержание теллура в электролите 30-275 г/л, содержание NaOH 90-200 г/л, катодная плотность тока 50-500 А/м2, температура электролита 20-50 С, напряжение на ванне 1,5-2,5 В.
Теллур можно получить также электролизом теллуратов щелочных металлов.
Осаждение теллура гидролитическим способом. Соли теллура гидролизуются в слабокислой среде по реакциям:
Мег Те03 + 2Н+ + Н20 = Те02 • 2Н20 + 2 Ме+, (6.11)
Те Hal, + 4Н20 = Те02 • 2НгО + 4Н Hal (6.12)
(Me - ион одновалентного металла; Hal - ион галогена). Минимальная растворимость Н2ТеОэ составляет ~0,05 г/л при рН = 3,5-5-5,5. Осадок Те02-2Н20 растворяют в кислоте или щелочи и из растворов осаждают элементарный теллур восстановлением сернистым газом или электролизом. Высушенный диоксид теллура можно восстановить углем при 850 °С:
Те02 + С = Те + С02. (6.13)
Выделение теллура из растворов экстракцией. Из щелочных растворов теллур экстрагируется трибутилфосфатом или аминами. Так, при экстракции 80%-ным раствором ТБФ в керосине из растворов, содержащих смесь 2-3 М НС1 и 3,5 М H2S04, образуется сольват НТеС15-2ТБФ. Элементарный теллур получают добавлением к экстракту сульфита натрия:
НТеС15 • 2ТБФ + 2Na2S03 + 2Н20 = Те + 4NaCl + НС1 +
+ 2H2S04 + 2 ТБФ. (6.14)
3. ИЗВЛЕЧЕНИЕ СЕЛЕНА И ТЕЛЛУРА
ИЗ МЕДЕЭЛЕКТРОЛИТНЫХ АНОДНЫХ ШЛАМО В
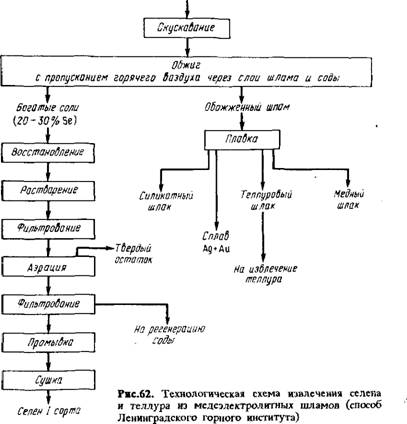
Современные способы переработки анодных шламов предусматривают предварительное удаление меди, затем извлече - ниє селена и теллура и заканчиваются получением сплава серебра и золота (металла Доре).
Технологические схемы переработки медеэлектролитных анодных шламов показаны на рис.62.
Удаление меди необходимо для доизвлечения и возврата в основное производство. Кроме того, медь ухудшает условия плавки на металл Доре. Удаление до 1-3 % меди обеспечивается двумя приемами - механическим и химическим. Крупные частицы меди (обломки, скрапы анода)отделяют на решетке или ситах, пески - в процессе классификации в гидроциклонах, конических классификаторах. Химические методы используют в различных вариантах:
Обезнеженный шла»
Окисление меди при 500-600 °С кислородом воздуха и растворение оксидов в разбавленной серной кислоте;
Окисление меди концентрированной серной кислотой при температурах до 300 °С с последующим водным выщелачиванием сульфата меди;
Окисление меди кислородом воздуха путем аэрации шламов в 10-15 %-ных растворах серной кислоты. Медь переходит в раствор:
2Cu + 2H2S04 + 02 = 2CuS04 + 2Н20. (6.15)
Обезмеженный шлам после фильтрации, промывки и сушки поступает на извлечение селена, теллура и благородных металлов. Извлечение селена составляет 90-95 %, теллура 50-55 %.
Окислительный обжиг шлама. В практике завода шлам обжигают на поду отражательной печи (низкотемпературный обжиг), в печах кипящего слоя или в шахтной печи (высокотемпературный обжиг).
При низкотемпературном обжиге (350-450 °С) элементарные селен и теллур окисляются до диоксидов (начиная с 200 °С), селениды и теллуриды металлов окисляются и входят в состав селенитов и теллуритов:
ШеХ +302 = 2МеХ03, (6.16)
Где Me - свинец, медь, никель, цинк; X -*1 селен, теллур, сера. Кроме того, образуются Ag2Se03, Ag2Te03 и др. Таким образом, селен и теллур остаются в огарке.
При высокотемпературном обжиге (700-800 С) в результате термического разложения селенитов металлов диоксид селена возгоняется:
Me Se03 = Me О + Se02, (6.17)
Где Me - медь, цинк, никель. Селенит свинца разлагается частично. Теллуриты термически более устойчивы, поэтому Те02 возгоняетя лишь частично.
Огарок направляют на получение металла Доре. Извлечение селена составляет около 94%, теллура - до 58%.
На рис.63 приведена цепь аппаратов полупромышленной установки для переработки медеэлектролитных шламов по способу, разработанному сотрудниками Ленинградского горного института. Обезмеженный шлам насосом из реактора 1
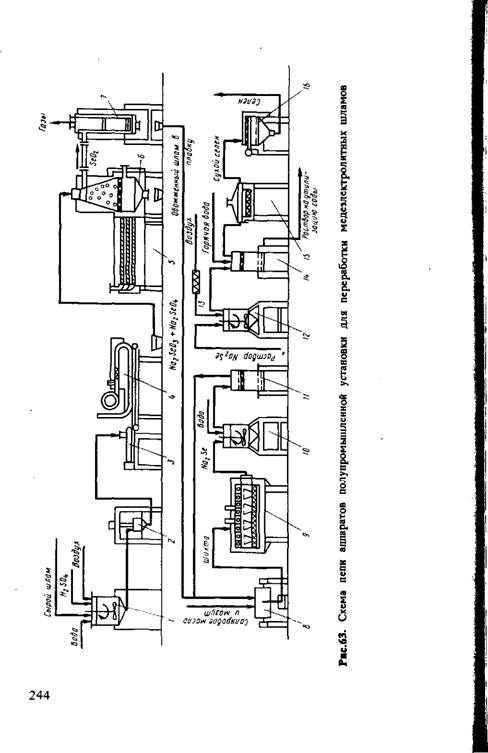
Подают в центрифугу 2 в виде пульпы. Шлам влажностью 30% загружают в приемный бункер пресса 3, обеспечивающего продавливание шлама через насадку с отверстиями диаметром 74 мм. Получаемые при этом влажные брикеты попадают на ленту пластинчатого транспортера 4 сушильной установки, проходя через которую, подсушиваются до влажности 10-15 %. Соду окатывают в чашевом грануляторе диаметром 1000 мм. Окускованный шлам поступает на обжиг в шахтную печь 6, представляющую собой усеченный конус с диаметрами оснований 400 и 500 мм и высотой 1300 мм. Горячий воздух из электрокалорифера 5 поступает в шламовую печь. При этом селен возгоняется [реакция (6.17)]. Газы из шламовой печи пропускают через содовый селеноуловитель, состоящий из двух взаимозаменяемых реторт (7), в которых идет образование селената и селенита натрия. Богатые соли направляют на селенидный передел, а оборотные соли второй реторты помещают на место первой. Второй поглотитель всегда загружают свежей содой.
Богатые соли пропитывают смесью мазута и солярового масла, в смесителе 8, загружают в графитошаметные тигли емкостью 8-10 л и помещают в муфельную печь 9 для восстановления [реакция (6.3)]. Селенидный спек растворяют в воде в аппарате для выщелачивания 10, отфильтровывают нерастворимый остаток в нутч-фильтре 11, селен выделяют из раствора путем окисления кислородом воздуха в аэраторе 12; воздух при этом очищают в фильтре 13. Элементарный селен отделяют на нутч-фильтре 14, сушат в шкафу 15, рассеивают на грохоте 16. Установка рассчитана на разовую загрузку до 300 кг шлама.
При сульфатизирующем обжиге шлама применяют для окисления элементарных меди, селена, теллура, серебра и др., а также селенидов и теллуридов металлов серную кислоту во вращающейся барабанной печи. При температуре до 300 С процесс протекает с образованием сульфатов металлов, диоксидов селена и серы, основного сульфата теллура:
Me + 2H2SO„ = MeS04 + S02 + 2Н20 (Me - Cu, Pb, Ni); (6.18) Se+ 2H2S04 = Se02 + 2S02 + 2H20; (6.19)
2Te +5H2S04 = Te203S04 + 4S02 + 5H20; (6.20)
2Ag + 2H2S04 = Ag2S04 + S02 + 2H20 ; (6.21)
Cu2Se + 6H2S04 = 2CuS04 + Se02 + 4S02 + 6H20; (6.22)
2Cu2Te + 13H2S04 = 4CuS04 + Te203S04 + 8S02 + 13H20.
(6.23)
Аналогично протекают реакции с селенитами и теллурита - ми металлов. При повышении температуры до 600 °С завершается процесс окисления, термически разлагается основной сульфат теллура, образуется теллурит меди:
Te203S04 = 2ТеОг + SOs; (6.24)
Те02 + CuS04 = CuTeOj + S03. (6.25)
При этой температуре диоксид селена отгоняется, а соединения теллура практически полностью остаются в сульфа - тизированном огарке. Из сульфатизированного огарка выщелачивают водой сульфат меди, а затем раствором гидроксида натрия - теллур. Отфильтрованный, промытый и высушенный кек направляют на получение металла Доре. Степень отгонки селена достигает 98%.
Спекание шлама с карбонатом нагрия. ЫагСОъ в окислительной атмосфере приводит при 500-600 °С к образованию растворимых натриевых солей селена и теллура:
Se + Na2C03 + 02 = Na2Se03 + С02; (6.26)
Cu2Se + Na2C03 + 202 = Na2Se03 + 2CuO + C02; (6.27) Ag2Se + Na2C03 + 02 = 2Ag + Na2Se03 + C02. (6.28)
Аналогичные реакции протекают при взаимодействии теллура и теллуритов; одновременно селениты и теллуриты окисляются до селенатов и теллуратов.
Спекание проводят в многоподовых или муфельных печах. Спек выщелачивают водой, кек направляют на получение металла Доре. Расход Na2C03 на спекание - 40-50% от массы шлама. Степень извлечения селена в раствор - до 97 %. При спекании при 650-700 °С образуется малорастворимый в воде теллурат натрия, и в этом случае селен после водного выщелачивания отделяется от теллура.
Прямая плавка обезмеженных шламов реализуется в двух вариантах: 1) купелированием; 2) плавкой в отражательной печи.
Купелированию подвергают шламы с повышенным содержанием свинца. В процессе купеляции селен и теллур переходят в газовую фазу и собираются в продуктах пылеуловительной системы. Так, раствор мокрого электрофильтра содержит до 95г/л Se, 270 г/л H2S04; шлам мокрого электрофильтра - 25-31 г/л Se; 16-18 г/л Pb; пыль сухого электрофильтра - 20-23 г/л Se, 1-5 г/л Те. Шламы и пыли электрофильтров выщелачивают 30%-ной соляной кислотой, содержащей H2S04 и NaClOj. Затем раствор
Подкрепляют концентрированной соляной кислотой для перевода Se (+6) до Se (+4) и восстанавливают селен сернистым газом. Раствор после осаждения селена разбавляют водой, и теллур восстанавливают
Сернистым газом.
Алюминий
Плавкой в отражательной печи перерабатывают шламы, богатые селеном и теллуром, с малым содержанием свинца. При плавке воздухом окисляют селен и теллур до диоксидов, до-
Содобый шлак \
Размол
Выщелачивание
Филыпрадание
Тдердый
Остаток
Pacmbop
I
Электролиз
Фильтрование
F Г"[5] Pacmbop ТверНый остаток
1 І
Васстанадление
I
Рилшродание
Pacmbop
Твердый^ остаток
Аэрация
I
Фильтробание
Сушка Теллур Т1
Ржс.64. Технологическая схема извлечения теллура из содовых шлаков
Бавкой Na2C03 и селитры переводят теллур в теллуриты. В результате получают силикатные шлаки, содовые теллурсо- держащие шлаки, сплав золота и серебра (металл Доре), се - ленсодержащие растворы и шламы в пылеуловительной системе. Из растворов, полученных выщелачиванием содовых шлаков, после нейтрализации получают гидрат диоксида теллура или теллур (рис.64). Из растворов пылеуловительной системы селен осаждают сернистым газом. Извлечение по этому способу составляет: селена 50-75 %, теллура 45-50 %.