РАЗДЕЛЕНИЕ ТАНТАЛА И НИОБИЯ И ОЧИСТКА ИХ СОЕДИНЕНИЙ ОТ ПРИМЕСЕЙ
Известны следующие способы разделения тантала и ниобия: дробная кристаллизация комплексных фтористых солей, экстракция органическими растворителями, разделение с помощью ионообменных смол, ректификация хлоридов, избирательное восстановление пентахлорида ниобия.
Метод дробной кристаллизации комплексных фторидов, являвшийся основным до начала 50-х годов, отчасти применяют и в настоящее время. Однако основным стал экстракционный метод разделения.
Ионообменный метод не используют в промышленной практике вследствие малой производительности по сравнению с жидкостной экстракцией. В случае переработки рудных концентратов хлорированием перспективно применение методов разделения высших хлоридов ректификацией и избирательным восстановлением пентахлорида ниобия.
Попутно с разделением тантала и ниобия обычно осуществляют их очистку от сопутствующих элементов и примесей.
Дробная кристаллизация комплексных фторидов
В 1865 г. швейцарский химик Мариньяк предложил способ разделения тантала и ниобия, который основан на различии
В растворимости фторотанталата калия K2TaF7 и фтороксони - обата калия K2NbOF5 • н2о. Разделению благоприятствует отличие в кристаллической структуре этих солей, что исключает изоморфную сокристаллизацию.
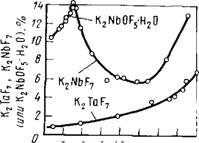
Сопоставление изотерм растворимости танталовой и нио - биевой соли (рис.26) показывает, что разделение выгодно проводить при концентрации HF 1 — 7 %, так как в этой области (в которой в донной фазе устойчива соль K2NbOFj • н2о) растворимость танталовой соли в 10 - 12 раз ниже растворимости ниобиевой соли.
Растворимость ниобиевой и особенно танталовой комплек-
Ршс. 26. Изотермы растворимости комплексных фторидов тантала и ниобия в плавиковой кислоте при
5 1U lb ZU lb ЗО 35 к О 25 с (по Г. С.Савченко н И. В.Та - н р о/0 нанаеву)
Сной соли понижается в присутствии избытка фтористого калия.
Смесь гидратированных оксидов тантала и ниобия растворяют в 23 - 40 %-ной плавиковой кислоте при нагревании до 70 - 80 °С в гуммированных или освинцованных реакторах. В нагретый отфильтрованный раствор добавляют ксі в количестве, необходимом ДЛЯ образования K2TaF7 И K2NbOFs. Из раствора выделяются игольчатые кристаллы K2TaF7. Дополнительная очистка перекристаллизацией из 1 - 2%-ного раствора HF приводит к снижению содержания примесей Si, ті, Fe до сотых долей процента, а ниобия до 0,1 - 0,3 %. Из маточного раствора после выпарки кристаллизуются пластинчатые кристаллы соли K2NbOFs • н2о, которые также очищают перекристаллизацией. Вместе с ниобиевой солью изоморфно кристаллизуется примесь титана в форме K2TiF6. Вследствие этого ниобиевая соль всегда содержит примесь титана. Кроме того, в ней содержится 0,5-2% тантала.
Разделение тантала и ниобия экстракцией
Экстракционное разделение тантала и ниобия с одновременной их очисткой от примесей других элементов (Si, Ті, Fe, Мй, Sn и др.) ведут из растворов фтористых соединений тантала и ниобия, содержащих плавиковую и серную кислоты. Растворы получают в результате разложения рудных концентратов плавиковой кислотой, как описано выше, или растворения смеси технических оксидов.
Для разделения большей частью используют два типа нейтральных экстрагентов: трибутилфосфат (ТБФ) и метилизобу - тилкетон (МИБК).
Ниже сопоставлены свойства ТБФ и МИБК:
ТБФ (С4Н,0)3Р=0 МИБК СН3-С-С4Н,
Температура кипения, °С. . . 178 (при 289 "С 116
Разлагается)
Температура вспышки, °С. . . 145 ~27
Плотность, г/см3 0,97 0,80
Вязкость, сПз 3,41 0,505
Растворимость в воде, %
(объеми.) 0,5 1,7-2,22
(при 25 °С) (при 20 °С)
Растворимость воды в экстра-
Генте, % (объемы.) 7,0 2,2
(при 25 «С) (при 20 °С)
ТБФ отличается от МИБК более высокими температурами кипения и воспламенения и меньшей растворимостью в воде. Его недостаток - высокая плотность и вязкость. Поэтому ТБФ иногда разбавляют инертными разбавителями (керосином, ксилолом), но это приводит к существенному понижению коэффициентов распределения.
ТБФ и МИБК экстрагируют фторидные комплексы тантала и ниобия из растворов с концентрацией HF выше 5 н. по гид - ратно-сольватному типу, т. е. с участием ионов гидроксония н3о • зн2о+ (или н9о4), к которым присоединяются три молекулы ТБФ или МИБК своими активными группами Р = о и с = = о. Это приводит к образованию крупного катиона, к которому присоединяются анионы HTaF7 или HNbFy. Таким образом, состав экстрагируемых комплексов можно представить в случае ТБФ формулой: (Д, о4 • зТБФ)нЭр7. МИБК образует соединения того же состава.
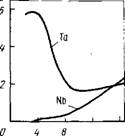
Тантал хорошо экстрагируется ТБФ и кетонами из слабо
кислых растворов, и из сильнокислых, тогда как ниобий экстрагируется только при концентрации HF более 4 н. (рис. 27). Это объясняется тем, что тантал во всем интервале кислотности находится в составе анионов TaF7~ и HTaF7, а
Рже. 27. Зависимость коэффициентов распределения тантала и ниобия Dot концентрации HF (сверх необходимой для образования TaFs и NbFs) при экстракции ТБФ. Концентрация в водном растворе: Та - 0,208 моль/л; Nb - 0,602 моль/л
Ниобий при низких концентрациях HF - в составе гидролизо- ванных ионов NbOFj". Вследствие этого реакция экстракции тантала и ниобия отличаются:
TaFf + 2Н+ + ЗТБФ + 4Н205=^[Н90+ • ЗТБФ]НТаР7; (215)
NbOF?" + 4Н+ + 2F - + ЗТБФ + ЗН20ї=ї[Н90+ • ЗТБФЦ^ЬР,. (2.16)
Отсюда следует:
Лта = ^[Н+^дн-ГГБФ]^.; (2.17)
DNb = ЗДН^^днІТБФ^.ЧР-]2, (2.18)
Где Kja и кмь - константы равновесия реакции (2.15) и (2.16).
При концентрации HF < 4 моль/л D^b«DTcn так как KTa>>KNb• Поэтому ниобий экстрагируется в малой степени. Однако с возрастанием концентрации HF (и соответственно Н+ -ионов) Dfjb быстро увеличивается в соответствии с уравнением (2.18.).
Максимум на кривой экстракции тантала объясняется конкурирующим извлечением в органическую фазу фтористоводородной кислоты. При высокой концентрации HF экстракция тантала протекает по реакции:
12 16 Hf\зе, моль/л
TaF*" + ЗСТБФ-HF) + 4Н20—*{H9oJ • ЗТБФ]НТаР7 + Н+ + 3F";
[ТБФ-HF]3 ■> отсюда DТа = кТа.
[н+ ] • [F-]3
Следовательно, DTa будет уменьшаться с возрастанием концентрации н+ - ионов. Из растворов с высокой концентрацией плавиковой кислоты (9-12 моль/л) в органическую фазу можно совместно извлечь тантал и ниобий, отделив их от ряда сопутствующих элементов (Fe, Mn, Ті, Sn, Si), коэффициенты распределения которых очень малы. Часть плавиковой кислоты можно заменить серной кислотой при сохранении их суммарной молярной концентрации 9-12 моль/л.
Экстракционное разделение тантала и ниобия обычно состоит из трех стадий:
Совместная экстракция тантала и ниобия с целью их отделения от сопутствующих элементов из растворов с концентрацией HF 5-8 моль/л и H2so4 4-5 моль/л.
Избирательная реэкстракция ниобия из экстракта водой.
Реэкстракция тантала водными растворами солей, например фтористого аммония.
Для экстракции преимущественно применяют аппараты двух типов - каскад сместителей-отстойников и пульсационные колонны. Из реэкстрактов осаждают добавлением растворов аммиака чистые гидратированные оксиды ниобия и тантала. Содержание в них примесей не превышает сотых долей процента. Содержание тантала в Nb2o5 и соответственно ниобия в Таго5 ниже 0,1 %.
Разделение тантала и ниобия ректификацией хлоридов
Смесь пентахлоридов тантала и ниобия можно успешно разделить ректификацией, поскольку точки кипения хлоридов отличаются на 14,3 °С (точки кипения ТаС15 и NbCl5 равны 234,0 и 248,3 °С соответственно).
При нормальном давлении относительная летучесть этой системы (коэффициент разделения) равна 1,38.
Как уже отмечалось, разделение ректификацией хлоридов выгодно использовать в том случае, когда концентрат перерабатывают хлорным методом, получая конденсат хлоридов. В последнем ниобий находится преимущественно в составе ок-
сихлорида NbOClj. Поэтому необходимо дополнительное хлорирование для перевода оксихлорида в хлорид. Это легко осуществить, хлорируя материал четыреххлористым углеродом при 350-400 °С:
2NbOCl3 + СС14 = 2NbCI5 + С02. (2.17)
В процессе хлорирования NbCl5 и ТаС15 отгоняются, при этом получают конденсат смеси хлоридов.
Для очистки от хлористого железа, которое затрудняет ректификационное разделение, пятихлористые тантал и ниобий перегоняют в атмосфере водорода при 350 С. При этом FeCi3 восстанавливается до малолетучего FeCi2. Другой путь очистки состоит в пропускании паров хлоридов через солевой фильтр (см. выше).
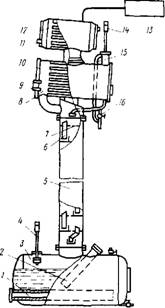
В отечественной литературе описаны результаты лабораторных и полупромышленных опытов по разделению тантала и ниобия ректификацией хлоридов. Полупромышленная колонна из нержавеющей стали имела диаметр 100 мм, 40 реальных тарелок и объем куба 0,2 м3 (рис. 28). В процессе эксплу-
Ржс. 28. Схема ректификационной колонны из нержавеющей стали дли разделения хлоридов тантала и ниобия:
- основной электронагреватель куба;
- пусковой электронагреватель; 3 - куб колонны; 4 - датчик манометра; 5 - ректификационная колонна; 6 - переливной патрубок; 7 - дырчатая тарелка; 8 - конденсатор; 9 - смотровое стекло; 10 - трубы конденсатора; 11 - штуцер подачи воды; 12 - холодильник паров теплоносителя; 13 - система регулирования давления; 14 - датчик манометра; 15 - линия сброса давления в колонне; 16 - кран отбора дистиллята
атации колонны из нержавеющей стали выявилась недостаточная ее стойкость в парах пентахлоридов ниобия и тантала. В связи с этим рекомендовано проводить ректификацию в металлических колоннах, покрытых эмалью, стойкой в парах пентахлоридов, заполненных насадкой из фарфоровых колец.
При разделении смеси хлоридов с преобладающим содержанием ниобия технологическая схема разделения состоит из следующих стадий:
Предварительной ректификации для отделения хлоридов тантала и ниобия от сопутствующих примесей (Ті, Si, Ai и др-);
Основной ректификации - получения чистого NbCi5 и концентрата Taci5;
Ректификации танталовой фракции (получение чистого ТаС15).
Метод ректификации отличается высокой производительностью и эффективностью разделения. Чистые хлориды тантала и ниобия могут служить исходными соединениями для получения тантала и ниобия.