ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ЦИРКОНИЯ И ГАФНИЯ
Циркониевые минералы, руды и рудные концентраты
Содержание циркония в земной коре относительно высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк, олово, никель и свинец. Известно около 20 минералов циркония. Они концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых) пегматитах. Основными промышленными источниками в настоящее время служат минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и эвколит, но они значительно бедней по содержанию циркония.
Бадделеит. По составу представляет собой почти чистый диоксид циркония. В наиболее чистых образцах до 98 % ZrOa. Обычно содержит примесь гафния (до нескольких процентов), изредка уран (до 1 %) и торий (до 0,2 %). Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение найдено в Бразилии.
Основные методы обогащения руд - гравитационные. Для отделения минералов железа и ильменита используют электромагнитное обогащение.
Циркон - ортосиликат циркония ZrSi04 (67,2 % Zr02, 32,8 % Si02). Это наиболее распространенный минерал циркония. Концентрируется главным образом в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях, образующихся при разрушении коренных пород. Циркон большей частью имеет коричневый цвет, плотность минерала 4,4-4.7 г/см3, твердость 7,5 по минералогической шкале. Минерал обычно содержит гафний (0,5-4 %). Основные запасы циркона сосредоточены в прибрежно-морских россыпях. Здесь циркон накапливается вместе с ильменитом, рутилом, монацитом и рядом других минералов.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепа - рациями.
Выпускаемые в СССР цирконовые концентраты первого сорта должны содержать не менее 65% Zr02. В них лимитируется содержание следующих примесей, % (не 6onee):FeO 0,1; Ті02 0,4; А1203 2,0; СаО и MgO 0,1; P2Os 0,15. Концентраты второго сорта должны содержать не менее 60 % Zr02, примеси не лимитируются.
Наиболее крупные месторождения циркона за рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В СССР циркон найден на Урале, Украине и в других районах страны.
Эвдиалит и эвколит. Состав эвдиалита может быть выражен общей эмпирической формулой: (Na, Ca)6Zr[Si60lg] [ОН, С1]2.
Эвколит - разновидность эвдиалита, содержащего ионы Fe2+. Химический состав эвдиалита, %: Na20 11,6-17,3; Zr02 12-14,5; FeO 3,1-7,1; Si02 47,2-51,2; СІ 0,7-1,6. Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других странах.
В капиталистических странах в 1986 г. было добыто 830 тыс. т цирконовых концентратов, в том числе в Австралии - 470, ЮАР - 150, США - 85.
Продукты переработки цирконовых концентратов
Цирконовые концентраты служат исходным материалом для производства ферросиликоциркония, ферроциркония и химических соединений циркония: диоксида циркония, фтороцирко - ната калия и тетрахлорида циркония, . а также соединений гафния.
Ферросиликоцирконий непосредственно выплавляют из цирконовых концентратов. Технический диоксид циркония служит исходным материалом для получения ферроциркония и используется в производстве огнеупоров и керамики. Диоксид циркония высокой чистоты применяют для производства высококачественных огнеупорных изделий и порошкообразного циркония. Фтороцирконат калия и тетрахлорид циркония используют главным образом для производства металлического циркония. Ниже рассмотрены основные способы производства соединений циркония.
Производство диоксида циркония
Разложение концентрата
Циркон практически не разлагается соляной, серной и азотной кислотами. Для его разложения с целью перевода циркония в раствор используют большей частью спекание (или сплавление) с содой или спекание с карбонатом кальция (мелом). Образующиеся цирконаты натрия или кальция растворяются в кислотах, из раствора затем выделяют гидроксид или основные соли циркония. Последние термически разлагают, получая диоксид циркония.
Разложение циркона спеканием с карбонатом натрия. При 1100-1200 С сода реагирует с цирконом с образованием метацирконата и ортосиликата натрия:
ZrSi04 + 3 Na2C03 = Na2Zr03 + Na4Si04 + 2 C02. (4.23)
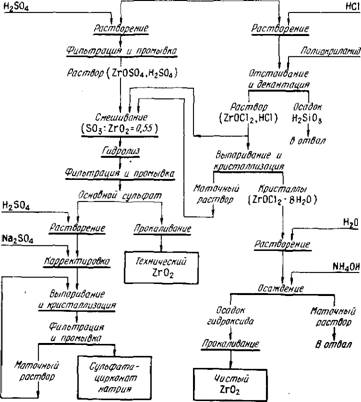
Процесс можно проводить в барабанных печах непрерывного действия, питая печь гранулированной шихтой (размер гранул 5-10 мм). Грануляцию проводят на чашевом грануляторе при увлажнении шихты. Измельченный спек первоначально выщелачивают водой для извлечения в раствор большей части ортосиликата натрия. Осадки после водного выщелачивания обрабатывают соляной или серной кислотой. В первом случае получают солянокислый раствор, содержащий основной хлорид цирконила ZrOCl2, во втором случае - растворы, содержащие основной сульфат циркония Zr(0H)2S04. При кислотной обработке образуется кремниевая кислота, для коагуляции которой в пульпу добавляют флокулянт полиакриламид. Осадки отделяют от цирконийсодержащих растворов фильтрацией.
Разложение циркона спеканием с карбонатом кальция. Процесс основан на взаимодействии циркона с СаС03:
ZrSi04 + 3 СаС03 = CaZr03 + Ca2Si04 + З С02. (4.24)
Эта реакция протекает с достаточной скоростью лишь при 1400-1500 С. Однако добавки в шихту небольшого количества хлорида кальция (~5 % от массы цирконового концентрата) позволяют снизить температуру спекания до 1100- 1200 °С. Ускорение процесса в присутствии малых добавок СаС12 объясняется, вероятно, частичным образованием жидкой фазы (температура плавления СаС12 774 С), а также
Цирконовий концентрат CaCOj I СаС1г
Шихтовка Спекание
Вь/щелачиВание на холоду
„ І Раствор в сброс
Осадок
Ршс.45. Технологическая схема переработки цирконового концентрата по способу спекания с карбонатом кальция
Увеличением структурных дефектов в кристаллах компонентов шихты под действием хлористого кальция.
Шихту, содержащую измельченный цирконовый концентрат, мел и хлорид кальция^ нагревают во вращающихся барабанных печах при 1100-1200 С в течение 4-5 ч, степень разложения достигает 97-98 %.
Обработку спеков соляной кислотой ведут в две стадии. Первоначально при обработке на холоду 5-10 %-ной соляной кислотой растворяется избыточный оксид кальция и разлагается ортосиликат кальция. Образующаяся коллоидная кремниевая кислота удаляется вместе с раствором. Нерастворив - шийся остаток, содержащий цирконат кальция, выщелачивают 25-30 %-ной НСІ при нагревании до 70-80 С, получая растворы, содержащие основной хлорид циркония. Примерно по тем же режимам можно выщелачивать известковые спеки азотной кислотой, получая растворы, содержащие Zr(0H)2(N03)2. Преимущества последней состоят в возможности утилизации азотнокислых маточных растворов после извлечения из них циркония и получения азотнокислых солей.
В случае применения серной кислоты можно выщелачивать известковый спек в одну стадию без существенных затруднений в отношении отделения раствора от осадка кремниевой кислоты. Обработку спека проводят раствором 300-400 г/л HjSC^ при температуре не выше 80-90 С. В этих условиях осадки содержат гидратированные сульфаты кальция - CaS04 • 2 Н20 и CaS04-0,5 Н20, что обеспечивает хорошую фильтрацию осадков. С целью снижения потерь циркония сульфатный кек, количество которого велико (~6 т на 1 т Zr02) многократно промывают водой. В некоторых производственных схемах рационально сочетается выщелачивание известковых спеков соляной и серной кислотами, что обеспечивает получение различных соединений циркония (рис. 45).
Выделение циркония из растворов и получение ZrOj
Растворы, полученные в результате выщелачивания содовых или известковых спеков, содержат цирконий (100-200 г/л) и примеси железа, титана, алюминия, кремния и др. В промышленной практике применяют четыре способа
Выделения циркония из растворов:
Выделение основного хлорида Zr(OH)2Cl2 • 7 HjO.
Выделение основных сульфатов циркония.
Осаждение кристаллогидрата сульфата циркония Zr(S04)2-4 Н20.
Кристаллизация сульфато-цирконатов натрия или аммония (дубитель для кожевенной промышленности).
Ниже рассмотрены наиболее распространенные первые два способа.
Выделение основного хлорида. Способ основан на малой растворимости кристаллогидрата Zr(OH)2Cl2-7 Н20 в концентрированной соляной кислоте, в то время как в воде и разбавленной НС1 растворимость высокая:
Концентрация
НС1, г/л 7,2 135,6 231,5 318 370
Растворимость при 20 °С Zr(OH)2 * 7 Н20,
Г/л 567,5 164,9 20,5 10,8 17,8
Растворимость основного хлорида в концентрированной НСІ при 70°С примерно в 5 раз выше, чем при 20 С. Выпариванием нельзя достигнуть концентрации НС1 выше ~220 г/л, так как образуется азеотропная смесь. Однако в кислоте такой концентрации растворимость Zr(OH)2Cl2-7 Н20 невысокая (~25г/л), что позволяет после охлаждения раствора выделить в кристаллы 70-80 % циркония, содержащегося в растворе. Основной хлорид выделяется в виде крупных кристаллов, имеющих форму тетрагональных призм, легко отделяемых от маточного раствора.
Способ дает возможность получить соединения циркония высокой чистоты, так как большинство примесей остается в солянокислом маточном растворе.
Из основного хлорида легко можно получить другие соединения циркония. Для получения Zr02 основной хлорид растворяют в воде и осаждают добавлением раствора аммиака гидроксид циркония. Прокаливанием последнего при 600-700 С получают диоксид с содержанием Zr02 99,6-99,8 %. Для получения других соединений (нитрата, фторидов) гидроксид растворяют в соответствующей кислоте.
Выделение основных сульфатов. Малорастворимые основные сульфаты, состав которых можно
Выразить общей формулой х ZrO2-у S03-z Н20 (дг>_у), выделяются из растворов при рН = 2-5-3 и мольном отношении S03 : Zr02 в исходном растворе в пределах 0,55-0,9.
При нейтрализации сернокислого раствора, содержащего значительный избыток кислоты, содой или аммиаком, гидролитическое выделение основного сульфата циркония не происходит. Это объясняется тем, что в таких растворах цирконий находится в составе прочных анионов [Zr0(S04)2]2-, образующих с катионами натрия и аммония хорошо растворимые соли. Гидролиз наступает лишь в случае вывода части ионов SOf" из растворов, например добавлением ВаС12 или СаС12, что усложняет технологию.
Значительно проще гидролитическое выделение основных сульфатов из солянокислых или азотнокислых растворов, так как в этом случае в раствор вводится дозированное количество сульфат-ионов (добавляют HjS04 или Na2S04).
Для осаждения основного сульфата в солянокислый раствор, содержащий 40-60 г/л циркония, добавляют H2S04
(0,5-0,7 моля на 1 моль Zr02), нейтрализацией и разбавлением доводят кислотность до 1-1,5 г/л по НС1, а затем нагревают раствор до 70-80 С. В осадок выделяется 97-98 % циркония, его состав примерно соответствует формуле 2 Zr02 • S03 • 5 HjO.
Осадок основного сульфата после промывки, фильтрации и сушки прокаливают для удаления S03 при 850-900 °С в муфельных печах, футерованных высокоглиноземистым огнеупором. Получаемый технический диоксид циркония содержит 97-98 % Zr02. Основные примеси следующие, %: Ті02 0,25-0,5; Si02 0,2-0,5; Fe203 0,05-0,15; CaO 0,2-0,5; S03 0,3-0,4.