ПРОИЗВОДСТВО ТРИОКСИДА ВОЛЬФРАМА
Вольфрамовые минералы, руды и концентраты
Вольфрам - малораспространенный элемент, среднее его содержание в земной коре Ю-4 % (по массе). Известно около 15 минералов вольфрама, однако практическое значение имеют только минералы группы вольфрамита и шеелит.
Вольфрамит (Fe, Mn)WO4 представляет собой изоморфную смесь (твердый раствор) вольфраматов железа и марганца. Если в минерале вольфрамата железа более 80 %, минерал называют ферберитом, в случае преобладания вольфрамата марганца (более 80%) - гюбнеритом. Смеси, лежащие по составу между этими пределами, называют вольфрамитами. Минералы группы вольфрамита окрашены в черный или коричневый цвет и обладают высокой плотностыо(7Д-7,9 г/см3) и твердостью 5-5,5 по минералогической шкале. В минерале содержится 76,3-76,8 % W03. Вольфрамит слабомагнитен.
Шеелит CaWOA - вольфрамат кальция. Цвет минерала - белый, серый, желтый, бурый. Плотность 5,9-6,1 г/см3, твердость по минералогической шкале 4,5-5. Шеелит часто содержит изоморфную примесь повеллита - СаМо04. При облучении ультрафиолетовыми лучами шеелит флюоресцирует сине - голубым светом. При содержании молибдена более 1 % флюоресценция приобретает желтую окраску. Шеелит немагнитен.
Вольфрамовые руды обычно бедны вольфрамом. Минимальное содержание W03 в рудах, при которых рентабельна их эксплуатация, в настоящее время составляет 0,14-0,15 % для крупных и 0,4-0,5% для мелких месторождений.
Вместе с минералами вольфрама в рудах встречаются молибденит, касситерит, пирит, арсенопирит, халькопирит, танталит или колумбит и др.
По минералогическому составу различают два типа месторождений - вольфрамитовые и шеелитовые, а по форме рудных образований - жильный и контактовый типы.
В жильных месторождениях вольфрамовые минералы большей частью залегают в кварцевых жилах небольшой мощности (0,3-1 м). Контактовый тип месторождений связан с зонами контакта гранитных пород с известняками. Для них характерны залежи шеелитоносного скарна (скарны - окварцован - ные известняки). К рудам скарнового типа относится крупнейшее в СССР Тырны-Аузское месторождение на Северном Кавказе. При выветривании жильных месторождений вольфрамит и шеелит накапливаются, образуя россыпи. В последних вольфрамит часто сочетается с касситеритом.
Вольфрамовые руды обогащают, получая стандратные концентраты, содержащие 55-65 % W03. Высокой степени обогащения вольфрамитовых руд достигают, применяя различные методы: гравитацию, флотацию, магнитную и электростатическую сепарацию.
При обогащении шеелитовых руд используют гравитационно-флотационные или чисто флотационные схемы.
Извлечение вольфрама в кондиционные концентраты при обогащении вольфрамовых руд колеблется от 65-70 % до 85-90 %.
При обогащении сложных по составу или труднообогатимых руд иногда экономически выгодно выводить из цикла обогащения промпродукты с содержанием 10-20 % W03 на химическую (гидрометаллургическую) переработку, в результате которой получают "искусственный шеелит" или технический триоксид вольфрама. Подобные комбинированные схемы обеспечивают высокое извлечение вольфрама из руд.
Государственный стандарт(ГОСТ 213-73) предусматривает содержание W03 в вольфрамовых концентратах 1-го сорта не ниже 65 %, 2-го сорта - не ниже 60 %. В них лимитируется содержание примесей Р, S, As, Sn, Си, Pb, Sb, Ві в пределах от сотых долей процента до 1,0 % в зависимости от сорта и назначения концентрата.
Разведанные запасы вольфрама по состоянию на 1981 г. оцениваются в 2903 тыс. т, из них в КНР 1360 тыс. т. Значительными запасами обладают СССР, Канада, Австралия, США, Южная и Северная Корея, Боливия, Бразилия, Португалия. Производство вольфрамовых концентратов в капиталистических и развивающихся странах в период 1971 - 1985 гг. колебалось в пределах 20 - 25 тыс. т (по содержанию металла).
Способы переработки вольфрамовых концентратов
Основной продукт непосредственной переработки вольфрамовых концентратов (помимо ферровольфрама, выплавляемого для нужд черной металлургии) - триоксид вольфрама. Он служит исходным материалом для производства вольфрама и карбида вольфрама — главной составляющей твердых сплавов.
Производственные схемы переработки вольфрамовых концентратов подразделяют на две группы в зависимости от принятого способа разложения:
Вольфрамовые концентраты спекают с содой или обрабатывают водными растворами соды в автоклавах. Вольфрами - товые концентраты иногда разлагают водными растворами ги - дроксида натрия.
Концентраты разлагают кислотами.
В тех случаях, когда для разложения применяют щелочные реагенты, получают растворы вольфрамата натрия, из которых после очистки от примесей производят конечные продукты - паравольфрамат аммония (ПВА) или вольфрамовую кислоту. 24
При разложении концентрата кислотами получают осадки технической вольфрамовой кислоты, которую в последующих операциях очищают от примесей.
Разложение вольфрамовых концентратов. щелочными реагентами Спекание с Na2C03
Спекание вольфрамита с Na2C03. Взаимодействие вольфрамита с содой в присутствии кислорода активно протекает при 800-900 С и описывается следующими реакциями: 2FeW04 + 2Na2C03 + l/202 = 2Na2W04 + Fe203 + 2C02; (l) 3MnW04 + 3Na2C03 + l/202 = 3Na2W04 + Mn304 + 3C02. (2)
Эти реакции протекают с большой убылью энергии Гиббса и практически необратимы. При соотношении в вольфрамите FeO:MnO = i:i AG°1001C = -260 кДж/моль. При избытке Na2C03 в шихте 10-15 % сверх стехиометрического количества достигается полное разложение концентрата. Для ускорения окисления железа и марганца в шихту иногда вводят 1-4 % селитры.
Содержащиеся в вольфрамитовом. концентрате примеси минералов кремния, фосфора, мышьяка, молибдена при спекании с Na2C03 образуют растворимые соли: Na2Si03, Na3P04, Na3As04, Na2Mo04. Касситерит в малой • степени реагирует с Na2C03.
Спекание вольфрамита с Na2C03 на отечественных предприятиях проводят в трубчатых вращающихся печах, футерованных шамотным кирпичом. Во избежание расплавления шихты и образования настылей (наростов) в зонах печи с более низкой температурой в шихту добавляют хвосты от выщелачивания спеков (содержащих оксиды железа и марганца), снижая содержание в ней W03 до 20-22 %.
Печь длиной 20 м и внешним диаметром 2,2 м при скорости вращения 0,4 об/мин и угле наклона 3 имеет производительность 25 т/сут по шихте.
Составляющие шихты (измельченный концентрат, Na2C03, селитра) с помощью автоматических весов подаются из бункеров в шнековый смеситель. Шихта- поступает в бункер печи, из которого подается в печь. Куски спека по выходе из печи проходят дробильные валки и мельницу мокрого размола, из которой пульпу направляют в выше лачиватель (рис.1).
Спекание шеелита с Na2C03. При температурах 800-900 С взаимодействие шеелита с Na2C03 может протекать, по двум реакциям:
CaW04 + Na2CQ3 Na2W04 + СаС03; (1.3)
CaW04 + Na2C03 *=*■ Na2W04 + CaO + C02. (1.4)
Обе реакции иду г с относительно небольшим изменением энергии Гиббса.
Реакция (1.4) протекает в заметной степени выше 850 С, когда наблюдается разложение СаС03. Присутствие оксида кальция в спеке приводит при выщелачивании спека водой к образованию малорастворимого вольфрамата кальция, что снижает извлечение вольфрама в раствор:
Na2W04 + Са(ОН)2 = CaW04 + 2NaOH. (1.5)
При большом избытке Na2C03 в шихте эта реакция в значительной мере подавляется взаимодействием Na2C04 с Са(ОН)2 с образованием СаС03.
Для снижения расхода Na2C03 и предотвращения образования свободного оксида кальция в шихту добавляют кварцевый песок для связывания оксида кальция в труднорасворимые силикаты:
2CaW04 + 2Na2C03 + Si02 = 2Na2W04 + Ca2Si04 + 2C02;(l.6) AG°100IC = -106,5 кДж.
Все же и в этом случае для обеспечения высокой степени извлечения вольфрама в раствор приходится вводить в шихту значительный избыток Na2C03 (50-100% от стехиометричес - кого количества).
Спекание шихты шеелитового концентрата с Na2C03 и кварцевым песком проводят в барабанных печах, как выше описано для вольфрамита при 850-900 °С. Для предотвращения плавления в шихту добавляют отвалы выщелачивания (содержащие в основном силикат кальция) из расчета снижения содержания W03 до 20-22%.
Выщелачивание содовых спеко в. При выщелачивании спеков водой в раствор переходят вольфрамат натрия и растворимые соли примесей (Na2Si03, Na2HP04, Na2HAs04, Na2Mo04, Na2S04), а также избыток Na2C03. Выщелачивание ведут при 80-90 °С в стальных реакторах с механическим перемешиванием, работающих в иерио-
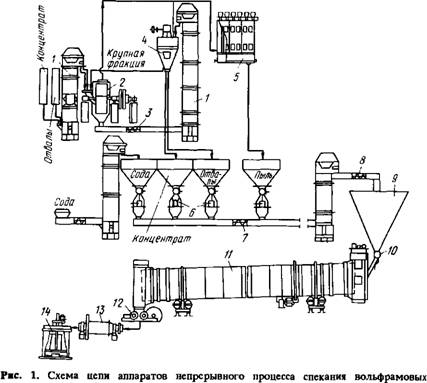
Концентратов с содой:
- элеватор, подающий концентрат в мельницу; 2 - шаровая мельница, работающая в замкнутом цикле с воздушным сепаратором; 3 - шнек; 4 - воздушный сепаратор; 5 - рукавный фильтр; 6 - автоматические весовые дозаторы; 7 - транспортирующий шнек; 8 - шнековый смеситель; 9 - бункер шихты; 10 - питатель;
- барабанная печь; 12 - валковая дробилка; 13 - стержневая мельница- выщелачиватель; 14 - реактор с мешалкой
Дическом режиме, или барабанных вращающихся выщелачивате- лях непрерывного действия. Последние заполняют дробящими стержнями для измельчения кусков спека.
Извлечение вольфрама из спека в раствор составляет 98-99 %. Крепкие растворы содержат 150-200 г/л W03.
Содержание W03 в отфильтрованных и промытых хвостах выщелачивания колеблется от 1,0 до 2 %. Фильтрацию пульпы проводят на вакуумных фильтрах (дисковых или барабанных) или автоматических фильтр-прессах типа ФПАК.
Автоклави о-с одовый способ разложения вольфрамовых концентратов
Автоклавно-содовый способ предложен и разработан в СССР1 применительно к переработке шеелитовых концентратов и промпродуктов. В настоящее время способ применяют на ряде отечественных заводов и в зарубежных странах.
Разложение шеелита растворами Na2C03 основано на обменной реакции
. CaW04CrB)+Na2C03(pacTB)^Na2W04(pacTB)+CaC03(TB). (1.7)
При 200-225 °С и соответствующем избытке Na2C03, зависящем от состава концентрата, разложение протекает с достаточной скоростью и полнотой. Концентрационные константы равновесия реакции (1.7) имеют небольшую величину, возрастают с температурой и зависят от содового эквивалента (т. е. количества молей Na2C03, приходящихся на 1 моль CaW04).
При содовом эквиваленте, равном 1 и 2 при 225 С, константа равновесия (Кс = С /С cq ) равна 1,56 и
2 4 2 3 0
0,99 соответственно. Из этого следует, что при 225 С минимально необходимый содовый эквивалент равен 2 (т. е. избыток Na2C03 равен 100 %). Реальный избыток Na2C03 выше, так как с приближением к равновесию скорость процесса замедляется. Для шеелитовых концентратов с содержанием 45-55 % W03 при 225 С необходим содовый эквивалент 2,6-3. Для промпродуктов, содержащих 15-20 % W03, требуется 4-4,5 моля Na2C03 на 1 моль CaW04.
Образующиеся на частицах шеелита пленки СаС03 пористые и до толщины 0,1-0,13 мм не обнаружено их влияние на скорость разложения шеелита растворами Na2C03. При интенсивном перемешивании скорость процесса определяется скоростью химической стадии, что подтверждается высоким значением кажущейся энергии активации Е = 75+84 кДж/моль. Однако в случае недостаточной скорости перемешивания (что
Имеет место в горизонтальных вращающихся автоклавах) реализуется промежуточный режим: скорость процесса определяется и скоростью подвода реагента к поверхности, и скоростью химического взаимодействия.
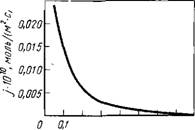
0,025
0,2 0,3 0, it 0,5 0,5 0,7 0,8 Ш гЩУШгС031
Как видно из рис.2, удельная скорость реакции уменьшается примерно обратно пропорционально возрастанию отношения молярных концентраций Na2W04:Na2C03 в растворе. Это
Ряс. 2. Зависимость удельной скорости разложения шеелита раствором соды в автоклаве j от молярного отношения концентраций Na2W04/Na2C03 в растворе при
175 °С
Обусловливает необходимость существенного избытка Na2C03 против минимально необходимого, определяемого значением константы равновесия. Для снижения расхода Na2C03 проводят двухстадийное противоточное выщелачивание. В этом случае хвосты после первого выщелачивания, в которых мало вольфрама (15-20 % от исходного), обрабатывают свежим раствором, содержащим большой избыток Na2C03. Получаемый раствор, являющийся оборотным, поступает на первую стадию выщелачивания.
Разложение растворами Na2C03 в автоклавах применяют также для вольфрамитовых концентратов, однако реакция в этом случае протекает сложней, так как сопровождается гидролитическим разложением карбоната железа (карбонат марганца гидролизуется лишь частично). Разложение вольфрамита при 200-225 °С можно представить следующими реакциями:
MnW04(TB)+Na2C03(paCT)^MiiC03(TB)+Na2W04(paCTB); (1.8)
FeW04(TB)+NaC03(pacT)*=iFeC03(TB)+Na2W04(paCTB); (1.9)
FeC03 + HjO^FeO + Н2С03; (1.10)
Na2C03 + H2C03 = 2NaHC03. (l. ll)
Образующийся оксид железа FeO при 200-225 °С претерпевает превращение по реакции:
3FeO + Н20 = Fe304 + Н2.
Образование гидрокарбоната натрия ведет к снижению концентрации Na2C03 в растворе и требует большого избытка реагента.
Для достижения удовлетворительных показателей разложения вольфрамитовых концентратов необходимо тонкое их измельчение и увеличение расхода Na2C03 до 3,5-4,5 г-экв в зависимости от состава концентрата. Более трудно разлагаются высокомарганцовистые вольфрамиты.
Добавление в автоклавную пульпу NaOH или СаО (что приводит к каустификации Na2C03) позволяет улучшить степень разложения.
(1.12)
Скорость разложения вольфрамита можно увеличить введением в автоклавную пульпу кислорода (воздуха), окисляющего Fe (II) и Mil (II), что приводит к разрушению кристаллической решетки минерала на реагирующей поверхности.
Вторичный пар
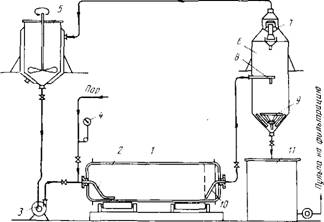
Ряс. 3. Автоклавная установка с горизонтально вращающимся автоклавом: 1 - автоклав; 2 - загрузочная труба для пульпы (по ней же вводится пар); 3 - пульповый насос; 4 - манометр; 5 - реактор-подогреватель пульпы; 6 - самоиспаритель; 7 - каплеотделитель; 8 - ввод пульпы в самоиспаритель; 9 - отбойник из броневой стали; 10 - труба для отвода пульпы; 11 - сборник пульпы
Выщелачивание проводят в стальных горизонтальных вращающихся автоклавах с обогревом острым паром (рис.3) и вертикальных автоклавах непрерывного действия с перемешиванием пульпы барботажным паром. Примерный режим процесса: температура 225 давление в автоклаве ~2,5 Мпа, отношение Т:Ж=1:(3,5*4), продолжительность на каждой стадии 2-4 ч.
На рис.4 приведена схема батареи автоклавов. Исходная автоклавная пульпа, подогретая паром до 80-100 °С, подается насосом в автоклавы, в которых нагревается до
Вторичный пар
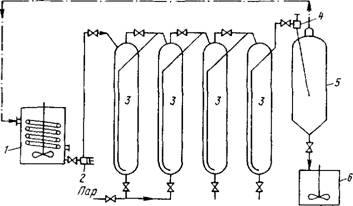
Рве. 4. Схема автоклавной установки непрерывного действия: 1 - реактор для подогрева исходной пульпы; 2 - поршневой насос; 3 - автокла вы; 4 - дроссель; 5 - самоиспаритель; 6 - сборник пульпы
200-225 °С острым паром. При непрерывном режиме работы давление в автоклаве поддерживается путем выпуска пульпы через дроссель (калиброванную шайбу из твердого сплава). Пульпа поступает в самоиспаритель - сосуд, находящийся под давлением 0,15-0,2 МПа, где происходит быстрое охлаждение пульпы вследствие интенсивного испарения. Преимущества автоклавно-содового разложения шеелитовых концентратов перед спеканием состоят в исключении печного процесса и несколько меньшем содержании примесей в вольфрамахных растворах (особенно фосфора и мышьяка).
К недостаткам способа следует отнести большой расход Na2C03. Высокая концентрация избыточной Na2C03 (80-120 г/л) влечет за собой повышенный расход кислот на нейтрализацию растворов и соответственно большие затраты на утилизацию сбросных растворов.
Разложение вольфраматовых к о н ц е н і р атов раств о р а м и гидроксида натрия
Растворы гидроксида натрия разлагают вольфрамит по обменной реакции:
Me WC>4 + 2Na0Hi=tNa2W04 + Ме(0 Н)2, (1.13)
Где Me — железо, марганец.
Величина концентрационной константы этой реакции Кс = [Na2WOj/[NaOH]2 при температурах 90, 120 и 150 °С равна соответственно 0,68; 2,23 и 2,27.
Полное разложение (98-99 %) достигается при обработке тонкоизмельченного концентрата 25-40 %-ным раствором гидроксида натрия при 110-120 °С. Требуемый избыток щелочи - 50 % и выше. Разложение проводят в стальных герметичных реакторах, снабженных мешалками. Пропускание в раствор воздуха ускоряет процесс благодаря окислению гидроксида железа (II) Fe(OH)2 в гидратированный оксид железа (III) Fe203-«H20 и гидроксида марганца (II) Мп(ОН)2 в гидратированный оксид марганца (IV) Мп02-лН20.
Применение разложения растворами щелочи целесообразно лишь для высокосортных вольфрамитовых концентратов (65-70 % W02) с небольшим содержанием примеси кремнезема и силикатов. При обработке низкосортных концентратов получают сильно загрязненные растворы и труднофильгруемые осадки.
Переработка растворов вольфрамата натрия
Растворы вольфрамата натрия, содержащие 80-150 г/л W03, с целью получения триоксида вольфрама требуемой чистоты до настоящего времени преимущественно перерабатывали по традиционной схеме, которая включает: очистку от соединений элементов-примесей (Si, Р, As, F, Мо); осаждение
Вольфрамага кальция (искусственного шеелита) с последующим его разложением кислотами и получением технической вольфрамовой кислоты; растворение вольфрамовой кислоты в аммиачной воде с последующей выпаркой раствора и кристаллизацией паравольфрамата аммония (ПВА); прокаливание ПВА с получением чистого триоксида вольфрама.
Основной недостаток схемы - многостадийность, проведение большинства операций в периодическом режиме, длительность ряда переделов. Разработана и уже используется на некоторых предприятиях экстракционная и ионообменная технология перевода растворов Na2W04 в растворы (NH4)2W04. Ниже кратко рассмотрены основные переделы традиционной схемы и новые экстракционный и ионообменный варианты технологии.
Очистка от примесей
Очистка от кремния. При содержании в растворах Si02, превышающем 0,1 % от содержания W03, необходима предварительная очистка от кремния. Очистка основана на гидролитическом разложении Na2Si03 при кипячении раствора, нейтрализованного до рН=8*9 с выделением кремниевой кислоты.
Растворы нейтрализуют соляной кислотой, добавляемой тонкой струйкой при перемешивании (во избежание местных перекислений) к нагретому раствору вольфрамата натрия.
Очистка от фосфора и мышьяка. Для очистки от фосфат - и арсенат-ионов используют метод осаждения аммонийно-магниевых солей Mg(NH4)P04 • 6Н20 и Mg(NH4)AsC)4 • 6Н20. Растворимость этих солей в воде при 20 С 0,058 и 0,038 % соответственно. В присутствии избытка ионов Mg2+ и NH4 растворимость ниже.
Осаждение примесей фосфора и мышьяка ведут на холоду:
Na2HP04 + MgCl2 + NH4OH = Mg(NH4)P04 + 2NaCl +
+ H20; (1.14)
Na2HAsQ4 + MgCl2 + NH4OH = Mg(NH4)AsQ4 + 2NaCl +
+ H20. (1.15)
После длительного стояния (48 ч) из раствора выпадают кристаллические осадки аммонийно-магниевых солей.
2-1325 . 33
Очистка от фторид-ионов. При высоком содержании флюорита в исходном концентрате содержание фторид-ионов достигает 5 г/л. Растворы очищают от фторид - ионов осаждением фторидом магния из нейтрализованного раствора, в который добавляют MgCl2. Очистку от фтора можно сочетать с гидролитическим выделением кремниевой кислоты.
Очистка от молибдена. Растворы вольфрамата натрия" необходимо очищать от молибдена в том случае, если его содержание превышает 0,1 % от содержания W03 (т. е. 0,1-0,2 т/л). При концентрации молибдена 5-10 г/л (например, при переработке шеелито-повеллитовых Тырны- Аузских концентратов) выделение молибдена приобретает особое значение, так как имеет целью получение молибденового химического концентрата.
Распространенный способ состоит в осаждении из раствора малорастворимого трисульфида молибдена MoS3.
Известно, что при добавлении в растворы вольфрамата или молибдата натрия сернистого натрия образуются сульфо - соли Na23S4 или оксосульфосоли Na23Sx04_x (где Э - Мо или W):
Na2304 + 4NaHS = Na23S4 + 4NaOH. (1.16)
Константа равновесия этой реакции для Na2Mo04 значительно больше, чем для Na2W04(^^0 » Кцг). Поэтому, если в раствор добавлено количество Na2S, достаточное лишь для взаимодействия с Na2Mo04 (с небольшим избытком), то преимущественно образуется сульфосоль молибдена. При последующем подкислении раствора до рН=2,5*3,0 сульфосоль разрушается с выделением трисульфида молибдена:
Na2MoS4 + 2НС1 = MoS3 j + 2NaCl + H2S. (1.17)
Оксосульфосоли разлагаются с выделением оксосульфидов (например, MoSjO и др.). Вместе с трисульфидом молибдена' соосаждается некоюрое количество трисульфида вольфрама. Растворением сульфидного осадка в растворе соды и повторным осаждением трисульфида молибдена получают молибденовый концентрат с содержанием W03 не более 2 % при потере вольфрама 0,3-0,5 % от исходного количества.
После частичного окислительного обжига осадка трисуль - фида молибдена (при 450-500 °С) получают молибденовый химический концентрат с содержанием 50-52 % молибдена.
Недостаток способа осаждения молибдена в составе три- сульфида - выделение сероводорода по реакции (1.17), что требует затрат на обезвреживание газов (используют поглощение H2S в скруббере, орошаемом раствором гидроксида натрия). Выделение трисульфида молибдена ведут из раствора, нагретого до 75-80 С. Операцию проводят в герметичных стальных реакторах, гуммированных или покрытых кислотоупорной эмалью. Осадки трисульфида отделяют от раствора фильтрацией на фильтр-прессе.
Получение вольфрамовой кислоты из растворов вольфрамата натрия
Вольфрамовую кислоту можно непосредственно выделить из раствора вольфрамата натрия соляной или азотной кислотами. Однако этот способ применяют редко вследствие трудностей отмывки осадков от ионов натрия, содержание которых в триоксиде вольфрама лимитировано.
Большей частью первоначально из раствора осаждают вольфрамат кальция, который затем разлагают кислотами. Вольфрамат кальция осаждают, добавляя в нагретый до 80-90 С раствор вольфрамата натрия раствор СаС12 при остаточной щелочности раствора 0,3-0,7 %. При этом выпадает белый мелкокристаллический легко отстаивающийся осадок, в маточном растворе остаются ионы натрия, что обеспечивает низкое их содеражние в вольфрамовой кислоте. Из раствора осаждается 99-99,5 % W, маточные растворы содержат 0,05-0,07 г/л W03. Отмытый водой осадок CaW04 в виде пасты или пульпы поступает на разложение соляной кислотой при нагревании до 90°:
CaW04 + 2НС1 = H2W04i + CaCl2. (1.18)
При разложении поддерживают высокую конечную кислотность пульпы (90-100 г/л НСІ), что обеспечивает отделение вольфрамовой кислоты от примесей соединений фосфора, мышьяка и отчасти молибдена (молибденовая кислота растворяется в соляной кислоте). Осадки вольфрамовой кислоты требуют тщательной отмывки от примесей (особенно от солей кальция
И натрия). В последние годы освоена непрерывная промывка вольфрамовой кислоты в пульсационных колоннах, что существенно упростило операцию.
На одном из предприятий в СССР при переработке растворов вольфрамата натрия вместо соляной кислоты используют азотную кислоту для нейтрализации растворов и разложения осадков CaW04, а осаждение последнего проводят, вводя в растворы Ca(N03)2. В этом случае азотнокислые маточные растворы утилизируют, получая азотнокислые соли, используемые в качестве удобрения.
Очистка технической вольфрамовой кислоты и получение W03
Техническая вольфрамовая кислота, полученная описанным выше способом, содержит 0,2-0,3 % примесей. В результате прокаливания кислоты при 500-600 С получают триоксид вольфрама, пригодный для производства твердых сплавов на основе карбида вольфрама. Однако для производства вольфрама необходим триоксид более высокой чистоты с суммарным содержанием примесей не более 0,05 %.
Общепринят аммиачный способ очистки вольфрамовой кислоты. Она легко растворяется в аммиачной воде, при этом большая часть примесей остается в осадке: кремнезем, гид - роксиды железа и марганца и кальций (в виде CaW04). Однако аммиачные растворы могут содержать примесь молибдена, соли щелочных металлов.
Из аммиачного раствора выделяют, в результате выпаривания и последующего охлаждения, кристаллический осадок ПВА:
Выпаривание
12(NH4)2W04 * (NH4)10H2W12O42 • 4Н20 + 14NH3 +
+ 2Н20. (1.19)
В производственной практике состав ПВА часто записывают в оксидной форме: 5(NH4)20- 12W03- 5Н20, что не отражает химической его природы как соли изополикислоты.
Выпаривание ведут в аппаратах периодического или непрерывного действия, изготовленных из нержавеющей стали. Обычно в кристаллы выделяют 75—80 % вольфрама. Более глубокую кристаллизацию проводить нежелательно во избежание загрязнения кристаллов примесями. Существенно, что большая часть примеси молибдена (70-80 %) остается в маточном растворе. Из маточного раствора, обогащенного примесями, вольфрам осаждают в виде CaW04 или H2W04, возвращаемых на соответствующие стадии производственной схемы.
Кристаллы ПВА отжимают на фильтре, затем на центрифуге, промывают холодной водой и сушат.
Триоксид вольфрама получают термическим разложением вольфрамовой кислоты или ПВА:
H2W04 =» W03 + Н20;
(NH4)10H2W12O42 • 4Н20 = 12W03 + 10NH3 + 10Н20. (1.20)
Прокаливание проводят во вращающихся электропечах с трубой из жаростойкой стали 20Х23Н18. Режим прокаливания зависит от назначения триоксида вольфрама, требуемой величины его частиц. Так, для получения вольфрамовой проволоки марки ВА (см. ниже) ПВА прокаливают при 500-550 °С, проволоки марок ВЧ и ВТ (вольфрам без присадок) - при 800-850 °С.
Вольфрамовую кислоту прокаливают при 750-850 °С. Триоксид вольфрама, полученный из ПВА, имеет более крупные частицы, чем триоксид, полученный из вольфрамовой кислоты. В триоксиде вольфрама, предназначенном для производства вольфрама, содержание W03 должно быть не ниже 99,95 % для производства твердых сплавов - не ниже 99,9 %.
Экстракционный и ионообменный способы переработки растворов вольфрамата натрия
Переработка растворов вольфрамата натрия существенно упрощается при извлечении вольфрама из растворов экстракцией органическим экстрагентом с последующей реэкстрак - цией из органической фазы раствором аммиака с выделением из аммиачного раствора ПВА.
Поскольку в широком интервале рН=7,5+2,0 вольфрам находится в растворах в форме полимерных анионов, для экстракции применяют анионообменные экстрагенты: соли аминов или четвертичных аммониевых оснований. В частности, в промышленной практике используют сернокислую соль триок- тиламина (i?3NH)HS04 (где R - С8Н17). Наиболее высокие показатели экстракции вольфрама наблюдаются при рН=2*4.
Экстракция описывается уравнением:
4(i?3NH)HS04(opr) + Н2\У120*"(водн) + 2Н+(водн)ї=ї
Ї=ї(Д3ГШ)4Н4\У12О40(орг) + 4Н80;(водн). (l.2l)
Амин растворяют в керосине, в который добавляют техническую смесь многоатомных спиртов (С7 - С9) для предотвращения выделения твердой фазы (вследствие малой растворимости солей аминов в керосице). Примерный состав органической фазы: амины 10 %, спирты 15 %, керосин - остальное.
На экстракцию направляются растворы, очищенные от мрлибдена, а также примесей фосфора, мышьяка, кремния и фтора. •
Вольфрам из органической фазы реэкстрагируют аммиачной водой (3-4 % NH3), получая растворы вольфрамата аммония, из которых выпаркой и кристаллизацией выделяют ПВА. Экстракцию проводят в аппаратах типа смеситель-отстойник или в пульсационных колоннах с насадкой.
Преимущества экстракционной переработки растворов вольфрамата натрия очевидны: сокращается число операций технологической схемы, создается возможность осуществления непрерывного процесса получения растворов вольфрамата Аммония из растворов вольфрамата натрия, сокращаются производственные площади.
Сточные воды экстракционного передела могут содержать примесь 80-100 мг/л аминов, а также примеси высших спиртов и керосина. Для очистки от этих экологически вредных примесей применяют методы пенной флотации и адсорбцию на активированном угле.
Экстракционная технология используется на зарубежных предприятиях и реализована также на отечественных заводах.
Применение ионообменных смол - конкурирующее с экстракцией направление схемы переработки растворов вальфрамата натрия. С этой целью применяют низкоосновные аниониты, содержащие аминные группы (чаще третичные аминьі) или амфотерные смолы (амфолиты), содержащие карбоксильные и аминные группы. При рН=2,5+3,5 на смолах сорбируются полианионы вольфрама, причем для некоторых смол полная емкость составляет 1700-1900 мг W03 на 1 г смолы. В случае смолы в 8С>5~-форме сорбция и элюация описываются соответственно уравнениями:
2tf2S04 + H4W12044; 5^«4H4W12O40 + 2SOf; (1.22)
I?4H4WI2O40 + 24NH4OH = 12(NH4)2W04 +4ДОН + 12H20. (l.23)
Ионообменный способ разработан и применен на одном из предприятий СССР. Требуемое время контакта смолы с раствором 8-12 ч. Процесс проводят в каскаде ионообменных колонн со взвешенным слоем смолы в непрерывном режиме. Затрудняющим обстоятельством является частичное выделение на стадии элюирования кристаллов ПВА, что требует их отделения от частиц смолы. В результате элюации получают растворы, содержащие 150-170 г/л W03, поступающие на выпарку и кристаллизацию ПВА.
Недостаток ионообменной технологии по сравнению с экстракционной состоит в неблагоприятной кинетике (длительность контакта 8-12 ч против 5-10 мин при экстракции). Вместе с тем к преимуществам ионитов следует отнести отсутствие сбросных растворов, содержащих органические примеси, а также пожаробезопасность и нетоксичность смол.
Разложение шеелитовых концентратов кислотами
В промышленной практике, преимущественно при переработке высокосортных шеелитовых концентратов (70-75 % W03), применяют непосредственное разложение шеелита соляной кислотой.
Реакция разложения:
CaW04 + 2НС1 = W03H20 + CoCl2 (1.24)
Практически необратима. Однако расход кислоты значительно выше стехиометрически необходимого (250-300 %) вследствие торможения процесса пленками волфрамовой кислоты на частицах шеелита.
Разложение проводят в герметичных реакторах с мешалками, футерованных кислотостойкой эмалью и обогреваемых через паровую рубашку. Процесс ведут при 100-110 С. Длительность разложения варьируют от 4-6 до 12 ч, что зависит от степени измельчения, а также происхождения концентрата (шеелиты различных месторождений отличаются по реакционной способности).
Однократная обработка не всегда приводит к полному вскрытию. В этом случае после растворения вольфрамовой кислоты в аммиачной воде остаток повторно обрабатывают соляной кислотой.
При разложении шеелито-повеллитовых концентратов с содержанием 4-5 % молибдена большая часть молибдена переходит в солянокислый раствор, что объясняется высокой растворимостью молибденовой кислоты в соляной. Так, при 20 С в 270 г/л НС1 растворимости Н2Мо04 и H2W04 равны 182 и 0,03 г/л соответственно. Несмотря на это, полное отделение молибдена не достигается. Осадки вольфрамовой кислоты содержат 0,2-0,3 % молибдена, извлечь который повторной обработкой соляной кислотой невозможно.
Кислотный способ отличается от щелочных способов разложения шеелита меньшим числом операций технологической схемы. Однако при переработке концентратов с относительно невысоким содержанием W03 (50-55 %) при значительном содержании примесей для получения кондиционного параволь - фрамата аммония приходится проводить две-три аммиачных перечистки вольфрамовой кислоты, что неэкономично. Поэтому разложение соляной кислотой большей частью применяют при переработке богатых и чистых шеелитовых концентратов.
Недостатки способа разложения соляной кислотой заключаются в высоком расходе кислоты, большом объеме сбросных растворов хлористого кальция и сложности их утилизации.
В свете задач создания безотходных технологий представляет интерес азотнокислый способ разложения шеелитовых концентратов. В этом случае маточные растворы легко утилизировать, получая азотнокислые соли.