ФТОРСОДЕРЖАЩИЕ МОНОМЕРЫ
Промышленное производство фторсодержащих карбоцепных полимеров основывается на полимеризации мономеров, содержащих двойную связь и различное число атомов фтора. В данной главе кратко описаны физические, химический4 и другие свойства, методы получения основных промышленных' мономеров:’ тетрафторэтилена, трифторхлорзтилена, винилфторида, винилиденфторида, гексафторпропилена. В табл. 1.1 и 1.2 приведены основные физические свойства фтормономеров, а также даны свойства фторсодержащих соединений, которые в последнее время начинают использовать в промышленности в качестве мономеров для получения полимеров.
ТЕТРАФТОРЭТИЛЕН
Тетрафторэтилен (ТФЭ) является основным мономером-для промышленного производства многих фторсодержащих полимеров.
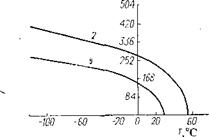
TOC o "1-5" h z В обычных условиях ТФЭ — газ без цвета и запаха. Основные физические константы приведены в табл.1. 1, 1.2.
ТФЭ плохо растворяется в воде. Ниже приведены значения констант растворимости ТФЭ в воде при различных температурах [14]:
Температ5фа, °С . . . . О 10 20 30 40 50 60 70
Константа Генри
Ы0-3, моль/(л • Па) 39,8 29,3 2,38 20,1 17,5 1,55 1,40 1,26
£-103, моль/(л-кгс/см2) 4,06 2,43 1,78 1,43 1,16 -1,01. 0,924 0,879
Примечание. Давление ТФЭ изменялось от 20 до 80 кПа (от 150 до 600 мм рт. ст.).
^-ТФЭ хорошо растворяется в органических растворителях.
•''/Наличие, четырех атомов фтора в молекуле ТФЭ обусловливает его высокую и своеобразную реакционную способность. Фтор-наиболее электроотрицательный элемент. При замещении атомов водорода в этилене на атомы фтора происходит смещение электронной плотности к атомам фтора, двойная связь ослабляется [15, с. 30], и поэтому на раскрытие двойной связи в ТФЭ требуется энергии на 83,74 кДж/моль (20 ккал/моль)
|
Со |
|
Ф Ю |
|
<N |
|
|
|
|
Меньше, чем в этилене, этим и объясняется высокая активность ТФЭ в реакциях полимеризации, а также в реакциях димериза - ции и циклизации с непредельными ®оеднмвниями. /
"“'ТтАБЛИЦА I. 2
|
Давление насыщенных паров и плотность жидких фторсодержащих мономеров при различных температурах
* Рассчитаио по уравнениям, приведенным в работе [1]. ** По данным работы [13]. а* По данным работы [8]. 4* При —81,2 °С. 8* При -55 °С. 6* При -29,4 °С. |
Третичных аминов, тетрагидронафталина, этандиола, бутилмер - каптана, смеси терпена с терпиноленом [16, с. 283].
ТФЭ легко сополимеризуется по радикальному механизму с многими мономерами: вииилиденфторидом, трифторхлорэти- леном, винилфторидом, гексафторпропиленом, винилхлоридом, винилиденхлоридом, этиленом и другими олефинами и диенами, винилацетатом, перфторалкилвиниловыми эфирами, нитрозил - хлоридом, нитрозилфторидом. ТФЭ не сополимеризуется ИЛИ сополимеризуется с трудом со стиролом, трифторстиролом, х акрилонитрилом, акрилатами.
Прочность связи С—Р в. ТФЭ высока [485,67 кДж/моль (116 ккал/моль)] и близка к прочности связи в СР'4 [18], поэтому отщепление атомов фтора от ТФЭ. происходит лишь под действием таких активных реагентов, как металлический натрий, алкоголяты и металлорганическне соединения.
Пиролиз ТФЭ приводит к получению гексафторпропилена, октафторциклобутана, перфторизобутилена и др.
В лабораторных условиях ТФЭ получают пиролизом политетрафторэтилена при 0,67 кПа (5 мм рт. ст.) и 500—700°С (выход 97%) [19, с. 142—144] или декарбоксилированием солей перфторпропионовой или трифторуксусной кислот (в смеси с ЫаОН) при 250—300°С (выход 90 и 32% соответственно) [16, с. 281].
ТФЭ в промышленности получают пиролизом дифторхлор-’ метана. Последний получают фторированием хлороформа фтористым водородом при повышенных температуре и давлении в присутствии фторхлоридов сурьмы.
Пиролиз дифторхлорметана ведут при 650—800 °С и атмосферном давлении в трубах из платины, серебра или сплавов, устойчивых к продуктам пиролиза дифторхлорметана [16, с. 283].
Пиролиз дифторхлорметана описывается реакцией:
2СНР2С1 —► С2Р4 + 2НС1
В результате внутримолекулярного отщепления хлористого водорода образуется бирадикал :СР2, который сразу же диме - ризуется в ТФЭ. Распад дифторхлорметана является гомогенной- реакцией первого порядка, константа скорости (в с-1) выра* жается уравнением [20]: К = 1,8-103 е_27670/т.
В качестве побочных продуктов образуются цикло-С^а, №01, С2НР3, ЩСЬЬа (п — 2 — 7), а также в небольших количествах другие фторорганические соединения.
Для получения высокого выхода тетрафторэтилена (выше 85%) степень превращения дифторхлорметана не должна превышать 40—50%; большое значение имеет также конструкция печи пиролиза. Необходимо выбирать оптимальное соотношение длины и диаметра печи, а также время пребывания з печи исходных к получающихся продуктов.
Для получения высокомолекулярного политетрафторэтиле - на ТФЭ необходимо тщательно очистить ректификацией, особенно от непредельных водородсодержащих примесей [21].
ТРИФТОРХЛОРЭТИЛЕН
Трифторхлорэтилен (ТФХЭ) при обычной температуре и атмосферном ' давлении представляет собой бесцветный газ. Основные физические константы приведены в табл. 1.1, 1.2.
По химическим свойствам ТФХЭ близок к ТФЭ. Реакции присоединения по двойной связи значительно легче протекают по радикальному механизму, чем по полярному. ТФХЭ легко реагирует с кислородом, галогенидами, галогенводородами, спиртами, аминами [16, с. 284—289].
ТФХЭ сополимеризуется по радикальному механизму с тетрафторэтиленом, трифторэтиленом, винилиденфторидом, ви- нилфторидом и вииилхлоридом, винилиденхлоридом, этиленом, стиролом, изобутиленом и др.
ТФХЭ взаимодействует с кислородом, причем реакция ускоряется в присутствии воды и при наличии жидкого ТФХЭ [18]:
Ср2=срс1 + о2 -------- >- | + зда + не!
Большинство известных методов получения ТФХЭ основываются на использовании в качестве исходного сырья трифтор- трихлорэтана СР2С1—СРС12, который' получают либо воздействием смеси хлора и фтористого водорода на перхлорэтилен при 300—500 °С в присутствии катализаторов, например СгРз, АШз [22], либо фторированием гексахлорэтана фтористым водородом при повышенных температурах и давлении на фторхлори - дах сурьмы [16, с. 280, 281; 23], либо обработкой смесью хлора и фтористого водорода этилена, ацетилена и этана при 400—500°С на галогенидах или окислах металлов [24].
Отщепление хлора от СРгС1—СРС1г может быть осуществлено цинком в полярных растворителях (вода, спирты), водородом над катализаторами (медь, кобальт, серебро, платина).
Реакция взаимодействия СР2С1—СРС12 с водородом даже на лучших катализаторах дает невысокий выход ТФХЭ. Недостатком является образование таких примесей, как СНг=Ср2, СНР=СРг, СНРС1—СРгС1, многие из которых трудно отделить от ТФХЭ и ухудшают качество полимеров [25].
В промышленных способах используется реакция дехлорирования СР2С1—СРС12 цинком в метиловом или этиловом спирте, а также в воде. Применение поверхностно-активных веществ (ПАВ) позволяет осуществлять реакцию в воде до высокой степени превращения (более 90%) [26]. В качестве
Примесей образуются СР2С1—СНРС1, СНС1=СР2, СНР=СР2, СН2=СР2, СР2С1—СР2С1. Для получения полимера с хорошими свойствами ТФХЭ должен быть очищен высокоэффективной ректификацией.
Известны пиролитические методы получения ТФХЭ из СНР2—СРС12, смеси СНР2С1 и СНРз или СНРС12 и СНР2С1 [27]. Однако эти методы не нашли применения в промышленности из-за протекания побочных реакций, что снижает выход ТФХЭ и осложняет получение чистого мономера.
ВИНИЛФТОРИД
|
5 ■ р ,г/см! |
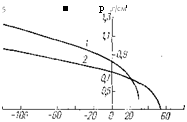 Винилфторид (ВФ) при обычной температуре и атмосферном давлении — бесцветный газ со специфическим запахом.
Винилфторид (ВФ) при обычной температуре и атмосферном давлении — бесцветный газ со специфическим запахом.
|
А цдж/г
|
Зависимость теплоты испарения (а) и плотности (б) жидких ВФ (!) и ВДФ (2) от температуры.
Основные физические свойства ВФ представлены в табл. 1.1 — I. 3 и на рисунке.
Ниже приведена растворимость ВФ в воде [28]:
|
|||
|
|||
|
|||
|
|
||
|
|||
При 15,6°С и 2,2 МПа (22 кгс/см2) винилфторид с водой образует гидрат.
Реакционная способность ВФ значительно ниже, чем у ТФЭ и ТФХЭ. Это объясняется тем, что, с одной стороны, прочность связи С—Р в ВФ достаточно высока, с другой стороны, наличие атомов фтора только у одного атома углерода в меньшей степени, чем это наблюдается для ТФЭ, способствует переходу л-эле - ктропов в триплетиое состояние и несколько снижает реакционную способность в радикальных реакциях.
|
ТАБЛИЦА I. 3 Влияние температурь! на свойства Вф и ВДФ
|
|
П р, и м е ч а н и е. Поверхностное натяжение приведено для жидких ВФ и ВДФ; вязкость и теплоемкость в числителе даны для газообразных, а в знаменателе для жидких ВФ и ВДФ. |
Ниже приведены длина и прочность связи С—Р в некоторых фторорганических соединениях [15, с. 30]:
Длина связи, Прочность сйязи,
Нм кДж/моль (ккал/моль)
СНз И 0,1390 (1,39) 447,99 (107)
СР4 0,1320 (1,32) 506,60 (121)
TOC o "1-5" h z СН2=СНР 0,1348 (1,348) -
СН2=СР2 0,1323 (1,323) -
СР2=СР2 0,131 (1,31) 485,67 (116)
Заряды (ст• 103 электростат, ед.) в молекуле ВФ распределяются следующим образом [29]:
+42 -182
Н /Р
%С==ьС н/-ш +211н
+36 +5
Неравномерное распределение зарядов у С = С-связи в ВФ способствует протеканию реакций по ионному механизму. Если для ТФЭ и ТФХЭ полимеризация с ионными катализаторами нехарактерна, то для ВФ она достаточно легко осуществима. Присоединение брома к ВФ протекает по полярному механизму, присоединение галогенводородов подчиняется правилу Марковникова и протекает с большой скоростью над хлоридами 7п, Ре, А1, а фтористого водорода в присутствии Н&ОзР. ВФ сополимеризируется с многими мономерами (тетрафтор - этиленом, винилиденфторидом, гексафторпропиленом и другими галогенолефинами, этиленом, пропиленом, изобутиленом, винил - ацетатом, стиролом и др.) [6].
Одним из основных промышленных способов получения ВФ является газофазное гидрофторирование ацетилена. Катализаторы для этого способа получают на основе у-А1203, А1Р3 и солей ртути. По данным [30] наибольшей активностью и устойчивостью обладают катализаторы, полученные обработкой у-А1203 фтористым водородом. Гидрофторирование рекомендуется проводить при температуре около 300°С. Показано, что реакция присоединения НР к ацетилену с получением ВФ необратима вплоть до 300—320°С, а реакция присоединения НР с образованием 1,1-дифторзтана обратима при температуре выше 220—250 °С.
При использовании катализатора, состоящего из смеси 90% ■ ■у-АЬОз и 10% Сё (ВР4)2, обработанной фтористым водородом, при 300—340°С выход ВФ составляет 90—93% [31]. Описан способ получения ВФ над А1Р3 при 250—400°С с конверсией С2Н2 и выходом СНгСНР около 90% [32].
Гидрофторирование ацетилена в присутствии солей ртути проводится при более низкой температуре (100—150°С), выход, как правило, составляет 60—80% [33]. Процесс существенно улучшается при использовании специальной аппаратуры [34]. Превращение ацетилена в СН2=СНР доведено до
97—99%, а срок службы катализатора увеличен до 2100 ч. Разработаны методы получения ВФ из 1,1-дифторэтана (ДФЭ) [35], который образуется при гидрофторировании ацетилена или винилхлорида. По одному варианту ДФЭ смешивают с ацетиленом, пропускают над катализатором при 200—400 °С и получают ВФ, по другому — ДФЭ подвергают дегидрофторированию при 250—300°С в присутствии катализаторов.
Следующий метод основан на получении 1,1-фторхлорэтана из винилхлорида и фтористого водорода. Гидрофторирование ведут при 0—15 °С в присутствии олеума или фторсульфоновой кислоты; 1,1-днфторэтан подвергают пиролизу при 500—700°С и времени контакта (продолжительность пребывания в печи) 2—30 с [36].
Для получения полимеров ВФ должен быть очищен от примесей и особенно от ацетилена. От большинства примесей удается избавиться ректификацией. Для глубокой очистки ВФ от ацетилена предложены следующие методы: гидрирование ацетилена [35], обработка селективным растворителем (диметилформ - амидом, диметилсульфоксидом и др.) [37], дистилляция с добавлением С02 или СНР3 [38], а также обработка растворами солей меди или ртути [39].'
__ ^ ВИНИЛИДЕНФТОРИД
1 Винилиденфторид (ВДФ) при обычной температуре и атмосферном давлении — бесцветный газ без запаха. Основные физические константы ВДФ приведены в табл. 1.1—1.3 и на рисунке.
Реакционная способность ВДФ ниже, чем у ТФХЭ и ТФЭ. ВДФ на воздухе не окисляется, но легко бромируется и достаточно легко сополимеризируется с этиленом, трифторхлорэти - леном, тетрафторэтиленом, гексафторпропиленом, винилфтори - дом, перфторалкилвиниловыми эфирами и др. [16, с. 279, 280]. Гомополимеризация ВДФ протекает значительно труднее, чем ТФЭ.
ВДФ проявляет как нуклеофильную, так и электрофильную реакционную способность [40]. Ряд сравнительной активности фторолефинов в ионных реакциях выглядит следующим образом:
Электрофильиая реакционная способность
Сн2=сн2 СН2=СНР СН2=СР2 СНР=СР2 СР2=СР2 СР2=СРСР3 СР2=С(СРз)2
Нуклеофильная реакционная способность
Эти данные хорошо совпадают с результатами измерения химических сдвигов 13С фторэтиленов (табл. 1.4): атом углерода слабее экранирован в СР2 и сильнее СН2-группе ВДФ.
Основным методом получения ВДФ является пиролиз
1, 1,1-дифторхлорэтана. Показано [41], что при 600—700°С в
|
ТАБЛИЦА I. 4 Химические сдвиги |3С фторэтиленов относительно этилена (в м. д.)
|
Трубчатом реакторе из сплава хрома и никеля распад СНз—СР2С1 протекает одновременно с отщеплением хлористого водорода и получением ВДФ. Эта реакция практически необратима. Пиролиз СН3—СР2С1 протекает с высоким выходом (90%) ■^при почтя полной конверсии СН3—СРгС1.
В результате отщепления фтористого водорода попутно образуется «СН2 = СРС1 (1—2%). Реакция распада СНзСРгС! описывается уравнением:
К — 2,53 • 1012е 26821 'Г
Для получения СН3СР2С1 используют реакцию взаимодействия винилиденхлорида с фтористым водородом в присутствии ЭпСЦ при повышенных температуре и давлении. Другим методом получения СНзСРгО служит реакция хлорирования 1,1-ди - фторэтана, получаемого из ацетилена и фтористого водорода. Описаны методы прямого получения ВДФ из 1,1-Дифторэтана воздействием хлора при высоких температурах [42]. Известны другие методы получения ВДФ [43]: каталитическое разложение СНз—СР3 при повышенных температурах; газофазное фторирование винилиденхлорида фтористым водородом при 250— 350°С над солями А1 или Сг.
Особого внимания заслуживает последний метод в связи с его простотой и высокой селективностью.
ГЕКСАФТОРПРОПИЛЕМ
Гексафторпропилен (ГФП) при обычной температуре и атмосферном давлении — бесцветный газ без запаха. Основные физические константы приведены в табл. I. 1, 1.2.
ГФП вступает в различные реакции присоединения, свойственные олефинам. К нему могут быть присоединены На, С12, Вг2, НР, НС1, НВг [44]. В присутствии щелочей спирты и меркаптаны легко реагируют с ГФП с образованием моногидро - перфторпропилалкиловых эфиров и аналогичных аддуктов присоединения меркаптанов, причем в отличие, от реакций с пропиленом в этих реакциях водород присоединяется к центральному атому углерода [45]. Показано, что атомы фтора Сг3-группы ГФП, в противоположность перфторалкилам, обладают значительной подвижностью. Линейные димеры и тримеры могут быть получены каталитическим воздействием на ГФП галоге - нидов щелочных металлов или тетра (N, А^диметиламино)этилена в диметилацетамиде [46]. Циклические димеры были получены при нагревании ГФП при 254 °С при аутогенном давлении ГФП [47]. При нагревании ГФП до 600 °С он разлагается, образуя CF3CF2CF = CF2 и (CF3)2C = CF2 [48]. Окислением ГФП кислородом или перекисью водорода может быть получена окись ГФП, ценное сырье для синтеза перфтор (алкоксиви - ниловых) эфиров [49]. В жестких условиях окисление идет до COF2 и CF3COF.
ГФП не склонен к самопроизвольной гомополимеризации и в отличие от ТФЭ не представляет особой опасности при хранении и транспортировании. ГФП сополимеризуется с ВДФ, ВФ, ТФЭ и смесью ТФЭ и этилена. Химические свойства ГФП и других фторолефинов обобщены в работах [50].
Основным способом получения ГФП является пиролиз ТФЭ, который осуществляется при 700—900°С в трубках из хромоникелевых сплавов. На первой стадии из ТФЭ образуется пер - фторциклобутан C4F8 по гомогенной реакции второго порядка с константой скорости /( — 16,5-10'° е~13234/,т. Реакция начинается уже при 300°С [51]. Образование ГФП идет по реакциям:
C4F8 —* C3F6 + :CP2; :CF2 + C2F4 —> C3F6
Распад C4F8 является реакцией первого порядка с константой К = 3,9-]016е-39753/т [52]. При feMnepaType свыше 600°С ГФП образует высокотоксичное соединение — перфторизобути - лен по реакции полуторного порядка. Скорость распада ГФП выражается уравнением:
DCc^Jdt^,5Cl6lV6-3A-lOl(>e-^10'T
Недостатком метода получения ГФП пиролизом ТФЭ является образование большого количества побочных продуктов, таких, как C4F8, C2F6, CF2=CFCF2CF3, (CF3)2C = CF2,
CF3C = CCF3, твердые полимеры и др. Для повышения выхода ГФП предложен ряд приемов по проведению пиролиза ТФЭ.
Пиролиз при пониженном давлении [около 13,3 кПа (100 мм рт. ст.)] и 750—850°С приводит к увеличению выхода ГФП до 81,5% при степени превращения ТФЭ 55,8% [53]. Пиролиз СМеСИ ТФЭ И ВЫСШИХ фторугЛерОДОВ CnF2n+2’ Cn+3F2(n+3), Cn+3F2(n+2), где «==1 — 10, дает выход ГФП около 100% при степени превращения ТФЭ близкой к 20% и 98% — при степени превращения 33,3% [54]. Температура пиролиза 700—900 °С, давление 1,35—437,6 кПа (0,0136—4,42 кгс/см2).
Время контакта 5 с, мольное отношение ТФЭ и высших фтор - углеродов 1 : 0,05.
Предложен пиролиз ТФЭ и С4р8 или их смеси в адиабатических условиях в присутствии избытка перегретых водяных паров при 700—900 °С, продолжительности контакта 0,48 с и степени превращения 50,5% [55]. Для предотвращения полимеризации к ТФЭ добавляют 3—10% CHF2З1 или CHF3, в результате образуются НС1 и HF — ингибиторы полимеризации [56]. Аналогичное действие оказывает введение НС1 и HF в зону охлаждения продуктов пиролиза при температуре реакционных газов не ниже 500 °С. При температуре пиролиза 780 °С и степени превращения ТФЭ 75,6% суммарный выход ГФП и C4F8 составляет 92,2%. Пиролиз ТФЭ в отсутствие НС1 или HF приводит к получению пиролизата, содержащего 0,188% полимера, и снижению выхода до 88,3%. Введение НС1 или HF в сочетании с разбавлением ТФЭ двуокисью углерода позволяет снизить токсичность продуктов пиролиза и увеличить выход ГФП до 90,2% при степени превращения ТФЭ 68,3%. Пиролиз осуществляется в трубках из сплава инконель при 700—900°С, давлении 69,3—198 кПа (0,75—2,0 кгс/см2), продолжительности времени контакта 1 с, отношении ТФЭ:СОг от 1:1 до 25:1.
ГФП может быть получен при пиролизе ПТФЭ [57], а также декарбоксилированием при 400—650 °С CF3CF2CF2COOH [58]. Описаны методы получения ГФП пиролизом CF3CHCICF3, CHF3, CF2CI2 [59], сопиролизом CHF2CI с CF3CHFCI и CF2 = CFC1 с CHFs [60].
Для получения сополимеров ГФП должен быть тщательно очищен, особенно если он используется для синтеза перфорированных полимеров. В целях безопасности ГФП прежде всего освобождают от высокотоксичного перфторизобутилена, используя его высокую реакционную способность [50], например, окисляя водным или ацетоновым раствором КМп04. Отделение от остальных примесей, как правило, производится ректификацией. Очистка от водородсодержащих непредельных примесей, которые, как и в случае полимеризации ТФЭ, имеют наибольшее влияние на качество полимера, может осуществляться
Экстрактивной ректификацией с полярными растворителями, обработкой серной или фторсульфоновой кислотами или другими химическими реагентами [19].