ХЛОРОФИЛЛ И ДРУГИЕ ПИГМЕНТЫ
Во всех фотосинтезирующих клетках, за исключением фото- синтезирующих бактерий, фигурирует хлорофилл а (Chi а). В бактериях вместо Chi а наличествует бактериохлорофилл
Сн.
НС
Л І, ІЩ—
}-N4 N=/
¥-
CzHs
■v*
/II I \
\>
Ч/ww ■/ і /
Н, с °-c\
■OCH,
\
H, C -
-CH,
\ 1 /
У—NH
MU UM
C=o
<
HC/CHz II
НгСхСН2 CHj
^:сн-снг нгсх
І—NH HN—v
I 0 0 I
CH,
C, H,
'Z"5
6)
H2CX
CH—CH3
Снг
Н2 ccT' >H
A)
HjC CHj
/\ CH, H5C H H
H H.
H H
.H H.
C=c' Nc=c; \ / \
H H3C
H H H H4
CHjH
CH3 H, OCH
H3C CH, H \ / 3
H H
SJ
Рис. 7.3. Структурные формулы некоторых пигментов. Л—хлорофилл а. В хлорофилле Ь обведенная кружком группа СН3 заменена на —НС=0; Б—fi-каротин; В—фикоэритробилии.
В Chi. Chi а имеет сине-зеленую окраску. Менее универсально, хотя и обычно, присутствие хлорофилла b (Chi b). В литературе
Описаны и другие хлорофиллы, содержащиеся в разных типах водорослей. Строение Chi а и СЫЬ показано на рис. 7.3, Л. В основе структуры находится порфириновое кольцо, ответственное за поглощение света в видимой области спектра. В центре кольца расположен атом Mg. Заметим попутно, что порфириновые циклы в комплексах с другими атомами фигурируют б ряде
Важнейших для биологии веществ—б геме (атом Fe), в гемоцианинах (атом Си) и др. [12].
Наряду с хлорофиллами в фотосинтетических системах растений присутствуют другие окрашенные вещества, пигменты, играющие вспомогательную роль. Общим правилом является наличие каротиноидов (рис. 7.3,Б). В красных водорослях (Rhodophycae), в сине-зеленых водорослях (Суапо - phycae) присутствуют фикобилины (вещества, родственные желчным пигментам), содержащие разомкнутое порфириновое кольцо (рис. 7.3, В). В табл. 7.1 [1] приведены спектральные характеристики хлорофиллов и других пигментов, участвующих в фотосинтезе.
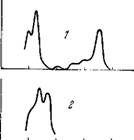
На рис. 7.4 показаны полосы поглощения Chi а, каротиноида, фико - эритрина и фикоцианина [1]. -
Основная проблема химии и физики фотосинтеза состоит в раскрытии механизма преобразования энергии света в химическую энергию, запасаемую в синтезируемых органических соединениях. Хлорофилл — вещество, определяющее фотосинтез; энергия света, им поглощенная, используется для фотосинтеза. Очевидно, что исследования указанной проблемы целесообразно начинать с простых фотохимических реакций с участием хлорофилла. Именно это направление начали с 1948 г. развивать Красновский и его сотрудники (см. [10, И]).
Реакция Красновского, открытая в 1948 г. [13], состоит в обратимом фотовосстановлении хлорофилла

4000 ШО ВООО 7000 Длит волны, А
Рис. 7.4. Полосы поглощения хлорофилла а (/), каротиноида (2), фикоэритри - на (3) и фикоцианина (4).
По оси оРдниат—оптическая плотность.
О
Chi + АН СЬГ + АН+.
Тем самым, световая энергия трансформируется in vitro в химическую при участии хлорофилла. Восстановителем, т. е. донором электрона в этих опытах служил аскорбат. Восстановленный
Таблица 7.1 Спектральные характеристики растительных пигментов
|
Максимумы поглощения, А |
Растения, содержащие пигмент |
|
|
Тип пигмента |
В органических растворителях |
В клетках |
I. Хлорофиллы Chi о
Chi b Chic Chid
Бактериовиридин
В Chi о В Chi b
II. Каротиноиды
На. Каротины а-каротин
Р-каротин
Y-каротин
Иб. Каротинолы (ксантофиллы)
Лютеол
Виолоксантол Фукоксантол
Спириллоксантол
4200, 6600
4530, 6430 4450, 6250 4500, 6900
Две формы:
4250, 6500
4320, 6600 3650, 6050, 7700
3680, 5820, 7950
В гексане 4200, 4400, 4700
В гексане 4250, 4500, 4800
В гексане 4400, 4600, 4950
В этаноле 4250, 4450, 4750
В этаноле 4250,
4500, 4750 В гексане 4250, 4500, 4750
В гексане 4640, 4900, 5240
4350, 6700- 6800 (несколько форм) 4800, 6500
Полоса 6450
Полоса 7400
Полосы 7500
Или 7600 Полосы 8000,
8500, 8900 Полоса 10 170
Все фотосинтезирую - щие растения кроме бактерий
Высшие растения и зеленые водоросли Диатомеи и бурые водоросли Некоторые красные водоросли
Зеленые бактерии
Пурпурные и зеленые
Бактерии Штамм пурпурных бактерий Rhodop - seudomonas
Многие листья и водоросли. Главный каротин в красных водорослях и в группе зеленых водорослей
Главный каротин во всех других растениях
Главный каротин в зеленых серных бактериях
Главный в зеленых и красных водорослях
Второй важнейший ка - ротинол листьев
Главный в диатомеях и бурых водорослях
Пурпурные бактерии
Таблица 7.1 (продолжение)
|
Максимумы поглощения, А |
Растения, содержащие пнгмеит |
||
|
Тип пигмента |
В органических растворителях |
В клетках |
|
|
III. Фикобилины Фикоэритрин Фикоцианины Аллофикоцианины |
В Н20 и in vivo 4900, 5460, 5760 В Н20 и in Vivo 6180 В фосфатном буфере, рН 6,5 6540 |
Главные в красных водорослях Главные в сине-зеленых водорослях Красные и сине-зеле - иые водоросли |
Хлорофилл может быть окислен вновь. По-видимому, возбужденные светом молекулы хлорофилла восстанавливаются in vivo за счет воды. Таким образом, главный пигмент растительных клеток— хлорофилл — непосредственно участвует в окислительно-
Восстановительных реакциях
т* при освещении. К этим реак-
S?- S*'
Хлорофилла
S
Х / циям относится и обратимое
Фотохимия фотоокисление
Ферри-ионом [14]:
Рис. 7.5. Схема электронных уровней хлорофилла по Красновскому [11].
Chi + Fe+++ Chi"1" + Fe"1 Каков же механизм реакции
Красновского?
На основании исследований спектров поглощения и флуоресценции хлорофилла и его аналогов можно считать, что электронные уровни хлорофилла расположены так, как показано на рис. 7.5. В темноте молекула находится на нижнем синглетном электронном уровне S0. Полосы поглощения Chi соответствуют переходам S0->5* (в красной области) и S0—>5* (в синей области спектра). Обратный переход S*->S*— безызлучательный (показан волнистой стрелкой); флуоресценция соответствует переходу S* —> So. С уровня S* возможен безызлучательный переход в триплегное состояние Т, являющееся метастабильным. При поглощении света в этом состоянии Chi переходит в возбужденное триплетное состояние Т*. Об образовании метастабильного триплетного состояния хлорофилла свидетельствует фосфоресценция его замороженных растворов [15]. Схема рис. 7.5 дана в упрощенном виде, на ней не указаны колебательные уровни.
Теренин рассмотрел роль триплетных состояний в фотохимии красителей (пигментов) [16]. В этих состояниях молекула находится в неустойчивой активной конфигурации, несущей большую часть поглощенной энергии светового кванта. Такие молекулы способны эффективно участвовать в химических превращениях и в процессах миграции энергии. Роль триплетных состояний определяется большой длительностью их жизни и химической не - иасыщенностью вследствие наличия неспаренных электронов.
Соответственно, обратимое фотовосстановление хлорофилла можно представить схемой
СЫ + Й(о->СЫ*-^ - Chi • •Chi • +АН - СЬГ+ • АН+.
Точка изображает неспаренный электрон, по-видимому, делока- лизованный в системе сопряженных связей порфиринового цикла. Красновский и его сотрудники доказали методом ЭПР, что при фотовосстановлении хлорофилла возникают свободные радикалы [11, 17—20].
Как уже сказано, хлорофилл подвергается и фотоокислению, в частности, кислородом при интенсивном освещении растворов Chi на воздухе. Эти явления также были детально изучены в работах Красновского и его школы [11, 21—25].
Таким образом, хлорофилл, будучи возбужден светом, может играть роль и донора, и акцептора электрона.
ЙСй
I
—е —е
Донор <=± Chi Акцептор —е —е
Сказанное относится и к ряду других порфириновых соединений— аналогов хлорофилла.
Спектр поглощения Chi a in vivo характеризуется сложным характером его красной полосы поглощения [26]. Это заставляет думать о наличии нескольких форм хлорофилла. Жизнь растения несомненно связана с химическими превращениями хлорофилла, биосинтез которого является важной особенностью фото - синтезирующих клеток (см. [27]). Красная полоса поглощения смещается, когда листья живого растения, выросшие в темноте, постепенно зеленеют на свету. Наличие нескольких форм хлорофилла доказывается тем, что во время постепенной его экстракции из листьев спектр поглощения меняется [28]. Различные формы, возможно, связаны с разными типами специфической агрегации молекул хлорофилла,
Энергия света, поглощенного хлорофиллом и другими пигментами, как уже сказано, может запасаться, переноситься от молекулы одного пигмента к молекуле другого, мигрировать между тождественными молекулами, излучаться в актах флуоресценции и фосфоресценции и рассеиваться, превращаясь в тепло. Проблемы, связанные с этими явлениями, рассматриваются далее. Во всех случаях первичный акт фотохимического процесса состоит в поглощении света. Эффективность использования энергии световых квантов, поглощенных вспомогательными пигментами, варьирует от 20 до 100% эффективности использования энергии, поглощенной Chi а. По-видимому, одна из функций вспомогательных пигментов состоит в снабжении хлорофилла а поглощенной энергией.
Количественное исследование фотохимического процесса требует прежде всего изучения спектра действия света, т. е. зависимости скорости продукции кислорода Р от числа поглощенных квантов 1а и длины волны X. Спектром действия называется функция
P/!a = f(V - (7-2)
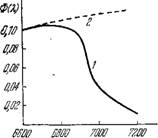
Если Р — число молекул 02, продуцируемых В 1 С, 1а — число квантов, поглощаемых в 1 с, то f(K) означает квантовый выход фотосинтеза, обозначаемый Ф(А). На рис. 7.6 показан график функции Ф(А,) для хлореллы [29]. Снижение квантового выхода в области 4500—5000 А, соответствующей поглощению света каротиноидами, заставляет думать, что эти вещества являются относительно слабыми сенсибилизаторами фотосинтеза. Напротив, в области поглощения света фикобилинами такого падения Ф(А) нет и, следовательно, фикобилины имеют такую же эффективность, как и Chi а. Из анализа спектров действия следует, что эффективность каротиноидов меняется от 20 до 50% эффективности Chi а, эффективность фикоэритрина — от 60 до 100%.

Длина волны, А
Рис. 7.6. Спектр действия (квантовый выход) фотосинтеза для хлореллы.
Абсолютное значение максимального квантового выхода характеризует число квантов, необходимых для выделения одной молекулы 02. Пользуясь методом дифференциальной маномет - рии, Эмерсон и Чалмерс [30] определяли порознь выделение 02 и поглощение С02 при фотосинтезе. Это было осуществлено также другими методами. Количественные данные показывают, что число квантов, поглощаемых при выделении одной молекулы кислорода, равно 8 (см. [1]). Отсюда следует, что для переноса каждого атома водорода от Н20 к С02 нужно два кванта.
По другим данным число квантов, приходящихся на молекулу Ог варьирует от 8 до 12.
Характерной особенностью кривых Ф(А) является резкое падение квантового выхода в длинноволновой, красной, области спектра («красное падение»). Оно наблюдается вблизи 6800 А в зеленых водорослях и вблизи 6500 А — в красных. Сходный эффект обнаруживается в спектре действия реакции Хилла [1]. Как мы увидим, объяснение красного падения не тривиально. Chi а поглощает свет в этой области. Соответственно возникает вопрос, отвечает ли красная полоса поглощения Chi а одному или нескольким электронным переходам. Если справедливо второе, то одни переходы могут быть эффективными, другие — неэффективными при фотосинтезе.
В работах лабораторий Красновского (см. [11, 31]) и Ливннг- стона [32] было показано, что хлорофилл частично агрегирует в неполярных растворителях, вероятно, образуя димеры. Применение современных методов исследования — электронографии [33], инфракрасной спектроскопии и спектроскопии ЯМР к изучению агрегации пигментов позволило обосновать представление о том, что в димере образуется координационная связь карбонильной группы одной молекулы Chi с центральным атомом Mg другой молекулы [34]. Агрегированные формы Chi а и других пигментов получены в модельных системах — в концентрированных растворах, монослоях и пленках [35]. В модельных системах наблюдаются спектры поглощения и люминесценции, сходные с таковыми in vivo. Установлено, что обратимые окислительно-восстановительные фотореакции свойственны как мономерным, так и агрегированным формам (см. [11]).
Как уже указывалось, в растениях наблюдается ряд «спектральных форм» хлорофилла, в частности, Chi а. Среди них имеются и агрегированные. В работах Литвина и сотрудников [35, 36] установлено, что в различных фотосинтезирующих организмах фигурирует один и тот же набор форм хлорофилла. Число таких форм велико, для Chi а оно более 10.
Допустим, что длинноволновая часть полосы поглощения принадлежит димерам, Chl2, в которых происходит более быстрая конверсия энергии электронного возбуждения в колебательную энергию. В этом случае димер Chl2 малоэффективен в фотосинтезе, и красное падение объясняется. Другое объяснение состоит в том, что Chi a in vivo фигурирует в нескольких формах, разнящихся положением полос поглощения, а также фотохимической эффективностью и выходом флуоресценции. Действительно, как показано на рис. 7.6, красная полоса Chi а состоит из двух компонентов примерно равной интенсивности, 6700 и 6800 А. Имеются указания на наличие третьего слабого компонента у 6950 А.
Ряд дополнительных фактов показывает, однако, что красное падение требует более сложного объяснения. Здесь очень важен эффект Эмерсона, состоящий в том, что свет, неэффективный в далекой красной области, станов. ітся полностью эффективным при одновременном освещении более коротковолновым излучением, например при комбинированном воздействии светом с X 7000 и 6500 А [37]. Эффект Эмерсона показан на рис. 7.7. Действие двойного облучения неаддитивно, выделение 02 существенно больше суммарного эффекта при освещении двумя типами излучения, примененными порознь. Количественно эффект Эмерсона характеризуется величиной
Д02 (комбинированное — Д02 (коротковолновое
освещение) освещение) и п\
Длина волны, А
Рис. 7.7. Эффект Эмерсона
В хлорелле. 1 — график Ф (Л) при длинноволновом освещении, 2— график Ф (Л) при добавочном коротковолновом освещении.
6 Д02 (длинноволновое освещение) ' \ • /
Где ДОг — скорость выделения кислорода. Спектр действия эффекта, т. е. зависимость g от длины волны добавочного коротковолнового света, показывает, что є особенно велико, когда большая часть этого света поглощается одним из вспомогательных пигментов — Chi b в зеленых водорослях, Chi с или фикоксантолом в диато - меях и фикобилином в красных и сине-зеленых водорослях. Отсюда следует, что для полной эффективности фотосинтеза нужно поглощение одного кванта хлорофиллом а и другого — одним из вспомогательных пигментов. Красное падение происходит в области, в которой свет поглощается только Chi а.
В красных водорослях падение квантового выхода происходит при сравнительно малой длине волны 6500 А. Это наглядно объясняется предполагаемым поглощением двух квантов. Красные водоросли не содержат Chi b и область поглощения Chi а простирается в них примерно до 6500 А, при более длинных волнах становится заметным поглощение света фикоцианином.
Однако предложенная интерпретация не свободна от неясностей. Фикобилин сенсибилизирует флуоресценцию Chi а в красных водорослях. Иными словами, кванты, поглощаемые вспомогательными пигментами, переносятся на Chi а. Перенос является количественным. Остается непонятым, каким образом те же кванты могут нести иную фотохимическую функцию.
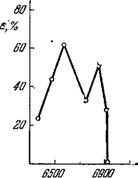
Более детальное исследование эффекта Эмерсона показало, что наряду с максимумами є (Л), соответствующими вспомогательным пигментам, в полосе поглощения Chi а имеется максимум при 6800 А (рис. 7.8) [38]. Этот результат показал, что эффект Эмерсона определяется поглощением одного кванта одной формой хлорофилла а и второго кванта — другой его формой. Максимумы на кривой спектра действия связаны не с поглощением вспомогательных пигментов, но с резонансным переносом энергии возбуждения с этих пигментов на активную форму Chi а.
Из изложенных фактов следует гипотеза о двух фотохимических системах, действующих в фотосинтезе — ФС / и ФС II [1, 39]. Система II флуоресцирует сильно, система / — слабо. В зеленых растениях ФС II содержит хлорофилл а с максимумами поглощения 6700 и 6800 А, но не 6950 А. ФС / содержит все эти три формы Chi а. Кванты, поглощенные Chi а 6700 и Chi а 6800, переносятся в ФС / на Chi а 6950 и энергия их дис- сипирует, чем и объясняется низкий выход флуоресценции. Появление пика при 6700 А на кривой є (А) объясняется тем, что ФС II содержит большую долю Chi а 6700, чем ФС I.
Если две фотохимические системы сенсибилизируют две последовательные фотохимические реакции, то они должны действовать с одинаковой скоростью. Свет поглощается одновременно в обеих системах, но в неодинаковой степени. При К > 6500 А в красных водорослях и при X > 6800 А в зеленых водорослях система / получает избыточную, а система II недостаточную энергию, чем и объясняется красное падение. Нарушается баланс, необходимый для совместной работы двух систем. Баланс этот улучшается при одновременном освещении более коротковолновым светом [1].
§ 7.3. ДВЕ ФОТОХИМИЧЕСКИЕ СИСТЕМЫ
Длина волны, А
Рис. 7.8. Спектр действия эффекта Эмерсона для хлореллы.
Если световые реакции, сенсибилизированные двумя фотохимическими системами, происходят последовательно, то можно определить спектр поглощения каждой системы, измерив спектры действия фотосинтеза при сильном, но не насыщающем воздействии светом, поглощаемым другой системой. Скорость общей реакции в этом случае определяется лимитирующим
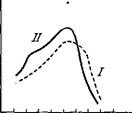
процессом. Если избыточный свет поглощается системой /, то скорость реакции, а значит, и спектр действия, лимитируется системой II и наоборот. Соответствующие измерения привели к установлению спектров поглощения обеих систем (рис. 7.9) [40]. ФС II несколько богаче Chi b и Chi а 6700, ФС / содержит больше Chi а 6800 и Chi а 6950. Нельзя, следовательно, считать, что Chi а 6700 служит сенсибилизатором одной фотохимической реакции, Chi а 6800 — другой. Обе реакции связаны друг с другом относительно медленным темновым процессом. Это доказывается тем, что эффект Эмерсона наблюдается и при вхождении в реакционный сосуд под прямым углом друг к другу двух лучей
То 6700 7000 в 7300 Длит ваты, Л
Рис. 7.9. Спектры поглощения ФС / и ФС // в хлорелле.
По оси ординат — оптическая плотность.
Со.
-(СН20)
Хн.
ZH.
Рис. 7.10. Схема фотосинтеза с двумя фотохимическими стадиями, сенсибилизированными ФС / и ФС//.
Света разной длины волны. При таких условиях коротко - и длинноволновый свет поглощается клетками водорослей в разное время. Эффект Эмерсона обнаруживается при прерывистом воздействии света с разной длиной волны с интервалом между вспышками, достигающим нескольких секунд [41]. В красных водорослях Porphyridium выделение Ог при вспышке зеленого света усиливается, если ей предшествует вспышка красного света, поглощаемого Chi а в ФС/. Отсюда следует, что при этом получается долгоживущее промежуточное соединение. Время его полураспада оценивается в 18 с. Напротив, выделение Ог при вспышке красного света не усиливается, если ей предшествует вспышка зеленого; таким образом, зеленый свет, поглощаемый ФС II, не создает долгоживущих промежуточных соединений.
Из сказанного следует, что общую схему фотосинтеза можно представить рис. 7.10. Мы пришли к уточнению схемы, показанной на рис. 7.1 [1].
Каким образом поглощенные кванты распределяются между двумя системами так, что они работают с одинаковой скоростью? Здесь предложены две гипотезы. Согласно первой иа
них, избыточная световая энергия, поглощенная ФС II, «переливается» в ФС I, но не наоборот, так как переход энергии возбуждения с Chi а 6950 на хлорофиллы а 6800 и 6700 затруднен высоким барьером. «Переливание» приводит к сбалансированному возбуждению обеих систем в области спектра, в которой больше света поглощается ФС II, чем ФС /. Оно объясняет красное падение при К > 6800 А, где свет поглощается главным образом Chi а 6950 в ФС/. В водорослях, содержащих фикобилин, Chi а в основном содержится в ФС I, и красное падение начинается при 6500 А.
Вторая гипотеза исходит из пространственного разделения ФС / и ФС//, находящихся в «отдельных пакетах» (см. [42]). Эта гипотеза более правдоподобна, так как пространственное разделение систем подтверждается опытами по фракционированию вещества хлоропластов. Сбалансированное возбуждение определяется в этом случае не переносом энергии от ФС// к ФСI, но наличием в обеих системах одинаковых пигментов, хотя и в разных пропорциях. Квантовый выход фотосинтеза должен прн этом иметь минимумы в областях, в которых одна из систем поглощает свет сильнее, чем другая. Соответствующая тонкая структура спектра действия была действительно обнаружена.
Изучение дифференциальных спектров поглощения дало богатую информацию о двух фотохимических системах. Дифференциальные спектры исследуются при одновременном поглощении света, возбуждающего фотосинтез. Возбуждающий пучок направлен перпендикулярно к аналитическому. Исследуются изменения в дифференциальном поглощении слабого света при наличии сильного монохроматического освещения (в частности вспышечного) по сравнению с темнотой. Дифференциальный спектр дает сведения о пигментах, испытывающих обратимые изменения при фотосинтезе. Варьируя длину волны возбуждения, удается получить спектр действия и определить пигменты, сенсибилизирующие изменения в поглощении. Этот метод был развит Дейзенсом [42], вспышечная техника — в работах Кока [43] и Витта [44]. Именно при помощи вспышечной техники, подробно описанной в [44], была получена наиболее детализированная информация о молекулярных событиях при фотосинтезе. Эта техника дает возможность измерять времена жизни т возникающих промежуточных соединений и времена их появления и исчезновения в интервале от Ю-1 до Ю-8 с. Времена эти широко варьируют для разных процессов.
В клетках хлореллы и в хлоропластах зеленых растений при освещении обнаружены изменения поглощения с временем жизни т = 3 мкс и временем появления промежуточных соединений, меньшим 25 НС [45, 46]. Дифференциальный спектр этих изменений имеет три отрицательных пика при 4300, 4600 и 4900 А и положительный при 5200 А. Таким образом, в синей области происходит выцветание. Оно интерпретируется как переход некоего каротиноида в метастабильную форму
<25 не
Саг >- саг*.
3 мкс
Это доказывается рядом фактов. Спектр исследуется при температурах, меньших—160°С, при которых заблокированы все химические реакции. Он наблюдается при блокировке фотосинтеза добавленным ядом 3-(3,4-дихлорфенил)-1,1-диметилмоче - виной (ДХММ) и исчезает полностью в присутствии парамагнитных тушителей (02). В гексане метастабильные состояния каротиноидов характеризуются полосой 5140 А, близкой к 5200 А. Возникновение Саг* имеет очевидный биологический смысл. При избыточном освещении энергия должна диссипиро - вать, что и осуществляется через посредство Саг*. Каротиноиды защищают хлорофилл от фотоокисления при избытке света.
Изучение ФС / показало, что содержащийся в ней Chi а, обозначаемый Chi сії, окисляется на свету. Этот процесс, представляемый схемой
<:о не
Chi а, Chi а),
20 мс
Обнаруживается по появлению в дифференциальном спектре отрицательных полос при 4380, 6600, 6820 и 7000 А [47]. Первая и последняя полосы сильные. При добавлении феррицианида к суспензиям хлоропластов амплитуды этих изменений сильно убывают. Chi а/ окисляется феррицнанидом в темноте и восстанавливается в темноте N-метилфеназониумсульфатом (МФС). В бутаноле фотоокисление чистого Chi а сопровождается появлением отрицательных полос при 4320 и 6660 А [48], что согласуется с результатами, полученными Красновским [11, 49].
Очень быстрое окисление хлорофилла Chi аг показывает, что это первичный продукт. Электрон переходит с Chi а/ на НАДФ+.
Установлена стехиометрия 1: 1 окисления Chiаг и восстановления НАДФ+ [43]. Восстановление Chi aj полностью блокируется ядом ДХММ. Так как этот яд специфически блокирует окисление воды, то конечным донором электрона для Chi af служит вода.
Свет с К 7000 А вызывает обратимые изменения поглощения Chi аг. За окислением следует восстановление в течение 20 мс. Однако в далекой красной области 7000—7300 А происходит лишь окисление хлорофилла аг. Как уже сказано, свет с энергией кванта йсо/ вызывает окисление Chi aIt свет с энергией кванта Ъищ поглощается в ФС//, в результате чего электроны НгО могут быть использованы для восстановления Chi aIt Пигмент в ФС 11 может возбуждаться лишь при к < 7000 А. Это, по-видимому, также Chi а, обозначаемый Chi ап. Различие Chi aj и Chi аи, возможно, сводится к различию в их окружении. Первый — «длинноволновый», второй — «коротковолновый» хлорофилл.
Время жизни Chi ал в 100 раз меньше, чем Chi aj. Тем не менее, удалось выделить реакцию Chi ац на свету, характеризуемую отрицательными пиками при 4350 и 6820 А [50]. Схема реакции имеет вид
<20 НС
Chi a, jj ч І Chi а*
0.2 мс
Как связаны ФС / и ФС II, т. е. Chi а, и Chi аи} Окисление Н2О блокируется ДХММ. Следовательно, этот яд должен вызывать исчезновение обратимых изменений Chi и Chi aIIt если они связаны последовательно. В присутствии ДХММ искусственный донор электронов МФС может снабдить Chi аг электронами вместо Н20. Если оба хлорофилла связаны, то МФС может реактивировать Chi а,, но не Chi ап. Это и наблюдается в соответствии со схемой [44]:
ДХММ
МФС I
НАДФ+ ч— Chi а, Chi а„<-ЩО.
Hdi] *«>//
Приведенная схема следует из результатов, полученных с помощью импульсной методики. Не следует, однако, думать, что эта методика дает исчерпывающие данные. Если какой-либо из доноров и акцепторов электрона, участвующий в фотосинтетической системе, не имеет соответствующей полосы поглощения, то он может быть не замечен. Так, перенос электрона с Chi aj на НАДФ идет в действительности через ферредоксин (см. далее стр. 353).
Приводимые здесь схемы (они заимствованы у Витта [44]) нельзя считать окончательными. По мере улучшения методики и увеличения точности результатов экспериментов картина все более усложняется. Ясно, что в исследованиях сложных проблем фотосинтеза должны применяться (и применяются) различные методы, дополняющие друг друга.
Свойства Chi аг и Chi аи представлены в табл. 7.2 [44].
Таблица 7.2
Свойства хлорофиллов I и II
|
Свойства |
Chi а] |
Chi ац |
|
Тип реакции |
Донор электрона |
Сенсибилизатор? |
|
Характеристические изменения |
4380, 6600, 6820-7030 А. |
4350, 6400, 6820 А |
|
Поглощения |
Расщепление полос |
Нет расщепления |
|
Время появления |
<20 не |
<20 не |
|
Время жизни (20 °С) |
20 мс |
0,2 мс |
|
Потенциал |
+ 0,45 В |
< 7000 А |
|
Область возбуждения |
< 7300 А |
|
|
Область рН |
3-11 |
? |
|
Температура инактивации |
65 °С |
55 °С |
|
Время старения (0 °С) |
Нет |
Т « 95 час |
|
Действующая концентрация |
Нет |
С « Ю-7 М/л |
|
ДХММ |
Связь ФС / и ФС// осуществляется посредством пластохи - нонов (ПХ). При экстрагировании петролейным эфиром хло - ропласты утрачивают способность окислять воду, но эта способность восстанавливается при добавлении ПХ [51]. ПХ участвуют в окислительно-восстановительных реакциях. Возбужденный Chi а'и восстанавливает ПХ до гидрохинона, Chi af окисляет его вновь. ПХ расположены в виде «пула», содержащего около пяти молекул, между ФС I и ФС II. (Подробности, относящиеся к кинетическому поведению ПХ, см. в [44], а также далее, см. стр. 372).
Этим дело, однако, не ограничивается. В окислительно-восстановительной цепи две молекулы Chi ап находятся в контакте с двумя молекулами неидентифицированного пока что вещества X —возможно также пластохинона, но находящегося в другом окружении. Вещество X восстанавливается Chi а// и служит переносчиком электрона. Максимальные изменения в
дифференциальном спектре X — положительная полоса при 3350 А. Таким образом, получаем схему
НАДФ+ ч— Chi о, <— ПХ <— X с— Chi ап <— Н20. й<о/ Ьац
Схема эта не полна — между ПХ и Chi cij имеются промежуточные переносчики электронов, равно как между Сhla{ и НАДФ+ (ферредоксин).
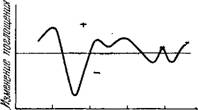
Ранее было известно, что в хлоропластах содержатся по крайней мере два цитохрома — цитохром Ь6 с окислительно-восстановительным потенциалом, близким к 0,0 В, и цитохром f с потенциалом, близким к +0,42 В. Позднее был найден еще и цитохром Ь3 с потенциалом около —0,15 В. Дифференциальные спектры показывают, что цитохромы (прежде всего цитохром /) испытывают обратимое окисление в освещенных- фотосинтезирующих клетках. Дифференциальный спектр цитохромов, полученный Дейзенсом и сотрудниками [52], показан на рис. 7.11. Потенциалы цитохромов промежуточны между потенциалами ФС / и ФС//, соответственно цитохромы занимают промежуточное положение между ФС/ и ФС//. Фотоокисление цитохрома / происходит только на свету, поглощаемом ФС/, т. е. Chi Я/ в красных водорослях. Свет, поглощаемый ФС//, т. е. фикоэритрином в красных водорослях, вызывает усиленное восстановление окисленного цитохрома /. Другие факты, характеризующие роль цитохромов, приведены в [44]. Получается схема
НАДФ+ <— Chi а, ч— цит f ПХ <— X <— Chi а„ <— Н20>
40О Ц 4500 5000 Длина волны, А
Рис. 7.11. Дифференциальный спектр Цитохромов в фотосинтезирующих системах.
Й(0/ . ЙШ//
По-видимому, один из цитохромов — цитохром Ь3 — функционирует в окисленной форме как первичный окислитель в ФС// [531. Он служит акцептором электронов, происходящих из Н20. Цитохром / может служить в восстановленной форме донором электронов в ФС/, передающим электрон^ на пиридин- нуклеотид. После этого цитохромы Ь3 и f взаимодействуют, причем снова возникает окисленное состояние первого и восстановленное второго. При этом освобождается свободная энергия,
О
+.0,5
Chi ah
—і—Потеря __\энергии ФД
ФП ^ НАД?
Потеря жре/ш
Ьь)Т
Ьы„
ЧПХ
Цит£ ПЦ -
СМ aj {7000)
НгО-
Chi ац (6800)
Рис. 7.12. Энергетическая схема событий, происходящих в ФС / и ФС ii.
Пц —пластоцианин, ПХ-~иластохинон, ФД — ферредоксин, ФП —флавопротеид.
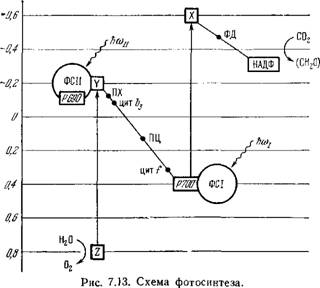
Z и Y — первичные доноры и акцепторы электронов световой реакции И, Р 700 и X — пер* вичные доноры и акцепторы электронов реакции I, Р 690 — реакционный центр ФС//, и 700 — реакционный центр ФС I, ПХ —пластохинон, ПЦ — пластоцианин, ФД —ферредоксии. По оси ординат отложены окислительно-восстановительные потенциалы в вольтах.
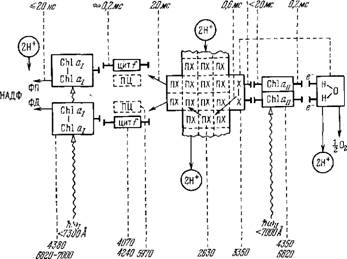
Равная 0,4 эВ, которая может быть использована для синтеза АТФ. На рис. 7.12 показана энергетическая диаграмма событий в ФС / и ФС// [44], а на рис. 7.13 — общая схема фотосинтеза (ср. рис. 7.10 и 7.1). Наконец, на рис. 7.14 приведена весьма детализированная схема переноса электронов от Н20 к НАДФ+ в хлоропластах [44]. На схеме указаны временные и спектроскопические характеристики соответствующих процессов. Время окисления ПХ 20 мс является лимитирующим. Одновременно функционируют две цепи переноса электронов. Это доказывается следующими соображениями: образование пластогидро - хинона за одну вспышку, в которой переносится только один
<гимс
5555
Рис. 7.14. Схема переноса электронов от Н20 к НАДФ+ в хлоропластах [44].
Электрон, можно понять, лишь если две цепи действуют парал- тельно; первый порядок реакции исчезновения Х~ 3350 (донор электрона для ПХ) можно объяснить лишь наличием двух цепей; кооперация двух Chi an доказывается блокированием двух центров Chi an одной молекулой ДХММ.
§ 7.4. ИССЛЕДОВАНИЯ ФЛУОРЕСЦЕНЦИИ
Изучение спектров флуоресценции фотосинтезирующей системы дает ценную информацию о ФС / и ФС//, несмотря на трудности интерпретации получаемых данных. Флуоресцирующая фотосинтезирующая система состоит из различных форм
пигментов, между молекулами которых возможна миграция энергии (см. далее, стр.370), что очень усложняет картину.
Квантовый выход флуоресценции Chi а составляет 30% in vitro и лишь 3—6% in vivo. В последнем случае флуоресцируют несколько форм хлорофилла а, разнящиеся спектрами испускания и квантовыми выходами. Эти формы характеризуются различной зависимостью флуоресценции от интенсивности освещения и различным образом изменяются во время индукционного периода. Квантовый выход флуоресценции фикобилинов не зависит от интенсивности освещения. Энергия, запасаемая
В Chi а, может расходоваться в фотоситезе или излучаться. Малый выход флуоресценции определяется именно тем, что энергия идет на фотосинтез.
Спектр флуоресценции Chi а показан на рис. 7.15 [1]. Главная полоса 6850 А и колебательный спутник 7400 А отличаются колебательной энергией, отвечающей частоте 1460 см-1, характерной для деформационного колебания СНг-группы. При сильном освещении, превышающем насыщающее для фотосинтеза, квантовый выход флуоресценции примерно удваивается. Он возрастает также при низких температурах. Квантовый выход сильно меняется при быстром переносе клеток из темноты на свет во время периода индукции фотосинтеза. Изменение флуоресценции в этом периоде отражает работу цепи переноса электронов.
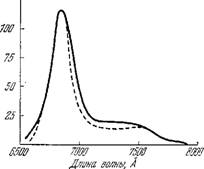
Рис. 7.15. Спектр флуоресценции хлореллы при возбуждении светом с Я 4200 А (сплошная кривая) и 4800 А
(пунктир). По оси ординат — квантовый выход флуоресценции в произвольных единицах.
Главная полоса испускания Chi a in vivo, обозначаемая F 685, в действительности содержит вторую более слабую компоненту в области 7000 А. При возбуждении клеток хлореллы светом с К 4400 А, поглощаемым Chi а, длинноволновая компонента сильнее, чем при возбуждении светом с X 4800 А, поглощаемым Chi Ъ. Следовательно, полоса флуоресценции при I 7200 A (F 720) определяется ФС/. Главная полоса, напротив, относится к ФС//. В красных и сине-зеленых водорослях зеленый свет, поглощаемый фикобилинами, более эффективен для возбуждения флуоресценции Chi а, чем свет, поглощаемый самим Chi а. Фикобилины содержатся преимущественно в ФС//. Из этих фактов вновь следует, что имеются две формы хлоро
филла а — флуоресцентная Chi йц и нефлуоресцентная (слабо флуоресцентная) Chi Я/.
Допустим, что возбуждение молекулы завершается либо излучением с вероятностью /, либо внутренней конверсией, безызлучательный переходом, с вероятностью g. Число возбужденных молекул п удовлетворяет дифференциальному уравнению
N = -(f + g)n (7.4)
С решением
Л (/) = л (0) ехр [-(f+ £)/]. (7.5)
Квантовый выход излучения равен
Оо
О
Для среднего времени жизни имеем
ОО I оо
T=\tdn \ dn = 7TF - (7-7>
О і о
Следовательно, т = Фто, где то = 1// — «естественное» время жизни в отсутствие тушения при g = 0. Для Chi а то = 15 не и квантовый выход in vitro Ф = т/то = 4,5/15 = 0,3. In vivo при слабом освещении Ф = 0,05, при сильном — Ф = 0,09, тогда, как прямые измерения дают соответственно значения 0,03 и 0,06. Расхождение объясняется наличием значительной доли нефлуо - ресцирующего Chi a in vivo. Расхождение устранится, если не светится около половины всего хлорофилла а.
Спектр действия флуоресценции Chi a in vivo, т. е. зависимость Ф от длины волны возбуждающего света, характеризуется, как и следовало ожидать, красным падением. Оно начинается в области 6750 А. Красное падение, по-видимому, связано не с Chi а 6800, а с минорной компонентой Chi а7 6950, наличествующей лишь в ФС I, тогда как компоненты 6700 и 6800 присутствуют в обеих фотосинтетических системах и дают примерно равные вклады в флуоресценцию. Действительно, при деструкции Chi а 6950 при помощи ультразвука красное падение исчезает.
Сложность флуоресценции Chi a in vivo подтверждается ее изменением во время индукционного периода фотосинтеза. Если клетки хлореллы подвергаются сильному освещению после длительного пребывания в темноте, выход Ф практически мгновенно достигает некоторого уровня. Через несколько миллисе
кунд Ф повышается примерно втрое, потом слегка убывает, затем достигает максимального уровня, пятикратного по сравнению с начальным. После этого Ф убывает до стационарного значения, достигаемого через несколько минут. Анализ такого
Поведения показывает, что за него ответственна полоса флуоресценции 6850 А, относящаяся к ФС //. Слабая флуоресценция ФС/ остается практически постоянной во времени.
При низких температурах полосы флуоресценции сужаются и уменьшается их перекрывание. Так, при 4 К были обнаружены три длинноволновые полосы испускания при 6890, 6980 и 7250 А. Охлаждение способствует излучению из ловушек, энергетическая глубина которых оценивается в 1 — 2 kbТ при комнатной температуре, 5—8 kbT при 77 К и 100—150 ksT при 4 К. Полоса 6950 А, наблюдаемая лишь при температурах ниже 140 К, возможно, обусловлена эмиссией из ловушек в ФС II. Полосы 6850 и 6980 А возбуждаются главным образом при поглощении в ФС II, а полоса 7250 А — при поглощении в ФС / [1].
В растворах хлорофилла, равно как и других красителей, интенсивность флуоресценции F пропорциональна интенсивности освещения I, т. е. квантовый выход флуоресценции не зависит от I. In vivo, однако, выход F/I идет к насыщению с ростом I (рис. 7.16) [1]. При насыщении фотосинтеза выход при-
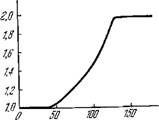
Рис. 7.16. Зависимость выхода флуоресценции (в условных единицах) Porphyri - dium от интенсивности освещения (в условных единицах).
Таблица 7.3
|
Некоторые характеристики двух |
Іракций вещества хлоропластов [1] |
|
|
Свойства |
Легкая фракция |
Тяжелая фракция |
|
Отношение Chi a/Chl b Относительное содержание цитохрома . Отношение каротинол/каротин Относительное содержание Fe Относительное содержание Мп Способность восстанавливать НАДФ+ Доля поляризации флуоресценции, возбужденной поляризованным светом, % Квантовый выход флуоресценции Спектр испускания при 77 К |
1 1,9 1-5 1 Высокая Низкий Больше с Я 7200 А |
2,3 3 3,3 1 5 Низкая 2,7 Высокий Больше с Я 6960 А |
Мерно удваивается. Причина этого пока не ясна [1]. Изучение спектральных свойств хлоропластов позволило локализовать фотосинтетические системы — фракционирование вещества хлоропластов и исследование спектров поглощения и флуоресценции двух фракций — легкой и тяжелой — показывает, что легкая фракция содержит преимущественно ФС/, а тяжелая — ФС// (табл. 7.3).
Существенные аргументы в пользу функционирования двух пигментных систем следуют из изучения флуоресценции. Однако мы не располагаем пока сколько-нибудь полной интерпретацией флуоресценции растительных клеток in vivo.