НЕЛИНЕЙНЫЕ ФЕРМЕНТАТИВНЫЕ ПРОЦЕССЫ
В ферментативных процессах могут проявляться различные типы нелинейных зависимостей от концентраций реагентов; в частности, удается наблюдать и периодические ферментативные реакции (см. § 8.7).
Стационарная кинетика ферментативных процессов может быть нелинейной в смысле нелинейной зависимости скорости превращения субстрата от его концентрации, а также от концентрации других эффекторов. С такими ситуациями мы встречаемся при рассмотрении белков-ферментов, обладающих четвертичной структурой и имеющих несколько активных центров, поведение которых взаимозависимо. Указанная нелинейность служит выражением кооперативности системы и проявляется в наличии особенностей (перегибов и максимумов) на кривых зависимости стационарной скорости от концентраций лигандов. Эти явления, весьма существенные для понимания свойств алло - стерических ферментов, рассмотрены в §§ 7.5, 7.6 книги [9]. Однако нелинейность стационарной кинетики в этих случаях никак не означает удаленности системы от состояния равновесия — она возникает и при равновесных соотношениях фермента с ли - гандами. В модели Моно, Уаймана и Шанжё (модель МУШ) [9, 50, 51] присоединение лигандов приводит лишь к сдвигу равновесия.
Рассмотрим неравновесный ферментативный процесс. Не- равновесность возникает в результате значительных различий в скоростях конформационных изменений ферментов, которые могут быть большими и малыми по сравнению со скоростями связывания субстратов и образования продуктов. Как уже сказано, классические модели аллостерических ферментов основаны на допущении быстрого наступления равновесия между всеми формами фермента, отличающимися друг от друга коиформа - циями и степенью насыщения лигандами. Однако во многих случаях изменение конформации оказывается наиболее медленной, определяющей кинетику стадией. При этом стационарная реакция протекает вдали от равновесия, что и приводит к специфическим особенностям на кривых зависимости скорости реакции от концентраций лигандов. Эти особенности нельзя интерпретировать на основе равновесных моделей.
Кинетические проявления конформационных изменений были проанализированы для одноцентрового мономерного фермента в ряде работ [52—56]. Однако во многих случаях за своеобразное кинетическое поведение ответственны скорее медленные изменения четвертичной структуры олигомерньгх ферментов. В работе [57] рассмотрены их нелинейные свойства.
Модифицируем модель МУШ. Рассмотрим фермент, молекула которого содержит п субъединиц — протомеров. Молекула фермента может находиться в двух различных конформационных состояниях R и Т, в которых она имеет различное химическое сродство к лиганду S.
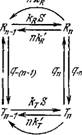
Будем считать, что переходы между этими состояниями происходят значительно медленнее, чем связывание и освобождение субстрата и образование продукта. Схема реакции представлена на рис. 8.27.
В неравновесном стационарном процессе фермент испытывает циклические конформационные изменения. Он лучше связывает субстрат в одной конформации, чем в другой, в которой он легче освобождает продукт, после чего возвращается в исходное конформациониое состояние (ср. стр. 320). При равновесии конформеров, которое описывается условием (смысл
констант ясен из рис. 8.27)
KRjkT =
Циклические конформационные превращения отсутствуют.
Пхт
KT. x r
В модели МУШ предполагается, что лимитирующими являются стадии образования продуктов с константами скорости
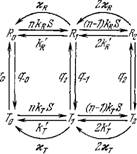
Рис. 8.27. Схема реакции, катализируемой «-мерным ферментом, имеющим два конформационных состояния.
Хд и хт. При этом стационарный процесс соответствует равновесию всех конформационных состояний фермента Ru ТПредположим, что равновесия нет, скорости переходов Ri Tt являются наименьшими (S — концентрация субстрата)
K~St k „S; k R,
При этих условиях в стационарном процессе соотношения концентраций фермента в состояниях Ri/Rj, TJTj определяются только концентрацией субстрата и константами K'R = kRj(k'R-\- xR)
И К'т — k'Tj{k'T + хг), но не константами Ці, q~i. Предположим далее, что концентрация продукта мала, следовательно, можно пренебречь стадией его связывания. Это упрощение не принципиально. Скорости конформационных переходов определяют только отношение общих концентраций фермента в двух конформациях Rt/Tt, где
(8.80)
Г=0
В са
Мом деле,
Rt — 2 Ri,
(K'Rsy,
(K'rSу.
Яо
Л
То
(8.81)
І)
П (п
П (п - 1) ... (п - і)
1-2 ... і - 1) ... (я - 1-2 ... і
Условие стационарности процесса можно записать в виде
І R,,,= t (8.82,
Из равенств (8.80) — (8.82) следует
І п (п — 1) ... (п — і)
1-2 ...і
І=0
(8.83)
*T (] + KRS)
Rt О + ФГ
I=0
Условие детального баланса при равновесии приводит к закономерному изменению констант равновесия qjq-i в зависимости от индекса І:
Її _ % 4-і <7-о
. і
Где Kr — knjk'n, Кт = кт1кт.
Допустим, что константы ^ и изменяются монотонно по мере связывания субстрата активными центрами. Тогда в силу (8.84) получим
Ч{+1 = а _ 1 Яі Кт s
И (8.85)
Ч—(»-Н) а
—і
Где а, s, г — константы.
Для системы глицеральдегидфосфатдегидрогеназа - f - НАД обнаружено именно монотонное изменение констант qf, причем s = 25, г = 1 [58].
У-
С помощью (8.85) получаем из (8.83)
Rt <7-о _ Г(* + /)(г* + 1)-|"
Где x — KrS/г — безразмерная концентрация субстрата и I — — (1 + + xR/k'R). Величина Rt/Tt изменяется от q0/q_0
При S = 0 до qnlq-n при S-*-oo. Для равновесной модели МУШ Rt/Tt монотонно зависит от S [59]. При равновесиях происходит монотонный переход фермента из одной конформации в другую, обладающую большим сродством к субстрату.
Вдали от равновесия при определенных значениях параметров г, s, I функция у{х) может быть немонотонной. Допустим, что две конформации отличаются каталитической активностью, но не сродством к субстрату, т. е. г = s. В этом случае функция у(х) проходит через максимум, а ее предельные значения при х = 0 и х —V оо совпадают. Если г ф s, то у(х) проходит через максимум, а предельные значения разнятся. При г = 100, s = 150, / = 2 и п — 4 максимум у(х) отвечает х = = 0,1. Это означает, что при увеличении х сначала происходит переход Г->- а затем переход R -> Т. Такое переключение кон - формационного перехода может проявиться в виде промежуточного плато на кривой зависимости стационарной скорости реакции от концентрации субстрата S. Формула (8.86) показывает, что немонотонность у(х) возможна при отличии параметров г, s, I от единицы.
Начальная стационарная скорость реакции, отнесенная к полной концентрации фермента Rt - f - Tt, равна
П п
XR Z iRi + ХГ Z ІТІ
"Ч+Г,"' ■ (8-87)
Для рассматриваемой модели это выражение приобретает вид
/ ч KRLrx (гх + 1)"-' (X + /)" + XTSX (sx + /)"-' (X + 1) °oW— L(rx+ I)" (x + /)" + (sx + (х + 1)" '
Где L — qo/q-o — аллостерическая константа равновесия. Кривизна получаемых кривых Уо(х) больше, чем в случае равновесной модели МУШ, так как концентрация субстрата х входнт в уравнение (8.88) в степени 2п, а в соответствующую равновесную функцию только в степени п. Равновесная функция получается из (8.88) при /= 1, она совпадает с формулой для модели МУШ [50]. Рассматриваемая модель учитывает два типа нелинейности — нелинейность, определяемую равновесными кооперативными свойствами, и нелинейность, вызванную медленностью конформационных превращений, т. е. удаленностью от равновесия.
Вследствие неравновесности на кривой v0(x) может появиться промежуточное плато. Соответствующая кривая v(x), полученная при параметрах xR/xT — 0,1, L = 10, 1 = 4, г = 100, s = 150, п = 4, показана на рис. 8.28. Плато получается в области х= 1. Такая кривая может вырождаться в S-образную кривую или в кривую, лишенную особенностей. Равновесная модель МУШ объясняет только S-образнне кривые v(x) при
любом числе состояний фермента и любом числе субъединиц п [60].
Для п = 4 кривые с промежуточным плато могут быть получены на основе равновесной модели последовательных конформационных изменений Кошланда [61]. Однако при этом приходится вводить искусственное предположение о резком изменении характера кооперативности — замене отрицательной кооперативности на положительную при увеличении концентрации субстрата. Впрочем, для любой равновесной модели концентрация субстрата входит в выражение скорости реакции в степени, не старшей п. Поэтому и модель Кошланда не всегда согласуется с опытом [62].
Неравновесная модель очень чувствительна к значениям параметров и дает большое разнообразие кинетических кривых. Можно думать, что сходные ферменты, полученные из различных источников (например, глицеральдегидфосфат- дегидрогеназа из дрожжей, из мышц животных и насекомых), проявляют различный характер кооперативности именно вследствие неравновесности своего поведения. Медленные изменения конформации могут приводить к пред - стационарному нарастанию или спаду активности фермента [56]. Приближение к стационарному состоянию может быть немонотонным, в частности иметь характер затухающих колебаний вследствие неравновесности (см. также [63]).
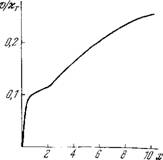
Рис. 8.28. График стационарной скорости с промежуточным плато.
Следует подчеркнуть, что однонаправленность циклического ферментативного процесса возможна только в кинетическом режиме, вдали от равновесия. Ни одна из элементарных стадий цикла не может быть истинно необратимой. Поэтому применение термина «релаксация» (см. § 6.6) условно. На первый взгляд может показаться, что прямая и обратная реакции S -*■ Р н Р -> S способны идти разными путями и равновесие должно лишь уравнять суммарные прямой и обратные потоки. Однако легко видеть, что в таком случае молекула фермента окажется вечным двигателем. В равновесии при неизменных концентрациях всех веществ в замкнутой системе молекулы фермента совершали бы циклические конформационные превращения и нагревали бы среду вследствие обычных потерь на трение. В действительности термодинамическое равновесие обязательно означает и детальное равновесие, т. е. равновесие на каждой элс-
ментарной стадии. В любой кинетической схеме, содержащей замкнутые циклы, условие детального равновесия накладывает связи на константы скорости (см., например, стр. 61).
Для регулирования активности фермента существенно то, что по крайней мере в одной из конформаций образование продукта происходит быстрее, чем переход между конформационными состояниями фермента. Возникающие нелинейные эффекты очень чувствительны к регулирующим факторам.
Изложенная теория с успехом применима, в частности, для интерпретации своеобразного кинетического поведения лактатде - гидрогеназы [64].
Неравновесные свойства ферментов весьма существенны. В работе Марковича и Крапивинского [ПО] были обнаружены медленные конформационные изменения фермента, продолжающиеся до 20—30 мин. Таковы конформационные изменения окружения SH-групп активного центра D-глицеральдегид-З-фосфатдегидро- геназы (ГАФД) в присутствии ингибитора — АТФ. Эти изменения проявляются в дифференциальных спектрах поглощения и в спектрах кругового дихроизма, в полосе поглощения специфических флуоресцентных меток. Предполагается, что малая скорость перестроек активного центра, индуцированных АТФ, объясняется их сопряжением с перестройками контактных площадок между субъединицами (ГАФД — тетрамер) и с последующими изменениями расположения субъединиц. В компактной тетрамер - ной структуре последние изменения невозможны из-за стериче - ских ограничений. Конформационный переход реализуется на промежуточной стадии димера или «рыхлого» тетрамера с подвижными контактами субъеднниц. Медленность перехода обусловлена низкой константой скорости диссоциации тетрамера. После перехода, вызванного АТФ, происходит ассоциация промежуточных форм, причем образуется тетрамер с иным расположением субъединиц. Эти представления подтверждаются исследованиями миграции энергии электронного возбуждения между хромофорами, расположенными на различных субъединицах. В последующих работах [111, 112] было проведено детальное изучение кинетики ферментативных реакций ГАФД, кинетики связывания ферментом АТФ и кофермента (НАД), подтвердившее изложенные представления и раскрывшее природу кооперативных свойств фермента, определяемых его четвертичной структурой и неравновесным состоянием.
Возможность весьма медленных конформационных перестроек фермента непосредственно свидетельствует о необходимости учета неравновесности и нелинейности ферментативных процессов в такого рода случаях.
Рассмотренное в данном параграфе нелинейное поведение ферментов не является организованным во времени—система не может выполнять незатухающие колебания, если в ней нет автокаталитических стадий, обратных связей.
Мы видим, однако, что отдаленность от равновесия приводит к разнообразным видам регулируемого поведения биохимических систем. Можно думать, что эти возможности реализуются, в частности, в сопрягающих мембранах (см. гл. 6 и 7).