МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ ФОТОРЕЦЕПЦИИ
Исходя из общих принципов физики, биофизики и биологии, легко прийти к заключению, что первичный акт фоторецепции должен состоять в поглощении света молекулами некоего пигмента. Человек и высшие животные воспринимают свет обычной интенсивности в области примерно от 4000 до 7000 А. Ультрафиолетовый свет поглощается прозрачными тканями глаза. Инфракрасные лучи не воспринимаются сетчаткой. Если бы они воспринимались, то теплокровные животные ощущали бы сильную фоновую инфракрасную радиацию, препятствующую рецеп
ции информативных сигналов. Следовательно, пигмент или пигменты фоторецепторных клеток должны поглощать свет в видимой области спектра, т. е. быть окрашенными. Поскольку речь идет о молекулах органических соединений, отсюда следует, что это должны быть молекулы с достаточно протяженной системой л-связей — при малом числе сопряженных связей поглощается лишь ультрафиолетовое излучение.
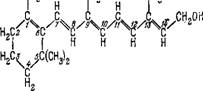
Действительно, еще в 1933 г. Уолд открыл присутствие витамина А в зрительном пурпуре в сетчатке [107]. Структура витамина А была установлена несколько раньше [108]. Витамин А (точнее, витамин Ai), или ретинолі, имеет следующую структуру:
СН,
СН,
СН»
Брутто-формула ретинолаї С19Н27СН2ОН. Эта молекула представляет собой почти не измененную половину молекулы каротина (см. стр. 339). Каротиноиды являются источником витамина А, отсутствие которого приводит к слепоте.
В сетчатке позвоночных фигурирует и вторая форма витамина А—витамин А2, или ретинол2; структура которого отличается от приведенной наличием двойной связи между углеро - дами 2 и 3. Соответственно, брутто-формула ретинола2 есть С19Н25СН2ОН. Ретинолы — это спирты. В фоторецепторах ретинолы трансформированы посредством алкогольдегидрогеназы в альдегиды — в ретинальї и ретиНаль2 — и связаны с фосфолипи - дами и белками. В ретиналях конечная группа молекулы есть не =СН—СН2ОН, а =СН—СН=0, и брутто-формулы ретиналяї и ретиналя2 суть СідН27СНО и С19Н25СНО. Число сопряженных л-связей в ретиналях на одну больше, чем в ретинолах.
Таким образом, ретинали служат хромофорными группами зрительных пигментов, содержащих липопротеины, именуемые о псинами. Опсины колбочек и палочек разнятся. Соответственно возникают четыре основных вида зрительного пигмента, охарактеризованные в табл. 7.5 [109].
Хромофорные свойства ретиналей определяются протяженной системой сопряженных л-связей. Обращает на себя внимание химическая общность пигментов фотосинтеза — каротинои - дов (см. стр. 340) и зрительных хромофоров. Можно думать об
общности их эволюционного происхождения. Имеются бактерии, лишенные, конечно, зрения, но содержащие бактериородопсин, весьма сходный со зрительным пигментом.
Таблица 7.5
Зрительные пигменты
Максимум поглощения А,, А
|
Ретинолі ^ФН> Ретиналь] ДФН-Н (Алкогольдегидрогеназа) |
( +Опсин I палочек I +Опсин к колбочек |
Свет Свет |
Родопсин йодопсин |
5000 5620 |
|
Ретинол* ^ФН> РрТИНЯЛЬо ДФН-Н (Алкогольдегидрогеназа) |
І +Опсин I палочек I +Опсин к колбочек |
Свет Свет |
Порфиропсин Цианопсин |
5220 6200 |
Исходя из общих принципов, можно снова заключить, что вслед за поглощением света в фоторецепторе должна возникать некая фотохимическая реакция. В родопсине ретиналь образует шиффово основание в результате взаимодействия альдегидной группы ретиналя с амино-группой опсина [110, 111], а именно с е-ЫНг-группой лизила [109, 112]:
С,9Н27СН=0 + H2N—опсин —> C,9H27CH=N— опснн + Н20.
Бычнй родопсин имеет молекулярный вес около 40 000. Если считать молекулу сферической, то ее диаметр составляет 40 А.
Под действием света ретиналь отщепляется от родопсина, аналогичные процессы протекают и в трех других случаях (см. табл. 7.5). Однако этим фотохимическое превращение не исчерпывается. Одновременно происходит фотоизомеризация ретиналя.
Комплекс опсина с ретиналем возникает за счет CH = N - связи и ряда слабых взаимодействий хромофора с белком. Эти взаимодействия оптимизируются в результате структурного соответствия ретиналя и опсина. Ретиналь может существовать в виде ряда изомеров, так как двойная связь С = С образует транс- или і{«с-конфигурацию. Наиболее устойчива сплошная гранс-конфигурация, которая и показана для ретинолаї на стр. 380. Установлено, что в комплексе с опсином в темноте ретиналь фигурирует в форме 11 - цис [113]:
СН3 сн.
I Н I 3 Н
H2C/'VVM\h
I I " Н I
Н2С^/С(СН31г ®
С Н. С СН
Н, 6 І
"2
•НС
О
В 11-ц«£-форме СНз-группа у Ci3 и водород у Сю очень сближены, и между ними возникает сильное отталкивание. Благодаря этому молекула несколько скручена, в ней нарушено плоское расположение я-связей. Тем самым уменьшена энергия сопряжения, и 11-цис-форма должна быть менее стабильной, чем полная транс-форма. Однако в комплексе с опсином проигрыш в энергии сопряжения перекрывается выигрышем в энергии взаимодействия с белком, наибольшей для 11-цмс-формы.
При выцветании пигмента на свету ретиналь отщепляется от опсина и изомеризуется в наиболее устойчивую сплошную
Родопсин
^ Изшиерага
Fl-цас-ретиналь + алсин, g » Сплошной транс - ретинолі + онсин
К Алногалйдегифоееназа, і
Т НЛД а йр. Т
11-цис-решнол с > ' 1 к J Сплошной транс-ретинол Рис. 7.28. Цикл изомеризации родопсина.
Транс-фориу. Цикл цис—гране-изомеризации является обязательной частью любой известной фоторецепторной системы [109]. Этот цикл показан на рис. 7.28 [109].
В растворе ретиналь образует под действием света смесь изомеров, состав которой зависит от длины волны света и полярности растворителя [114, 115]. Полярный растворитель — этанол — стабилизует 11-цис-конфигурацию. Ее содержание в таком растворе ретиналя составляет 25—30% [116].
Установлено, что единственное действие света на ретиналь состоит именно в изомеризации 1 \-цис -> сплошной транс. Отщепление ретиналя от опсина должно рассматриваться как следствие этого процесса [117].
В этой книге и в «Молекулярной биофизике» [12] постоянно подчеркивается определяющее значение конформационных превращений молекулы в биологических явлениях.
В фоторецепции мы встречаемся не с ротамеризацией, не с конформационной перестройкой ретиналя, а с цис.—транс-изомеризацией— повороты происходят вокруг двойных, а не единичных связей. Различие между ротамеризацией и цис—транс - изомеризацией имеет количественный характер. В первом случае для конформационного превращения нужно преодолеть барьер порядка нескольких ккал/моль (в этане 3 ккал/моль), во втором, при переходе 11-цис-ретиналя в полностью грамс-форму — около 25 ккал/моль, причем значение частотного предэкспонен - циального множителя составляет от 107 до 10" с-1 в зависимости от растворителя [118]. Соответственно изомеры ретиналя устойчивы в растворе. Разности их энергий не велики — порядка 1—3 ккал/моль.
При возбуждении молекулы поглощенным светом происходит перестройка я-электронной оболочки, и барьер внутреннего вращения снижается до величины, соизмеримой с къТ. Время жизни молекулы в синглетном возбужденном состоянии 10~9 с, время, нужное для поворота, 10-11—Ю-12 с. Квантовый выход для реакции изомеризации 1 \-цис - у полностью транс составляет 0,5—0,7 [119]. Энергия кванта света более чем достаточна для изомеризации— кванту с к 5000 А отвечает энергия 58 ккал/моль.
Значительный интерес представляет детальный механизм изомеризации. Нужно установить, через какое возбужденное состояние— синглетное или триплетное — проходит изомеризация под действием света. В теоретических работах показано, что энергетический барьер для переходов в триплетном состоянии существенно ниже, чем в синглетном [120—122]. Окончательный ответ на вопрос о роли возбужденных триплетных состояний при изомеризации хромофора в родопсине был получен в работах Розенфельда и сотрудников [123]. В этих работах был применен метод лазерного фотолиза и использована система веществ-доноров, позволявшая в результате светового возбуждения создавать высокую концентрацию триплетных состояний шиффова основания ретиналя. Действительно, оказалось, что эффективность изомеризации в триплетном состоянии очень высока. Однако время жизни триплетных состояний шиффова основания ретиналя практически такое же, как для триплетных состояний ретиналя. Это означает, что отсутствие триплетного поглощения, установленное для шиффовых оснований ретиналя [124], объясняется не малым временем жизни триплетов, а малой эффективностью интеркомбинационной конверсии. При непосредственном фотолизе этих соединений триплеты не обнаруживаются [123].
По-видимому, триплетное состояние не играет роли при изомеризации хромофора в зрительном пигменте.
Действуя светом разных длин волн на раствор родопсина в эквимолярной смеси глицерина с водой при температуре—190 °С, можно обратимо смещать равновесие изомеров, что находит свое выражение в сдвигах полосы поглощения [109]. На основе такого рода исследований Уолд построил схему последовательных превращений родопсина, показанную на рис. 7.29. Под действием
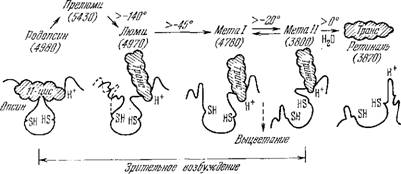
Рис. 7.29. Стадии выцветания родопсина.
Ретиналь заштрихован. В скобках указаны величины в А; температуры измеряются
В градусах Цельсия.
Света ретиналь, находящийся в комплексе с опсином, изомери- зуется, образуется прелюмиродопсин. При этом нарушается структурное соответствие ретиналя и опсина, и последний вместе со связанным ретиналем испытывает конформациониое превращение. Глобула опсина постепенно раскрывается, возникают стадии, обозначаемые как люмиродопсин и метародопсины. На заключительной стадии шиффово основание гидролизуется, и ретиналь отщепляется от опсина. При раскрытии опсина экспонируются новые химические группы, в частности, две SH-группы и группа, связывающая протон, с рК около 6,6 (вероятно, имида - зольная). Эти факты установлены с помощью биохимических и физико-химических методов [125—127].
Поглощая второй квант света, ретиналь может вновь перейти в 11-цмс-форму. Пигмент не только выцветает на свету, но может и регенерироваться. Соответствующая схема представлена на рис. 7.30 [109].
Таким образом, фоторецепция сводится к изомеризации хромофора, за которой следует изменение структуры липопро - теида — опсина. Конформациониое превращение опсина приводит в конечном счете к возникновению нервного импульса.
В сетчатке головоногих моллюсков наряду с родопсином содержится второй фоторецепторный комплекс — ретинохром. В отличие от родопсина, ретиналь в ретинохроме находится в сплошной гране-форме, изомеризующейся в 11-цнс-форму при воздействии оранжевым светом. Белковая часть ретинохрома может давать комплексы и с другими изомерами ретиналя. При освещении все они дают 11-цис-форму, отщепляющуюся от белка. В этом смысле поведение ретинохрома противоположно поведению родопсина. Можно думать, что ретинохром катализирует
PffffonniH
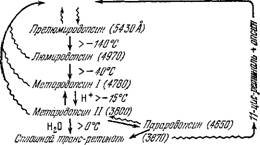
Рис. 7.30. Промежуточные стадии при выцветании и регенерации родопсина
Волнистые линии—действие света, прямые—темиовое превращение.
4
Опоин
Изомеризацию ретиналя и, тем самым, способствует реконструкции выцветшего родопсина [128].
В работе [129] было показано, что выцветание и регенерация родопсина in vitro зависят от частоты коротких вспышек лазерного освещения. Поглощается лишь свет, поляризация которого отвечает определенной ориентации молекул родопсина. Тем самым существенно соотношение между частотой вспышек и временем поворота молекул родопсина в растворе.
Ценная информация об электронных переходах в ретинале получена в исследованиях флуоресценции (см., например, [130]). Изучение флуоресценции родопсина, внешних сегментов палочек как целостных систем и модельного соединения — N-рети- нил—опсина позволило выявить особенности переноса энергии между соседними молекулами пигмента [131]. С этими явлениями связан ряд интересных и важных проблем биомолекулярной оптики.
Различные формы зрительных пигментов характеризуются различными спектрами поглощения. Эти' различия не сводятся к указанным в табл. 7.5. Полоса поглощения хромофора существенно зависит от его взаимодействия с опсином и, следова-
Тельно, от состояния липопротеина и его видовых особенностей. Так, сетчатка лягушки содержит два типа палочек («красные» и «зеленые») и два типа колбочек. Красные палочки содержат «классический» родопсин, зеленые — родопсин с полосой поглощения, сдвинутой в коротковолновую сторону. Спектральная чувствительность зрительных пигментов, как правило, коррелирует со спектральным составом света в среде, в которой существует данный организм. При переходе от голубоватой морской воды к желтоватой пресной воде родопсин в палочках рыб постепенно замещается порфиропсином. Сетчатка морских рыб имеет максимум чувствительности вблизи 5050 А, пресноводных — вблизи 5400 А (см. [132]).
Пигментная система фоторецепторов сходна с пигментной системой фотосинтеза в том отношении, что в обоих случаях у ограниченного числа пигментов встречаются самые разные спектральные чувствительности, что объясняется разнообразием их взаимодействий с белками.
В данной главе рассматриваются лишь взаимодействие каро- тиноидов со светом, их роль в фотосинтезе и фоторецепции. Однако этим не исчерпывается участие каротиноидов в биологических процессах. Способность каротиноидов к цис-транс-язоыери - зации существенна для метаболизма. Наличие большого числа - ненасыщенных двойных связей определяет легкую окисляемость этих соединений и, следовательно, участие в окислительно-восстановительных реакциях. Соответственно каротиноиды функционируют в темновой биологии. Они фигурируют в ряде тканей животных, в частности, в нейронах моллюсков, в тканях воспроизводящих органов как беспозвоночных, так и позвоночных (в том числе и у человека). Каротиноиды функциональны в окислительном метаболизме [133, 134]. Если биохимическая эволюция приводит к синтезу той или иной группы органических соединений, то они используются в живой природе многообразно— везде, где это оптимизирует существование организма.
Факты и гипотезы, кратко изложенные в настоящем параграфе, ставят ряд физических задач, еще далеких от своего решения. Структура опсина, а значит, и родопсина изучена недостаточно. Поэтому пока невозможно построение детализированной модели родопсина и его превращений на свету. Значительный интерес представила бы квантовая химия этих явлений, еще не построенная.
Наибольший интерес представляет установление связи между событиями, происходящими в родопсине, и возникновением электрических потенциалов в последовательных нейронах сетчатки, завершающееся посылкой нервного импульса в мозг. Об этом почти ничего не известно. Далее необходимо изучить строение и свойства мембран фоторецепторных клеток. Очевидно, что без такого рассмотрения нельзя даже подойти к решению указанных вопросов. Дальнейшие подробности, относящиеся к фоторецепции на молекулярном уровне, см. в [109, 135].
Для понимания молекулярного механизма фоторецепции существенны исследования кинетики темновых реакций зрительного пигмента, протекающих вслед за световым воздействием. Согласно Абрахамсону [136], целесообразно разделять эти реакции на ранние и поздние стадии. К первым относятся переходы прелюмиродопсин люмиродопсин метародопсин I —* метаро - допсин II. Они происходят быстро, как установлено с помощью импульсного фотолиза (см. [137—139]). Предполагается, что последний переход, сопровождаемый конформационными изменениями, и приводит к изменению проницаемости фоторецептор - ной мембраны и к генерации импульса. Это удалось подтвердить экспериментально [140]. Процессы второй стадии, следующие за указанными, по-видимому, не имеют отношения к формированию первичного электрического ответа фоторецептора и, возможно, играют роль в регенерации родопсина [141]. Они происходят очень медленно (секунды и даже минуты) и характеризуются простой кинетикой. Напротив, кинетика перехода метародопсин I—*■ метародопсин II, изученная методом импульсного фотолиза, сложна, она аппроксимируется суммой не менее, чем трех экспонент [142]. То же относится к реакциям прелюмиродопсин —»люмиродопсин [143] и люмиродопсин метародопсин I [142]. Были опубликованы и другие данные. В наиболее подробном исследовании перехода прелюмиродопсин -> люмиродопсин, проведенном методом импульсного фотолиза в средах с различной вязкостью, установлено, что кинетика перехода аппроксимируется суммой трех экспонент, т, е. процесс является суммой параллельных реакций первого порядка. Константы скоростей перехода не зависят от вязкости [143, 144]. Есть основания думать, что сложная кинетика является универсальным свойством ранних темновых реакций как in vitro, так и in vivo [145]. Причины сложной кинетики и ее биологическая значимость остаются пока неясными.