ИММУНИТЕТ
Специфические процессы клеточной дифференцировки ответственны за иммунитет, в частности, за продукцию антител в организмах позвоночных. Имеющаяся сейчас информация об этих процессах позволяет сформулировать физические проблемы, относящиеся к иммунитету, и подойти к их решению.
Строение и функции антител (AT) описаны в § 1.3. Природа взаимодействия антител с антигенами (АГ) в основном установлена. Вторая главная проблема иммунологии — проблема возникновения иммунитета — гораздо сложнее.
Хорошо известно, что иммунная система животного служит для борьбы с болезнетворными микроорганизмами. Можно было бы думать, что эволюционное происхождение системы специфического иммунитета связано с этой жизненно важной задачей. Современные представления об иммунитете приписывают ему более широкую функцию контроля за генетическим постоянством клеток организма. Главной задачей иммунной системы, возможно, является устранение мутантных (в частности, раковых) клеток из организма многоклеточного животного. Работа специфической иммунной системы выражается в том, что в ответ на появление генетически чужеродного материала (антигена) организм вырабатывает специфические реактивные клетки (клеточный иммунный ответ) и специфические антитела (гуморальный иммунный ответ). Как специфические реактивные клетки, так и антитела могут циркулировать в организме и специфически взаимодействовать с АГ. В результате этого взаимодействия чужеродный материал может быть инактивирован, разрушен или фагоцитирован клетками ретикуло-эндотелиальной системы. Современные представления об иммунитете основываются на кло- нально-селекционной теории Бернета [146—149]. Этой теории предшествовали качественные идеи, высказанные Ерне [150]. В организме производятся лимфоциты, каждый из которых чувствителен к одному АГ или к нескольким родственным АГ. Возникают лимфоциты, чувствительные практически к любым АГ, в том числе и к таким, с которыми организм никогда не встречается в условиях своего биологического существования. Это определяется наличием на мембранах лимфоцитов специфических рецепторов, имеющих высокое сродство к определенному антигену. Антиген действует как фактор селекции, стимулирующий развитие клонов иммунологически активных клеток из лимфоцитов, имеющих рецепторы к данному антигену. Таким образом, лимфоцит унипотентен в смысле взаимодействия с АГ. Мы не останавливаемся здесь на генетических факторах, определяющих синтез АТ-подобных белков рецепторов (см. [151 —153]).
Наряду с клонально-селекционной теорией следует упомянуть о гипотезе матричного действия АГ, предложенной Гау - ровицем [154, 155]. Согласно этой гипотезе, роль АГ состоит в стимуляции определенных генов внутри лимфоцита, который мультипотентен. АГ есть внутриклеточный фактор селекции, AT надолго сохраняются в клетке. Сциллард считал, что синтез AT подобен индуцированному синтезу ферментов (см. § 1.6), и построил соответствующую модельную теорию [156]. АГ трактуется в ней как индуктор, снимающий репрессию синтеза специфического у"гл°булина. Однако клонально-селекционная теория лучше обоснована и подтверждена многочисленными фактами.
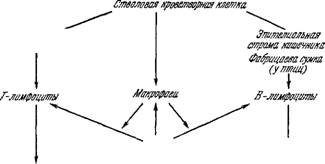
Установлено, что основными продуцентами антител являются зрелые плазматические клетки [149, 151, 152, 157]. Специфичность продуцируемых AT совпадает со специфичностью рецепторов, находящихся на поверхности клеток-предшественников [157]. Предшественниками плазматических клеток, клетками, воспринимающими антигенный стимул, являются так называемые В-клетки, относящиеся к малым лимфоцитам и образующиеся в результате дифференцировки стволовых кроветворных клеток. Роль рецепторов в В-клетках играют "иммуноглобулины (104 — 105 молекул на клетку), В-клетки сами по себе не делятся, они приобретают способность к пролиферации только после бласт-трансформации, т. е. после превращения в так называемые бласты (у-клетки) под действием АГ [149, 151]. Бласт« трансформация происходит по истечении латентного периода'* длящегося 24—48 часов. г/-клетки интенсивно пролиферируют. Часть у-клеток дает начало клонам плазматических клеток (z-клетки). Данный клон z-клеток вырабатывает антитела, спе^ цифичность которых совпадает со специфичностью рецепторов на поверхности клеток-предшественников [149, 152, 157, 158]. Зрелые z-клетки к дальнейшему делению не способны, они существуют в течение нескольких десятков часов.
Стимулированные антигеном В-лимфоциты могут, наряду с образованием клона плазматических клеток, привести к образованию так называемых клеток иммунной памяти [146, 147, 151, 152]. Если организм отвечает на АГ, воздействию которого он подвергался ранее, то обычно его иммунный ответ оказы* вается более быстрым и сильным. Это явление называется иммунной памятью. Оно связано с увеличением числа клеток, спо
собных отвечать на повторный антигенный стимул аналогично первоначальным В-лимфоцитам [157].
Второй популяцией лимфоцитов, способных к специфическому распознаванию генетически чужеродного материала, являются так называемые Т-клетки. Они, так же как и В-клетки, возникают из стволовых клеток, но в своем развитии обязательно проходят через тимус. Часть 7'-клеток ответственна за клеточные иммунные реакции. В ответ на антигенный стимул
Элитшашая строма тимуса
Еласты (уТ-ттт)
АГ
Т-В-талерация
-шет/ги)
Г-B-mmm памяти \
И /ШМЯИШ • ^
1Г
Зрфеторте югетт тлага омму, (z-штт)
Тегпачша
АГ
Рис. 9.19. Схема событий, вызываемых введением антигена.
Они дифференцируются в специфические реактивные клетки (так называемые киллеры). Две другие подпопуляции Г-кле - ток (хелперы и супрессоры) играют регуляторную роль в развитии гуморального (а, возможно, и клеточного) иммунного ответа. Степень участия регуляторных 7'-клеток в гуморальной иммунной реакции зависит от природы антигена. Существуют так называемые тимус-независимые антигены, способные вызывать нормальный ответ без помощи 7'-клеток ([152], см. также [159]).
На рис. 9.19 показана схема описанных событий [152].
Одна из важных задач биофизики состоит в построении физико-математической модели явлений, происходящих при развитии
18 M. В. Волькенштейн
Иммунного ответа. Естественно, что такая модель не должна описывать все детали процесса, еще недостаточно изученные. Модель предназначена для качественного и полуколичественного рассмотрения его важнейших особенностей. Соответствующие попытки имеются в литературе. Модель, предложенная в [160], описывает развитие клона АТ-продуцирующих клеток, т. е. ограничивается лишь частью процесса, не рассматривая им-, мунную реакцию в целом. Более сложная модель представлена в работе [161]. Другая модель предложена в работах [162, 163]. Однако она сформулирована в абстрактных терминах, затрудняющих биологическую интерпретацию. Наиболее разработаны модели Белла [164, 165]. Модели, предложенные в [164], дают детальное описание иммунной реакции, используя весьма конкретные предположения о механизмах, которые, к сожалению, в некоторых случаях не установлены достоверно. Расчеты, выполняемые на ЭВМ, приведены в согласие с экспериментальными данными по иммунным реакциям у кроликов. В более поздней работе [165] ставится задача построения достаточно простой модели, допускающей качественное исследование. Эта модель получила дальнейшее развитие в работах Пимблея [166]. В перечисленных работах (за исключением [160]) не учитывались прямо эффекты запаздывания, связанные с латентными фазами в процессах дифференцировки клеток.
Изложим здесь основные результаты исследования, проведенного в работах [167]. Задача состояла в построении модели, опи-г сывающей работу иммунной системы в целом и позволяющей с помощью качественного исследования^ предсказать характер течения иммунной реакции в различных^ условиях с тем, чтобы выработать тактику целенаправленного вмешательства в ход иммунной реакции. Модель пока ограничивается рассмотрением гуморальной иммунной реакции.
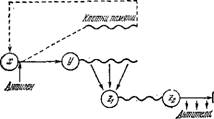
Рис. 9.20. Схема развития АТ-продуцирующих клеток.
Волнистые линии означают. пролиферацию.
На рис. 9.20 показана используемая схема развития клона АТ-продуцирующих клеток. Как уже отмечалось, плазматические клетки (z) являются основными продуцентами антител. Развитие плазматических клеток из В-лимфоцитов требует приблизительно 3—4 дня (см., например, [151]). Поэтому иммунный ответ, состоящий в выработке AT, запаздывает по отношению к моменту стимуляции. Формирование клеток иммунной памяти
Требует, по-видимому, еще большего времени. Запаздывание в производстве AT и в формировании иммунной памяти является существенной чертой иммунной реакции.
Во-первых, продолжительность запаздывания не мала по сравнению с характерными временами процесса. Во-вторых, математическое исследование, проведенное в работах [167], показывает, что продолжительность запаздывания может быть решающей для характера течения иммунной реакции. В указанных работах запаздывание учитывается в упрощенной форме сосредоточенного запаздывания.
(9.55)
Скорость выработки антител пропорциональна наличному количеству плазматических клеток, которое определяется числом В-лимфоцитов, стимулированных ранее, в момент времени, отстоящий от текущего на время запаздывания tr. Аналогично, выработка клеток памяти определяется числом актов стимуляции В-лимфоцитов в момент, отстоящий от текущего на определенное время запаздывания tm. Процесс описывается следующей системой дифференциальных уравнений с запаздывающим аргументом:
X = J — x~lx(t) — Рх (t)g (t) + Атх (t - tm) g(t - tm) Є (t - tm),
G = Kg(t)-Qh(t)g(t),
H = Arx ({ - tr) g{t - tr) 0 (i - tr) - Rh {t) g (t) - Sh (0.
Здесь x, g, h — соответственно количества В-лимфоцитов, антигена и антител;
![]()
Если t < 0, если t ^ 0,
(9.56)
/ — скорость пополнения популяции 5-лимфоцитов в результате дифференцировки стволовых клеток, т — среднее время жизни 5-лимфоцитов. Члены —Px(t)g (t) и Атх (t — tm)g (t — tm)Q (t — tm) описывают соответственно уменьшение популяции В-лимфоцитов в результате контакта с АГ и ее пополнение вследствие формирования клеток иммунной памяти. Клетки памяти считаются идентичными первоначальным В-лимфоцитам, К характеризует скорость репродукции АГ в условиях организма (К < 0 в случае неразмножающегося АГ). Члены —Qh(t) g(t) и —Rh(t)g(t) описывают соответственно уменьшение количеств АГ и AT в результате их взаимодействия. Член Arx(t — tr)g(t — tr)Q(t — tr) описывает производство AT, S характеризует скорость распада AT.
Параметры Р, Ат, Ar, tr, tm, которые в дальнейшем считаются постоянными, в действительности могут зависеть от динамики численности регуляторных Г-клеток. Такое упрощение корректно при описании иммунного ответа на тимус-независимый АГ или
IS*
При быстром достижении стационарного уровня количества РеГуляторних клеток. Рассмотрение системы (9.55) с постоянными параметрами необходимо также как первый шаг в изучении поведения полной системы, учитывающей динамику регуляторных клеток.
Уравнения (9.55) описывают систему специфического гуморального иммунитета. Здесь не учитывается спонтанный синтез антител и не рассматривается в явном виде действие неспецифических факторов защиты организма. Отметим только, что указанные механизмы, по-видимому, создают первый барьер для инфекции.
Уравнения (9.55) позволяют при разумных значениях параметров правильно описать динамику иммунного ответа на введение неразмножающегося (К < 0) АГ. Однако наиболее интересным представляется изучение иммунной реакции в случае размножающегося АГ. Далее, не приводя математических выкладок, мы опишем характерные особенности решений системы (9.55) при К > 0. Если
(.IxArQ/KR)1/г - 1 < (Sx (Р - Am)/R)'!\ (9.57)
Что соответствует большой скорости расходования В-лимфоци- тов, система (9.55) имеет единственное стационарное решение
Х0 = Jx, g0 = 0, fto = 0. (9.58)
Такое стационарное состояние без антигена и специфических антител неустойчиво. Если выполнено условие (9.57), то при попадании размножающегося АГ в организм, его количество нарастает неограниченно.
Если неравенство (9.57) нарушено и
Р > Ат, (9.59)
То, помимо неустойчивого стационарного состояния (9.58), система (9.55) имеет следующие стационарные решения:
2Arq • і
(9.60)
KR
Xi = [JxArQ/KR + 1 - (Р - Ат) Sx/R + DV2] ■ gl = [JxArQ/KR - 1 -(P-Am) Sx/R - Dv°] -2 (p _ Am)- , h = K/Q
V,1 KR
*2 = [JxArQ/KR +\-(P-Am) Sx/R - DVl]
2ArQ '
(9.61)
2{P-Am)x '
G2 = [JxArQ/KR - 1 - (P - AJ Sx/R + D"2] h2=KjQ,
Здесь
D = [JxArQ/KR + 1 ~(Р~Ат) Sx/RY - 4JxArQ/KR.
Стационарные точки (9.60), (9.61) слиты в одну, если (JxArQ/KR)'!* — l=[(P — Am)Sx/R],'h и различны (*, > g, < <g2), если выполняется неравенство, обратное (9.57). Если (Р — Ат) стремится к нулю, то Xi-*Jx, gi —*S/[R(JxArQ/KR—1)] и Х2 KR/AQ, Как показало исследование стандарт
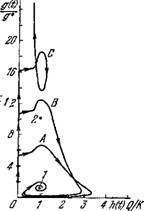
Ными методами, стационарная точка (9.61), соответствующая большему количеству АГ, неустойчива. Характер стационарной
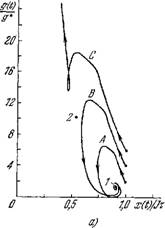
Рис. 9.21. Проекции фазовых траекторий системы (9.55) на плоскость
(х, g) (а) и \h, g) (б). Траектории построены для < ЛС = 1; х (0) = /т; ft (0) = 0; fxArQ/KR = 2\ ТЛГ=2; PS/RKГ = 0,04; Ат = 0; SIK = 3 и различных начальных количеств антигена g (0)/g*, равных 2 (Л), 4 (В) и 6 (С). g*=s/[R (harqikr— 1)] 1 н 2—стационарные точки.
Точки (9.60) зависит от продолжительности запаздываний. Она устойчива прн малых запаздываниях. В этом случае в зависимости от начального количества АГ возможно: а) стремление решений системы к стационарному состоянию (9.60); такое решение указывает на возможность длительного сосуществования инфекции со специфическими антителами (состояние носитель- ства); б) неограниченный рост количества АГ (рис. 9.21). По мере увеличения запаздываний уменьшается минимальное начальное количество АГ g(0), приводящее к неограниченному размножению АГ. Кроме того, стационарная точка (9.60) становится неустойчивой. Поэтому при малых начальных количествах АГ возможно возникновение предельного цикла — перио
дическое течение болезни (рис. 9.22). При достаточно большом запаздывании в формировании иммунного ответа (tr) количество АГ растет неограниченно, независимо от начальных
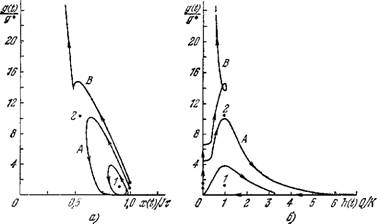
Рис. 9.22. Проекции фазовых траекторий системы (9.55) на плоскость (х, g) (а)
И (A. g) (б).
Траектории построены для < К=1,5 и g (0)/g* = l (кривые A), g(0)/g* = l,5 (кривые В). Значения остальных параметров и начальные данные те же. что и для рис. 9.21.
Условий. При Р > Ат условие, обеспечивающее неограниченный рост количества АГ, имеет вид
/Т Ktr ехр (- Юг) < ехр (- 1), Ktr> 1 • (9.62)
Рассмотрим теперь ситуацию, когда интенсивность формирования клеток памяти больше интенсивности расходования В-лим - фоцитов в результате контакта с АГ, т. е.
Ат > Р. (9.63)
В этом случае система (9.55) обладает единственной положительной стационарной точкой (9.60). Необходимое и достаточное условие устойчивости этой стационарной точки при tr = = tm = 0 имеет вид
В силу (9.64) при tr = tm — 0 стационарная точка (9.60) (Ат > Р) устойчива, в частности при St > 1 (так как Х\ > > KR/AQ).
Если стационарная точка (9.60) (Ат > Р) устойчива при нулевых запаздываниях, она устойчива и при достаточно малых запаздываниях. Увеличение запаздываний неизбежно приводит к неустойчивости стационарного состояния. Для малого запаздывания в формировании иммунной памяти, такого, что
Атехр(-Ют)>Р, (9.65)
Решения системы (9.55) ограничены. Следовательно, если (9.65) выполнено, то возможны два типа решений.
А) Стремление к стационарному состоянию — стационарная точка (9.60) (Ат > Р) устойчива; б) циклические решения — стационарная точка (9.60) (Ат > Р) неустойчива. Если tm столь велико, что условие (9.65) нарушено, то можно показать, что для любых tr достаточно большие начальные количества АГ ведут к неограниченному росту его количества. Более того, для достаточно больших значений tr количество АГ растет неограниченно при любых исходных количествах АГ.
Для более детального изучения зависимости течения иммунной реакции от значений параметров удобно вместо (9.55) рассмотреть более простые уравнения. Вырабатываемые системой АТ имеют высокое сродство к АГ. Поэтому до тех пор, пока количество АГ не слишком мало, появляющиеся АТ быстро реагируют с АГ. Действительно, заметные количества АТ наблюдаются лишь после удаления АГ [168]. Это обстоятельство позволяет аппроксимировать систему (9.55) уравнениями
X = 7 - т-1* (t) - Рх (t) g (t) + Атх (t - tm) g(t - tm) Q(t — tm), g = Kg{t)-Ar-Q-x(t - tr) g(t — tr) Q{t - tr).
(9.66)
Уравнения (9.66) описывают «борьбу» между В-лимфоцитами и антигеном, причем быстро действующий медиатор — антитела — не представлен в них явно. Уравнения (9.66) сходны с уравнениями Вольтерра для системы «хищник — жертва» (см. § 8.3), если Ат > Р. Отличие от уравнений Вольтерра состоит в наличии запаздывания в нелинейных членах. В нашем случае АГ играет роль «жертвы». Замена уравнений (9.55) уравнениями (9.66) формально соответствует бесконечной скорости взаимодействия АТ с АГ. Это значит, что уравнения (9.66) не выполняются при g(t), близких к нулю.
Однако расчеты показывают, что уравнения (9.66) правильно описывают характерные черты иммунной реакции. Обращение g(t) в нуль, согласно уравнениям (9.66), соответствует большой вероятности уничтожения АГ в реальном процессе. Особенности течения иммунной реакции, связанные с конечной скоростью взаимодействия АГ с АТ, рассмотрены подробно в [167].
В рамках системы (9.66) найдены условия уничтожения АГ или неограниченного роста его количества.
Эти условия, в частности, показывают роль запаздываний в развитии иммунной реакции. Так, для эффективной супрессии быстро размножающегося АГ запаздывание в развитии иммунного ответа tr должно быть не слишком малым и не слишком большим.
Уравнения (9.66) имеют ненулевую стационарную точку
Хо = к/лг> g0 = (t — ArJx/K)/[Am х (1 - P/Am)l (9.67)
Физический смысл имеют лишь значения go > 0. Устойчивость этой точки исследуется обычным методом линеаризации уравнений (см. стр. 397). Переходя к безразмерным переменным | = х/хо, г] — g/go, получаем вместо (9.66) уравнения
К~ л = Ті (0 - l(t - tr) ті (t - tr) Є {t - tr), j
Xi = a-l{t)-bl (t) т| (0 + c| {t - tm) n (t-tm) 9 (t-tm), )
(9.68)
Где a = JxAr/K, b =(l — а)Р/ (Am — P), с = bAJ{Am — P), a, b,c — положительны и связаны условием а — b + с= 1. Стационарная точка имеет координаты г) = 1, 1. Характеристические числа Я являются корнями квазиполинома
(1 - К/К)(1 + й + Ят)-(1 +Ят) ехр (— Ur) —
- с (1 - УК) ехр (- Мп) = 0. (9.69)
При нулевом запаздывании (tr = tm = 0) и а > 0 оба корня имеют отрицательные вещественные части и точка асимптотически устойчива. Если Q = 0, то оба корня чисто мнимые. Если а > 0, то стабильность сохраняется для достаточно малых ненулевых tr, tm. Их возрастание нарушает устойчивость. При а = 0 любые отличные от нуля значения U и tm приводят к неустойчивости. Если а = b = 0, то уравнения (9.68) принимают вид
Эти уравнения отличаются от уравнений Вольтерра — Лотка только наличием запаздываний в нелинейных членах. Колебательный характер системы, сохраняющийся и при ненулевых значениях tr и tm, проявляется в циклической кинетике иммунной реакции.
На рис. 9.23 показаны примеры решений уравнений (9.70). Можно было бы ожидать, что увеличение запаздывания в формировании иммунной памяти tm должно всегда приводить к уве
личению времени, требуемого для элиминации АГ. В действительности, однако, нарастание неустойчивости с ростом запаздывания может привести к сокращению времени реакции благодаря уменьшению числа обходов стационарной точки (см. рис. 9.23).
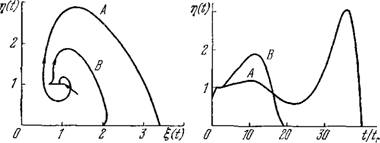
Рис. 9.23. Решения уравнений (9.70) в безразмерных единицах при trK = trx~l = = 0,3; |(0) = 1,4; ті (0) = 0,75 и для tm, равных 1,5\tr (Л) или 2,5 tr (В).
Учтем теперь конечную скорость реакции АТ и АГ, считая, что количество В-лимфоцитов мало меняется в ходе иммунной реакции, т. е. х(/)?»х(0). Уравнения (9.55) принимают форму
G = W)-Qh{t)g(t), j
H = Ag(t - tr) 9(t - tr) - Rg(t) hit) - Sh(t), ) где A = Arx(0). Если
KR/AQ < 1,
(9.71)
(9.72)
Система (9.71) имеет две стационарные точки (0,0) и
(9.73)
Стационарная точка (0, 0) неустойчива, характер стационарной точки (9.73) зависит от параметров и, в частности, от запаздывания tr. Кривая, разделяющая области устойчивости и неустойчивости стационарной точки в плоскости (trK, trS), задается параметрически следующим образом:
TrK-
У. о — П - KR/AQ) у sin у
Cos у — KR/AQ '
(9.74)
Sin у
0<*/<Arccos (KR/AQ).
В частности, стационарная точка (9.73) устойчива при trK < 1 и неустойчива при trK> я/2 (для любого KR/AQ < 1).
Система (9.71) не допускает неограниченного роста количества антител (h(t)). Количество АГ растет неограниченно при выполнении1 одного из следующих условий:
> 1
AQ
(9.76)
KR
(9.75)
Или
AQ
JrfctrKexp(-Ktr)<l и Ktr> 1.
Е(,ли (9.75) и одно из неравенств (9.76) нарушено, то количество АГ ограничено.
M, L 3
Итак, при выполнении условия (9.75), когда система (9.71) обладает только нулевой стационарной точкой, количество АГ неограниченно нарастает. В условиях (9.72), когда система обладает двумя стационарными точками, пространство параметров
|
Trs |
|||
|
Д |
|||
|
+ |
|||
|
8 |
|||
|
I |
11 |
III |
|
|
Б |
- |
! * |
|
|
В + |
|||
|
4 |
|||
|
A |
|||
|
+ |
|||
|
2 |
- |
||
|
І |
• |
1L 2 М 3 trK О Q2 0,40,50,6 0,8 1,0 КК/АО А) 'Б;
Рис. 9.24. Разбиение плоскости параметров (trK, trS) на области, соответствующие различным режимам системы (9.71) (Л), и значения характерных точек L и М разбиения в зависимости от KR/AQ (Б). Точки а, б, в, г, д соответствуют фазовым траекториям, приведенным на рис. 9.25.
(trK, trS, KR/AQ) распадается на области, соответствующие различным режимам реакции. На рис. 9.24, Л показано разбиение плоскости параметров (trK, trS) при KR/AQ = 0,5. В области / стационарная точка (9.73) устойчива, количество АГ ограничено; в области // стационарная точка (9.73) неустойчива, количество АГ неограниченно нарастает.
Разбиение выполнено на основе условий (9.74) и (9.76). Видно, что с увеличением запаздывания tT система переходит из области / в // и далее в ///. На рис. 9.24, Б приведены значения L и М (см. рис. 9.24, А) в зависимости от KR/AQ:
L = Arc cos (KR/AQ)/[ 1 - (KR/AQ)2]'1', Ме~м = , M> 1.
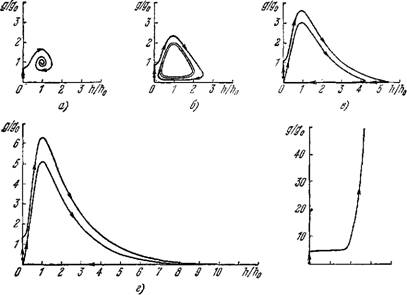
На рис. 9.25 приведены примеры фазовых траекторий системы (9.71), полученные с помощью ЭВМ. Соответствующие значения параметров обозначены на рис. 9.24, А крестиками. Рис. 9.24, А (область /, устойчивая стационарная точка) соответствует такому течению болезни, когда, начиная с некоторого
О 0,05 0,1 Ь/!)в 3)
Рис. 9.25. Фазовые траектории системы (9.71) в безразмерных переменных g/go, h/h0 (см. (9.73)) для KR/AQ = 0,5; S/K = 3 и значений запаздыва - ' ния trK, равных I (я), 1,25 (б), 1,5 (в), 1,75 (г) и 3 (д).
Момента, болезнь не прогрессирует, а количество АГ в организме практически постоянно (организм становится носителем инфекции). Если
S KR /(. KR \
Достаточно мало, то стремление решений системы к стационарному состоянию соответствует, по-видимому, выздоровлению. В области // (см. рис. 9.24, Л) система имеет предельный цикл (см. рис. 9.25,6 — г), что соответствует периодическому течению болезни. С увеличением запаздывания амплитуда колебаний увеличивается, а минимальное количество АГ уменьшается. При этом доля времени, в течение которого количество АГ близко к нулю, растет (0,5 от продолжительности цикла в случае в и
0,7 — в случае г). Минимальные количества АГ для случаев в, г равны соответственно 8- Ю-4 и 8- Ю-10 от стационарного.
При учете конечной скорости реакции АГ с АТ в рамках детерминистических уравнений (9.55), (9.71) полная элиминация размножающегося АГ невозможна. В действительности, если согласно детерминистическим уравнениям достигаются малые количества АГ, то должен проявиться дискретный стохастический характер процесса размножения и гибели микроорганизмов, что делает возможным полное уничтожение АГ. Циклический характер решений согласно детерминистическим уравнениям указывает на возможность рецидивов в ходе заболевания. В [167] предложен метод для оценки вероятности уничтожения А Г. На основе этого метода был исследован вопрос об оптимальной тактике лечения с точки зрения предотвращения рецидивов. Показано, что наиболее целесообразно вводить специфические АТ (сыворотку) в момент максимального количества собственных АТ. При использовании антибиотиков наибольший эффект достигается, если начинать их применение в тот момент, когда количество АГ максимально. Слишком раннее применение как антибиотиков, так и антител ослабляет собственный иммунный ответ организма, что приводит к увеличению вероятности рецидива. Мо-, дель также показывает, что в случае слабых хронических инфекций одним из приемов лечения может быть преднамеренный перевод заболеваний в острую форму, что позволяет активизировать иммунный ответ организма и тем самым увеличить вероятность полной элиминации АГ.
Проблемы возникновения иммунитета — проблемы развития. Можно думать, что принципы трактовки иммунитета, такие, как учет запаздывания, а также рассмотрение фазовых переходов щ неравновесных мультистационарных системах (см. § 8.1,2) по| могут математическому моделированию процессов развития — онтогенеза, канцерогенеза, биологической эволюции.
[1] (р, т)=c;'eqc2\... (2.7)
[2] В тех случаях, когда это не может привести к недоразумениям, сами реагенты и их концентрации обозначаются одинаково.
[3] Здесь и далее сами частицы мы также будем обозначать через А, В и т. д.
X'-
Рис. 8.31.
Ингибированием.
Гиба, для которой dx/dv — 0. Если такая нелинейность имеет место, то возникает ряд специфических явлений, в частности, множественные стационарные состояния, их неустойчивость, ги - стерезисный характер зависимости v от параметров системы и