ФЕРМЕНТАТИВНЫЕ ПРОЦЕССЫ ФОТОСИНТЕЗА
Основными продуктами двух первичных фотохимических реакций являются восстановленное промежуточное соединение ХН и окисленное Z (см. рис. 7.1). Окислитель Z окисляет Н20 до 02, ХН восстанавливает С02 до углевода. Процессы эти протекают с участием ферментов. Ферментативная система, участвующая в выделении 02, содержит марганец. Установлено, что ион марганца участвует в реакции, фотокатализируемой ФС// (см. табл. 7.3). Пара Мп3+/Мп2+ характеризуется высоким окислительно-восстановительным потенциалом (около 1,5 В). Можно предположить, что Мп2-Н испытывает фотоокисление до Мп3+ во второй световой реакции, а затем Мп3+ окисляет воду в темновой реакции:
2Мп3+ + Н20 —* 1/2О2 + 2Мп2+ + 2Н+
Для чего нужно более чем +0,75эВ. Конечно, речь здесь идет о Мп как кофакторе фермента.
Таким образом, предположительно Z есть фермент, содержащий трехвалентный марганец. Предполагалось, что X это НАДФ+ (пара НАДФ+/НАДФ-Н имеет потенциал —0,35 В). В действительности имеется не менее чем два предшественника— железосодержащий белок ферредоксин ФД и фермент ферредоксин-НАДФ-редуктаза. Установлено, что освещенные хлоропласты восстанавливают пигмент вплоть до —0,6 В [44]. Предположительно потенциал X близок к этой величине. Схема возможных реакций [1] записывается в виде
X ФД ФД-НАДФ - ^ НАДФ+
ХН Восст. ФД * редуктаза НАДФ-Н '
—0,6В -0,4В —0,35В
Гораздо лучше известен химический путь, ведущий от С02 (восстанавливаемого такими веществами, как НАДФ-Н) к углеводу.
Этот путь был установлен Кальвином и его сотрудниками, широко использовавшими радиоактивную метку — углерод С14 [54—56].
Стехиометрическое уравнение, описывающее брутто-реак - цию фиксации двуокиси углерода, имеет вид
6 РДФ + 6 С02 + 18 АТФ + 12 НАДФ-Н —►
—>6 РДФ + ГФ +18 АДФ + 17 Ф„ + 12 НАДФ.
Здесь РДФ — рибозо-1,5-дифосфат
О ОН ОН
II I 1
(Р)ОСН2—С—С— С—СН20(Р),
Н н
ГФ — гексозофосфат. РДФ является первичным акцептором С02. Путь углерода в фотосинтезе — последовательности тем - новых реакций — описывается так называемым циклом Кальвина— Бассама. Этот цикл состоит из 13 стадий, катализируемых соответствующими ферментами (см. [55]). Суммарная реакция написана выше. В сокращенных обозначениях
6С5 + 6С, =6С5 + С6, где индексы обозначают число атомов углерода в соединении.
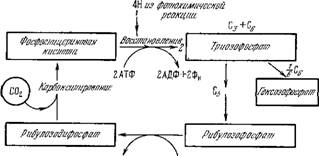
Ацф+фн атф
Рис. 7.17. Упрощенная схема цикла превращений углерода по Кальвину.
Упрощенная схема цикла Кальвина показана на рис. 7.17, более детализированная его схема — на рис. 7.18. Результирующий гексозофосфат гидролизуется с отщеплением фосфата. На образование одной молекулы гексозы из 6 молекул С02 расходуется энергия 18 молекул АТФ. Именно эти молекулы образуются при переносе электронов в процессе фотосинтеза —
происходит фотофосфорилирование АДФ. Суммарная реакция имеет вид
НАДФ + «'АДФ + п'Ф„ + пПа> —>- НАДФ-Н + «'АТФ + 02 + («' — 2) Н20.
Эта реакция реализуется в полной системе с участием пигментных систем и цепи переноса электронов. Главные физические
J СО,
ЖЧ ЖЧ.
П
ФГК ФГК ФГК ФГК ФГК ФГК
Вт
■ В НАДФ-Н
ФГА ФГА ФГА ФГА ФГА ФГА
І
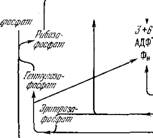
J АТФ
Лсилулозв-
РиВулозофосфат ■ РиВулозофосфат РиВулвзвфвсфат
В НАДФ ■
А
<Дшкси - ицетв//-
Рис. 7.18. Путь углерода в фотосинтезе. ФГК—3-фосфоглицерат, ФГА—глицеральдегид-3-фосфат.
Проблемы фотосинтеза относятся к механизму фотофосфорили- рования, т. е. превращения световой энергии в химическую энергию макроэрга. Эти проблемы рассматриваются в следующих двух параграфах.
§ 7.6. ХЛОРОПЛАСТЫ
Как уже сказано, фотосинтез происходит в органоидах растительных клеток, именуемых хлоропластами. На рис. 7.19 приведена электронная микрофотография среза хлоропласта из листа кукурузы [57]. Хлоропласты имеют диаметры, варьирующие от 3 до 10 мкм, и толщину от 1,5 до 3 мкм. Таким образом, хлоропласт заполняет почти всю клетку зеленой водоросли. На рис. 7.19 в хлоропласте видны примерно параллельные ла - меллы, погруженные в более светлую строму. У высших растений ламеллы плотно упакованы параллельно друг другу и образуют стопки, называемые гранами. Ламеллы представляют собой сечения уплощенных замкнутых мешочков — тилакоидов, имеющих диаметр около 5000 А. Число тилакоидов в хлоропласте порядка 1000. Модель структуры хлоропласта, предложенная Вейером [58], показана на рис. 7.20 [57]. Мембрана тила - коида имеет толщину около 100 А-
Ряд фактов показывает, что все процессы фотосинтеза локализованы в тилакоидных мембранах. Именно в них содержатся активные пигменты, прежде всего хлорофилл. Фрагменты тилакоидов реализуют реакцию Хилла и фотофосфорили - рование.
Из фактов, изложенных выше, следует, что молекулы хлорофилла в хлоропластах действуют независимо друг от друга, но
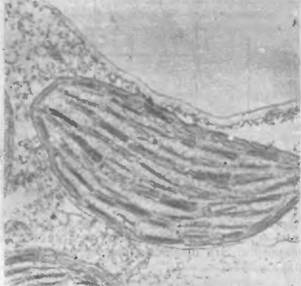
Рис. 7.19. Электронная микрофотография среза хлоропласта.
•і1".
Согласованно, что обусловливается, по-видимому, наличием определенных функциональных единиц, локализованных в ти - лакоидах. Установлено, что некоторая доля молекул Chi а, поглощающих свет вблизи 7000 А, ориентирована в хлоропласте определенным образом. Об этом свидетельствуют измерения дихроизма [59, 60]. Цитохром f, по-видимому, расположен близко к этим ориентированным молекулам хлорофилла. При освещении зеленых листьев поглощение в цитохроме f при 5530 А уменьшается, т. е. он окисляется. Это происходит и при низких температурах. Одновременно наблюдаются и изменения в спектре Chi а. Отметим, что при низких температурах затруднен транспорт электрона на большие расстояния. Отсюда можно заключить, что цитохром f каким-то образом ассоциирован с Chi а или с Р 700 [57, 61] (см. также § 7.7),
Как указывалось выше, фотосинтез происходит в двух фотохимических системах. Проблема пространственной локализации этих систем в хлоропластах очень актуальна.
При деструкции хлоропластов ультразвуком было установлено, что частицы с константой седиментации 38S, имеющие диаметр порядка 300 А, сохраняют способность к реакции Хилла [62]. Частицы объемом менее 15 • 105 А3 уже не активны [63]. Отсюда следует, что наименьшее число молекул хлорофилла, активных в фотосинтезе, равно 40—120 [57].
При освещении хлоропластов или целостных фо- тосинтезирующих организмов (водорослей) наблюдаются два сигнала ЭПР. Первый сигнал (R) представляет собой резкий пик, быстро возникающий и быстро исчезающий. Второй сигнал (S)—широкий, медленно возрастающий и еще медленнее исчезающий. /?-сиг - нал приписывается Chi а и, возможно, Р700, т. е. ФС/, S-сигнал — ФС // [64]. /?-си - гнал генерируется наименьшими частицами, получающимися при разрушении хлоропластов, напротив, S-сигнал исчезает уже тов [65].
Опыты по сегментации хлоропластов показывают, что фотосинтетическая активность действительно присуща отдельным тилакоидам (см. [57, 66]). Более точная локализация пигментных систем пока не установлена. Для этого нужно было бы провести опыты по реконструкции фотосинтетической системы из неактивных фрагментов.
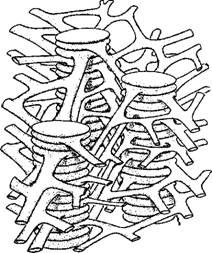
Рис. 7.20. Модель структуры хлоропласта.
Гораздо больших фрагмен-
Структурные исследования тилакоидов методом электронной микроскопии показывают, что тилакоиды содержат регулярные, кристаллоподобные системы плотно упакованных гранул [66, 67]. На рис. 7.21 показана электронная микрофотография среза тилакоида из листа шпината. На ней хорошо видны гранулы, размером 185 X 155 X ЮОА3. На некоторых микрофотографиях удается увидеть, что эти частицы в свою очередь построены из четырех или большего числа субъединиц. Молекулярный вес
гранулы оценивается в 2 • 106. Зная состав ламелл, можно, исходя из этой оценки, определить число молекул различных веществ в грануле. Соответствующие данные приведены в табл. 7.4 [67].
Число молекул хлорофилла, равное 230, находится в разумном согласии с независимой оценкой для фотосинтетической единицы (см. стр. 337).
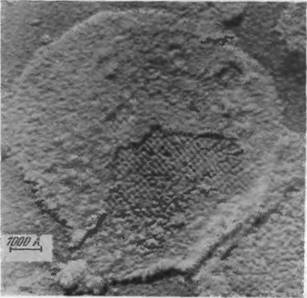
Рис. 7.21. Электронная микрофотография среза тилакоида.
Значение этих гранул снижается тем обстоятельством, что их упаковка варьирует в зависимости от условий роста растения. Частицы, обладающие размерами, близкими к указанным, способны реализовать реакцию Хилла, но не полный фотосинтез, даже если к ним добавлены растворимые компоненты хлоропластов [57].
Рассеяние рентгеновых лучей под малыми углами дает информацию о размерах ламелл [69]. Каждый тилакоид состоит из корпускулярного слоя, построенного из частиц диаметром 31—36 А. Внутри слоя находится непрерывный элемент толщиною в 42 А. Общая толщина тилакоида, состоящего из замкнутого корпускулярного слоя, окружающего замкнутый же двойной непрерывный слой, равна 178А. Корпускулы диаметром
Таблица 7.4
Состав гранулы из тилакоида шпината
|
Липидная фракция (числа молекул) |
А'іолекулярньїй вес |
Белковая фракция |
Молекулярный вес |
|
230 хлорофиллов |
206 400 |
Белок |
928 000 |
|
48 каротиноидов |
27 400 |
2 атома марганца |
110 |
|
48 хинонов |
31 800 |
12 атомов железа, |
|
|
В том числе содер |
|||
|
Жащиеся в двух ци- |
|||
|
Тохромах |
672 |
||
|
116 фосфолипидов |
90 800 |
6 атомов меди |
218 |
|
144 дигалактозилдн- |
|||
|
Глицеридов |
134 000 |
||
|
366 моногалактозил- |
|||
|
Диглицеридов |
268 000 |
||
|
48 сульфолипидов |
41 000 |
||
|
Стероиды |
15 000 |
||
|
Неидентифицирован- |
175 000 |
||
|
Ные липиды |
|||
|
Итого |
988 400 |
Итого |
929 000 |
31 А соответствуют! Д гранулы. Таким образом, результаты исследования рассеяния рентгеновых лучей в какой-то мере согласуется с построением гранул из субъединиц. Однако нет полного соответствия между ■ данными электронной микроскопии и результатами изучения рассеяния рентгеновых лучей.
Два факта заслуживают особенного внимания — кристалло- подобная структура, показанная на рис. 7.20, и отсутствие полной фотосинтетической активности у частиц, имеющих размеры гранул. Возможно, что для такой активности необходим именно упорядоченный коллектив гранул, достаточно большой «кристалл». Высокая упорядоченность и периодичность структуры, не наблюдаемая в других мембранах, заставляет думать о возможности применения представлений физики твердого тела к механизму фотосинтеза (см. § 7.7). Это пока лишь гипотетические соображения. Вместе с тем, нельзя считать исключенными артефакты, создаваемые оттенением посредством 0s04 или КМп04, применяемым в электронной микроскопии [69] (ср. стр. 290).
(7.8)
Обработка детергентами (дигитонином) с последующим центрифугированием и электрофорезом позволяет определить содержание и состав белков в хлоропластах [171, 172]. Более детальная информация о расположении и ориентации белковых молкул в мембранах получена иммунологическими и другими методами. Установлено, что в хлоропластах имеются частицы двух сортов: легкие диаметром 70—110 А и тяжелые диаметром 150—180 А. Легкие частицы содержат больше Chi а, они способны к циклическому фосфорилированию и к восстановлению НАДФ+ в присутствии аскорбата [173]. Тяжелые частицы содержат больше Chi b, они способны восстанавливать на свету феррицианид (реакция Хилла) и проводить нециклическое фосфорилирование. На этих основаниях легкие частицы отождествляются с ФС/, тяжелые — с ФС//. На квадратном микрометре поверхности тилакоида содержится около 4000 легких частиц и около 2000 тяжелых [174]. Из изложенного следует, что число ФС / и ФС II должно быть примерно одинаково. Отсюда можно заключить, что в каждой тяжелой частице содержится две
ФС//.
В работающих хлоропластах наблюдаются медленные изменения поглощения при 4750 и 5150 А, происходящие за секунды [70]. В этих же спектральных областях наблюдаются быстрые изменения поглощения со временем появления полос, меньшим Ю-5 с, и временем исчезновения 20 мс [71]. Быстрые изменения являются индикаторами окислительно-восстановительных реакций. Установлено, что они происходят параллельно с фосфорилированием. Они отражают изменения электрического поля поперек мембраны, их исчезновение связано с транспортом протонов и других ионов. Действительно, при увеличении проницаемости мембраны для ионов в результате осмотического шока изменения исчезают быстрее. Это происходит и при действии разобщителей фосфорилирования, увеличивающих проницаемость для протонов. Наконец, ионофоры, такие как грамицидин D, увеличивающие проницаемость к щелочным ионам, также ускоряют исчезновение спектральных изменений [44], причем имеется четкая зависимость от концентрации грамицидина. Были проведены опыты со слоями Chi a, Chi Ь и каро - тиноидов на стеклянных пластинках. Слои подвергались действию электрических полей с напряженностью до 106В/см и измерялись изменения поглощения. Они оказались совпадающими с изменениями в хлоропластах, индуцированными светом [44]. Изменение поглощения А ЦІ = АЛ линейно зависит от изменения потенциала Atf
Z=q/C = a АЛ.
Здесь q — заряд, перенесенный через мембрану, С — емкость мембраны, примерно равная 1 мкФ, а ж 50 мВ/ДЛ. Кроме того, работает «молекулярный амперметр», и ток через него равен
![]()
При вспышке, вызывающей один оборот, через мембрану переносится два элементарных заряда е на одну электронную цепь. Из экспериментальных данных следует, что при этом Д-ф да да 50 мВ, при длительных вспышках Афтах ~ 200 мВ, а при стационарном освещении Аф да 100 мВ. Исследование световых реакций показывает, что поле создается наполовину реакцией в ФС / и наполовину — реакцией в ФСП [44].
С помощью стеклянного электрода и индикаторов обнаружены и изменения рН, сопровождающие фотосинтез. При убывании электрического поля одновременно нарастает рН [72]. Согласно оценке отношение числа поглощенных протонов к числу перенесенных электронов равно 2 (дальнейшие подробности см. в [44]).
Эти результаты качественно согласуются с хемиосмотиче - ской теорией Митчелла (см. § 6.4), согласно которой перенос электронов дает свободную энергию для фосфорилирования в форме градиентов ф и рН (см. также [73]).
При вспышке, вызывающей один оборот, Аф 50 мВ, но АрН очень мало, значительно меньше единицы. Значит, в этих условиях фотосинтез протекает независимо от АрН. Показано, что при единичной вспышке фосфорилирование действительно происходит за счет Аф с выходом АТФ 0,30 на вспышку и независимо от интервала между вспышками. Фосфорилирование блокируется грамицидином D. При значениях Аф, больших 50 мВ, количество возникающего АТФ пропорционально Аф. Отсюда следует, что электрическая энергия используется для продукции АТФ [74].
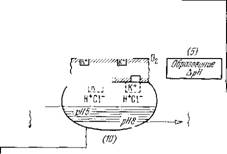
На рис. 7.22 показана общая схема сопряжения различных процессов в фотосинтезе, предложенная Виттом [44]. На рисунке показан участок тилакоидной мембраны. При фотосинтезе происходят следующие события, перенумерованные на рисунке:
Миграция и диссипация энергии. Энергия запасается и затем диссипирует в Саг*, а также в результате флуоресценции.
Световые реакции, описанные выше (см. стр. 366).
Образование электрического поля вследствие направленного переноса электронов перпендикулярно к мембране, определяемого анизотропной ориентацией молекул.
Перенос электрона и втекание в мембрану протонов в соответствии с теорией Митчелла (см. §§ 6.4, 6.5): два электрона на внешней стороне мембраны замещаются двумя ионами ОН, а две дырки (+) на внутренней стороне мембраны — двумя протонами. Возможный механизм протеолитические реакции, сопряженные с переносом электрона от Н20 к НАДФ+.
5. Образование АрН. Связанные ОН - и Н+ могут замещаться Ch и К+. ОН~ и Н+ диффундируют соответственно во внешнюю и внутреннюю фазы, что создает разность АрН.
![]()
У/\ - іу/у/^Я - уу/ум СЩ 50~г00мВ
По)
(1) ЇЩ ІЩ, (Z)\ CM а; ШдП
Миграция энергии
Световые реакции
Отражение паля
V (7)
|
К+сг |
К+сг |
|
|
К+0Н" |
' \ |
К+0Н" |
(4) I Перенес шетрона I — —
Химжееки управляемый
при/пен
К+0Н~ 1 К+0Н"
H+DH~ Н+0Н"
І і,
■с» АТФ
Метек iF - тЗ действием поля
//сток К+ лед действием поля
♦ I ц „
Л у уГ
ШнАш
Н Д Л ltl-Н+Н +W/M(ry/,
(В)
Исчезновение поля
АДФ •
Ос/ин aiopom (8)
|
Н+сг к+ |
Н+сг к+ |
|
F-цУ ] ІУґМ |
|
Н+ І Н+
Убыль V йрН
Образование АТФ
(3)
Диірірузиошв/й. притек К++ Н*
Рис. 7.22. Схема сопряжения молекулярных процессов в фотосинтезе по
Витту.
Управляемое полем истечение протонов и убывание АрН.
Управляемое полем истечение К*.
Диффузионная убыль АрН.
Фосфорилирование, сопряженное с разрядкой электрически энергизованной мембраны в соответствии с теорией Митчелла.
10. Регуляция внутреннего значения рН\ При рН1' да 8 Непроводимость мембраны больше, чем Непроводимость. При генерации Н+ (п. 4) возрастание [Н+]» замедляет поток электронов, что, в свою очередь, замедляет генерацию Н+. Возрастание [Н+]' увеличивает вытекание Н+, что происходит за счет вытекания К+. [Н+]* поддерживается на определенном уровне. Она возрастает с увеличением частоты вспышек или интенсивности света. В свою очередь, ускоряется процесс 6 и фосфорилирование (процесс 9).
Таким образом, энергия световых квантов заряжает мембрану. В правой части рис. 7.22 показано, как используется эта энергия.
Положения, суммированные в приведенной схеме, подтверждаются многочисленными и разнообразными опытными фактами. Однако механизмы соответствующих процессов еще не установлены, и эту схему следует пока считать гипотетической.
(7.10)
(7.П)
Вместе с тем, как подчеркивается в монографии [170], применение теории Митчелла к фотосинтезу встречается с трудностями при количественных оценках. В этой теории свободная энергия протонов должна превышать энергию фосфорилирования
ПцОн ^ Оф.
Здесь Оф да 0,5 эВ да 11,5 ккал/моль, пц — число протонов, перемещение которых приводит к фосфорилированию. В естественных условиях при Аф = 50 мВ и АрН « 2—2,5 имеем
Он = е Аф + /гбТ • 2,3 АрН да 0,18 эВ.
Следовательно, «н должно быть не менее трех [175, 176]. В работе [177] дается близкая оценка — утверждается, что для синтеза 1 моля АТФ нужны 4 протона. С другой стороны, из соотношения АТФ/е - = 2 и Н+/е~ = 2 следует, что на 1 моль АТФ расходуются 2 протона. В условиях импульсного освещения по-прежнему Аф = 50 мВ, а АрН = 0. Число протонов составляет 0,5/0,005= 10. Но отношения АТФ/е~ и Н+/е~ те же и, значит, не хватает энергии восьми протонов.
Таким образом, для применения теории Митчелла к фосфорилированию при фотосинтезе необходим дальнейший анализ, прежде всего уточнение количественных характеристик процесса.
Вместе с тем феноменологическая картина, следующая из всех имеющихся данных, хорошо согласуется с теорией Митчелла.